黄河三角洲盐碱地刺槐混交林对土壤脲酶活性的影响
2013-12-16刘云李传荣许景伟邴贝贝吕蒙蒙程玲
刘云,李传荣†,许景伟,邴贝贝,吕蒙蒙,程玲
(1.泰山森林生态站,山东农业大学农业生态与环境重点实验室,271018,山东泰安;2.山东省林业科学研究院,251014,济南)
土壤酶是土壤中具有生物活性的蛋白质,可以作为评价土壤肥力的指标[1],它不仅是外源有机物质腐解转化的驱动力,而且是土壤有机质转化、土壤结构及物理性状演变与保持的驱动力,在碳、氮、磷、硫等的生物循环中起重要作用[2]。土壤脲酶是一种酰胺酶[3],主要来源于土壤微生物的活动及植物根系的分泌物和动植物残体腐解过程中释放的酶[4],在土壤有机物中碳-氮键的水解作用中具有重要作用,其活性的提高能促进土壤有机氮向有效氮的转化[5],可以用于表示土壤的氮素供应状况。许多研究资料表明,脲酶活性与土壤肥力指标有很好的相关性,如关松荫[6]在研究茶园土壤和森林对土壤脲酶活性时指出,土壤脲酶可以作为评价土壤肥力的指标之一。刺槐(Robinia pseudoacacia)是黄河三角洲盐碱地改良土壤的优良树种。目前的研究大多集中在刺槐的生理机能和土壤水分方面[7-8],对营造刺槐林的改良土壤效果也给予了广泛的重视[9],但是刺槐混交林土壤酶活性的影响尚未引起充分的重视。笔者以黄河三角洲盐碱地防护林为研究对象,通过分析脲酶与刺槐林地土壤养分、土壤微生物、土壤水文特性和蓄水性能的关系,研究不同类型刺槐混交林地的土壤脲酶活性,并通过主成分分析法找出影响刺槐林地土壤脲酶活性的土壤因子,以期为黄河三角洲盐碱地土壤质量评价和土壤肥力的维持与改善提供科学依据。
1 研究地概况
研究地点位于山东省东营市河口区,属暖温带半湿润区大陆性季风气候,年均气温12.1℃,无霜期201 d,≥10℃的积温约4 200℃,年均降水量500~600 mm,7—8月降水量约占全年降水量的50%,且多暴雨,易形成旱涝灾害,年均蒸发量为1 962.1 mm。土壤为冲积性黄土母质在海浸母质上沉淀而成,机械组成以粉沙为主,沙黏相间,层次变化复杂。
天然植被以盐生、湿生的禾本科植物茅草(Imperata cylindrica)、芦苇(Phragmites communis)为主。主要造林树种有刺槐、杨树(Populus euramericana)、白蜡(Fraxinus chinensis)、柽柳(Tamarix chinensis)等。
2 研究方法
2.1 调查与采样
于2011年4和8月开展调查,分别代表旱季和雨季。在试验区选择刺槐+白榆(Ulmus pumila)混交林、刺槐 +臭椿(Ailanthus altissima)混交林、刺槐+白蜡混交林为研究对象,林龄均为26年,分别设置20 m×20 m样地(表1)。以刺槐纯林和无林地作对照。在选择的样地内根区,采用环刀法测定土壤的水文指标,采用十分法分别取0~10 cm、10~20 cm和20~40 cm 3层的土壤样品,每个样地3次重复,装入无菌袋中带回实验室。其中一部分用于土壤微生物的培养,另一部分风干,去除杂质过筛后,保存于冰箱中,用于测定土壤养分和土壤脲酶。在树木20 cm范围内挖取20 cm×20 cm×40 cm的土柱,分0~10 cm、10~20 cm和20~40 cm 3层取根系,每个林分重复3次。

表1 样地概况Tab.1 Survey of plot
2.2 测定方法
1)土壤脲酶质量分数的测定。脲酶质量分数用靛酚比色法测定,活性以24 h后1 g土壤中NH3-N 的质量(mg)表示[6]。
2)土壤水文物理特性和蓄水性能的测定。采用烘干法测定土壤含水量,环刀法测定土壤密度、总孔隙度等,并由公式计算一定土层深度内的毛管蓄水量和饱和蓄水量[10]。其中土壤涵蓄降水量的计算公式为
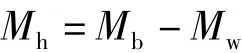
式中:Mh为土壤涵蓄降水量,mm;Mb为饱和蓄水量,mm;Mw为土壤含水量,mm。
3)土壤化学性质的测定。pH值采用电位法测定;含盐量采用质量法测定;全磷采用碳酸钠熔融-钼锑抗比色法测定;全N采用半微量凯氏法测定;速效钾采用乙酸铵提取-火焰光度法测定;碱解氮采用碱解扩散法测定;有机质采用重铬酸钾容量法测定[11]。
4)土壤微生物的培养。采用牛肉膏蛋白胨培养基培养细菌,高氏一号培养基培养放线菌,马丁氏培养基培养真菌,Ashby无氮培养基培养自生固氮菌[12]。
5)根系的质量。根系在烘箱中65°下烘干8 h,称量质量。
2.3 数据处理
采用SPSS 17.0和Excel软件进行相应的数据统计和分析。
3 结果与分析
3.1 不同林分类型的土壤脲酶活性
不同刺槐林地中,不同土层深度的土壤脲酶的质量分数见图1。由图1(a)可知,与CK相比,8月份造林地脲酶质量分数显著增加(P<0.05),其中RP、RU、RA和 RF的脲酶质量分数分别是 CK的4.02、4.74、5.01和 5.08 倍,而与 RP 相比,RU、RA和RF的质量分数分别增加了17.86%、24.62%和26.41%。在不同土层深度上,刺槐混交林地的土壤脲酶质量分数均高于刺槐纯林地,其中0~10 cm和20~40 cm土层的脲酶质量分数达到显著水平(P<0.05),10~20 cm差异不显著(P>0.05)。在同一林分中,土壤脲酶质量分数的变化趋势是0~10 cm>10~20 cm>20~40 cm,层次之间变化较明显。
4月份脲酶活性的变化规律和8月份大体相同(图1(b)),但是脲酶质量分数低于8月份,其中CK、RP、RU、RA和 RF分别降低了 18.95%、25.88%、27.83%、32.44%和32.24%。
同一林地中,土壤脲酶活性随土层的加深而降低,这与一些研究结果一致[13-15]。混交林较纯林提供了较多的枯枝落叶和营养元素等物质,改善了土壤理化性质,并且为微生物提供了充足的碳源,加之刺槐的固氮作用[16],促进了微生物的生理代谢活动[17],增加了微生物的数量,从而使混交林的土壤脲酶质量分数较纯林高。造林后枯枝落叶及腐殖质主要积累于土壤表层,上层有机物含量较高,进而导致微生物数量较下层多,加之表层水热条件和通气状况好,因微生物生长旺盛、代谢活跃、呼吸强度加大而使表层的土壤脲酶活性较高。随土层的加深,土壤密度増大,孔隙度减小,有机质也随着土层的加深而急剧下降,土壤微生物的活动会减弱,限制了生物代谢的强度,生物产酶能力随之下降[18]。由于纯林和混交林树种组成不同,土壤脲酶活性也会产生一定的差异。总体来看,造林显著增加了土壤脲酶的活性,而且混交林又优于纯林。
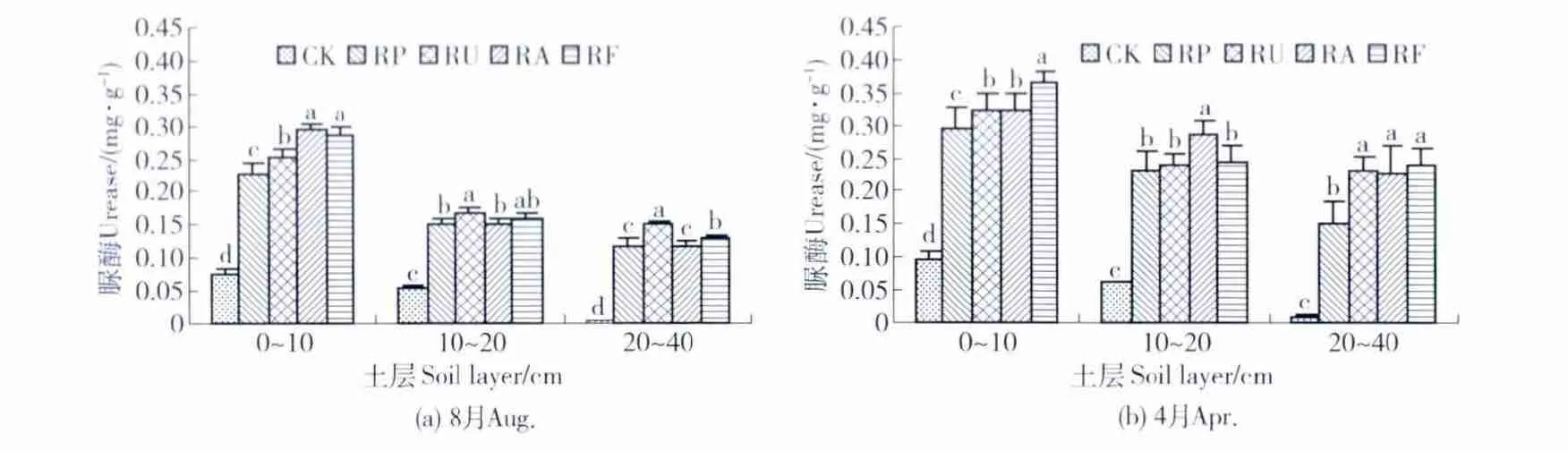
图1 不同林地土壤脲酶的活性Fig.1 Soil urease activity in different stands
3.2 不同林分类型土壤脲酶活性与土壤因子的关系
3.2.1 土壤水文物理特性和蓄水性能 由图2(a)可知,土壤密度随土层加深而增大,林地间差异不显著(P>0.05),与无林地差异显著(P<0.05),表现为无林地>刺槐纯林>刺槐混交林。由表2可知,4月份各林地的总孔隙度均随土层的加深而减小,且各土层上均表现为刺槐混交林>刺槐纯林>无林地。这与林地枯落物分解后腐殖质含量增加,有利于表层土壤团粒结构的形成有关。各林地的孔隙比分别比 CK增加了 23.1%(RP)、33.1%(RA)、27.1%(RU)和36.8%(RF)。土壤涵蓄降水量为RF(94.63 mm)>RA(90.91 mm)>RU(89.41 mm)>RP(79.84 mm)>CK(53.94 mm),有效涵蓄量与其大体一致。从空间变化来看,土壤饱和蓄水量、涵蓄降水量和有效涵蓄量均随土层的增加而减小。
8月份(图2(b)和表2)林分的水分物理特性和蓄水性能和4月份的大体规律相同,但各林分均优于4月份,表现为土壤密度减小、总孔隙度增加和涵蓄降水量增加等。
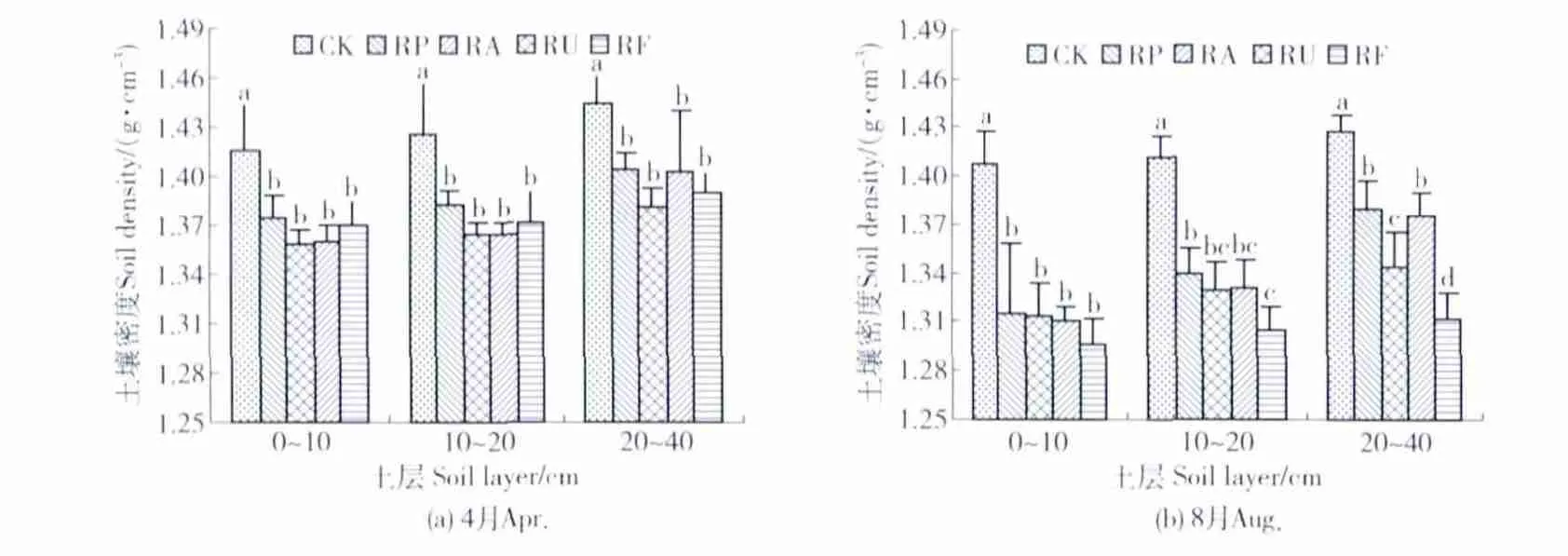
图2 图2 不同林分的土壤密度Fig.2 Soil density in different stands
3.2.2 土壤化学性质 4和8月份(表2、图3)各林地土壤养分与土壤脲酶的变化趋势大体一致。全氮、碱解氮、有机质质量分数均是随土层的增加而降低,且刺槐混交林>刺槐纯林>无林地;与无林地相比较,林地的pH值在0~20 cm土层均有一定程度的降低;4月份,林地10~20 cm含盐量高于其他层次(图3(a)),原因是林地降低了土壤蒸发量,减弱了盐分向表层的聚集,而无林地由于蒸发强烈,导致盐分表聚性明显;8月份,林地0~10 cm含盐量较低(图3(b)),这与盐分随降雨向下淋洗有关,且为CK > RF>RP >RA >RU(10~20 cm,RP >RF)。
3.2.3 土壤微生物和根系质量 由表2可以看出,8月份,刺槐混交林地土壤细菌个数>放线菌个数>真菌个数,这与大多数的研究结果相同[19]。其中细菌和固氮菌的数量均表现出随土层的加深而减少的趋势,而放线菌和真菌的数量主要集中分布在0~20 cm土层范围内,没有明显的规律性。这是因为细菌和放线菌适宜在中性或微碱性的环境中生活,而真菌一般生长在酸性土壤中。微生物总量方面,3种混交林地为无林地的2.4~2.8倍,刺槐纯林地为无林地的2.2倍,刺槐混交林地明显大于刺槐纯林地。由表2还可以看出,4月,土壤微生物数量略低于8月,变化规律与8月基本一致。
由于试验林均为26年生,其根系质量在一年内变化较小,故仅分析8月份根系。由表2可知,各样地林分根系分布差异显著(P<0.05),无林地草本丰富,根系集中于表层,而刺槐林地中根系大多集中于10~20 cm土层,40 cm以下土层出现土壤板结现象,根系较少。
3.2.4 土壤脲酶活性与土壤化学性质和土壤微生物数量的相关性分析 脲酶与土壤化学性质的关系(表3)表明:4月,刺槐混交林地脲酶质量分数与全氮、碱解氮、有机质质量分数显著正相关(P<0.01),与含盐量负相关(P<0.05),与全P、速效钾和pH值相关性不显著。8月与4月大体相同,不同点为与含盐量呈显著负相关(P<0.01)。
4和8月,刺槐混交林地脲酶活性和微生物的相关性基本相似(表3)。脲酶与固氮菌、细菌显著正相关,与放线菌正相关,与真菌相关性不明显,同时,脲酶与根量的相关性不显著。
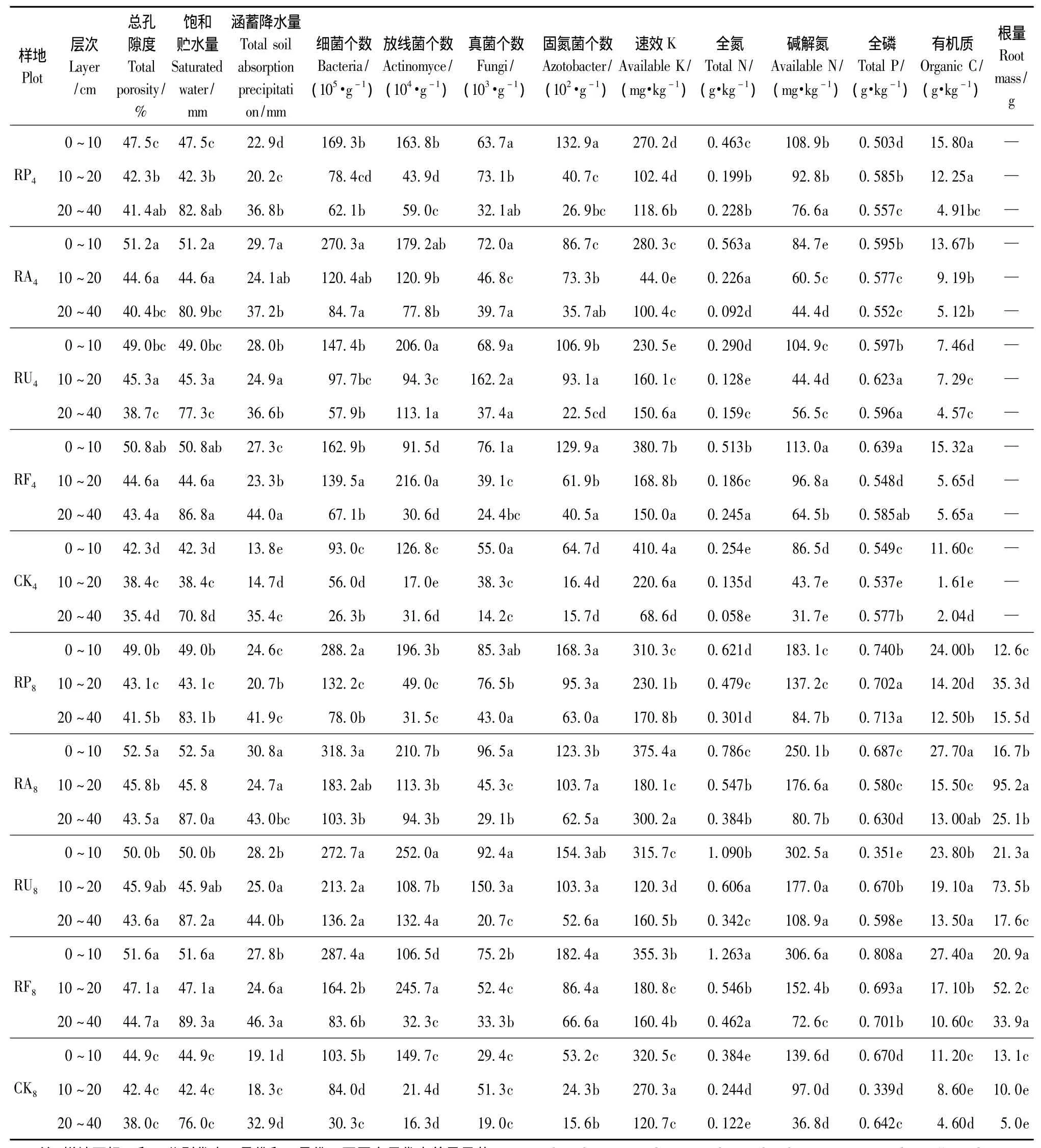
表2 不同林分的土壤理化性质、微生物和根量Tab.2 Soil physic-chemical properties,microbes and root weight in different stands
3.3 土壤脲酶活性各影响因子的主成分分析
对研究区的土壤微生物、土壤化学性质、土壤水文物理特性和蓄水性能等共16个指标(土壤密度、总孔隙度、饱和蓄水量、涵蓄降水量、细菌个数、放线菌个数、真菌个数、固氮菌个数、根量、pH值、含盐量、速效钾质量分数、全氮质量分数、碱解氮质量分数、全磷质量分数和有机质质量分数)进行主成分分析,结果见表4。可知,仅需要4个主成分就可解释超过85%的信息。第1主成分中,总孔隙度、细菌、固氮菌、全N、碱解氮和有机质的系数值较大,方差贡献率达52.325%,说明土壤的通透性以及氮元素质量分数对脲酶的活性有较大的影响;第2主成分主要解释了土壤蓄水性能,如饱和蓄水量和涵蓄降水量,方差贡献率达到14.533%;第3主成分主要是pH值的信息,方差贡献率达到13.250%,说明pH值通过对元素以及微生物的影响间接影响脲酶的活性;第4主成分是全P的信息,方差贡献率为6.804%。从评价脲酶活性的角度看,可知总孔隙度、细菌个数、固氮菌个数、全N质量分数和有机质质量分数可以作为主要指标。
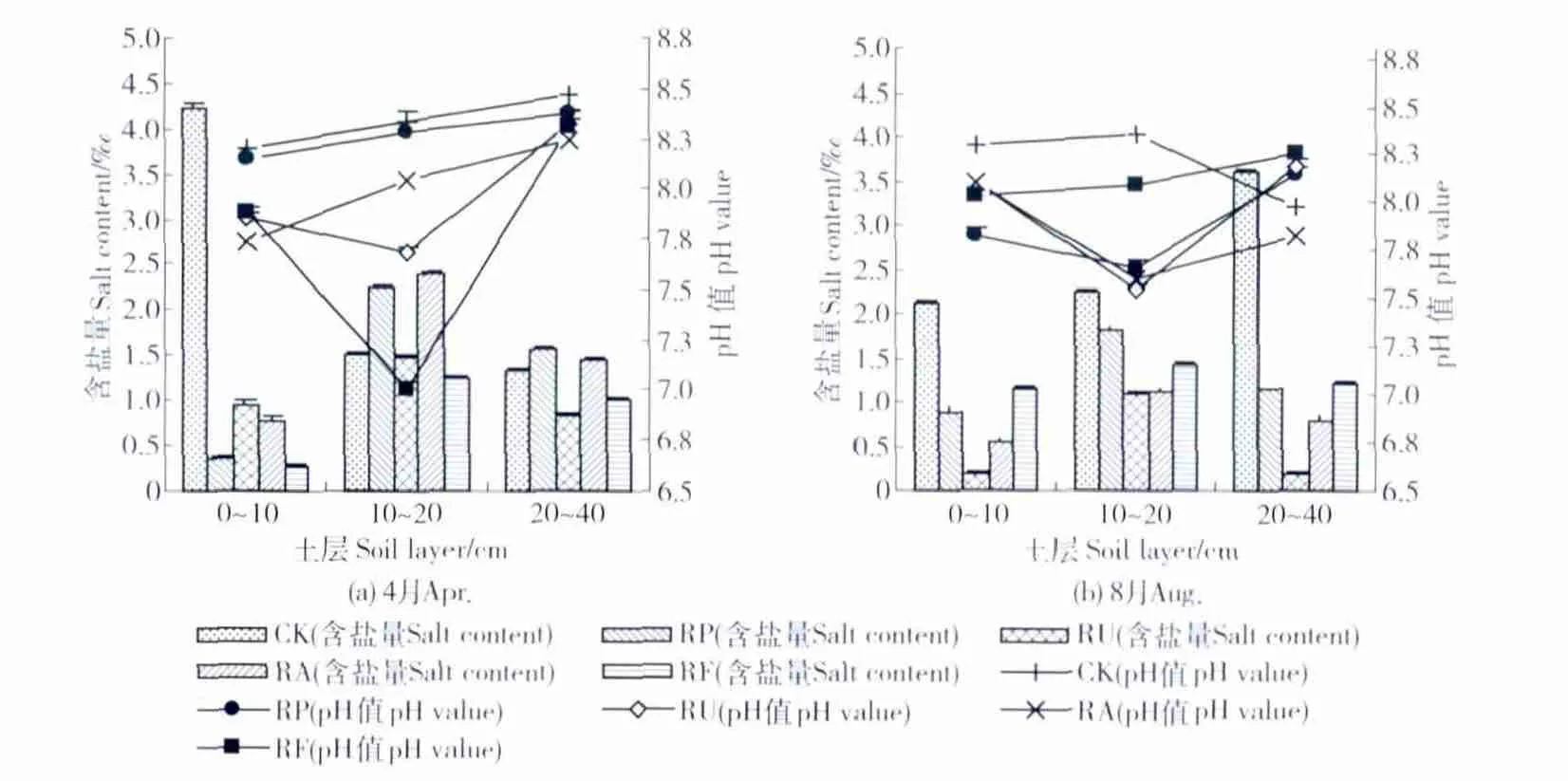
图3 不同林分的含盐量和pH值Fig.3 Salt content and pH value in different stands

表3 土壤脲酶活性与土壤化学性质和土壤微生物数量的相关性分析结果Tab.3 Correlation analysis among urease activity,soil chemical properties and microbes quantity
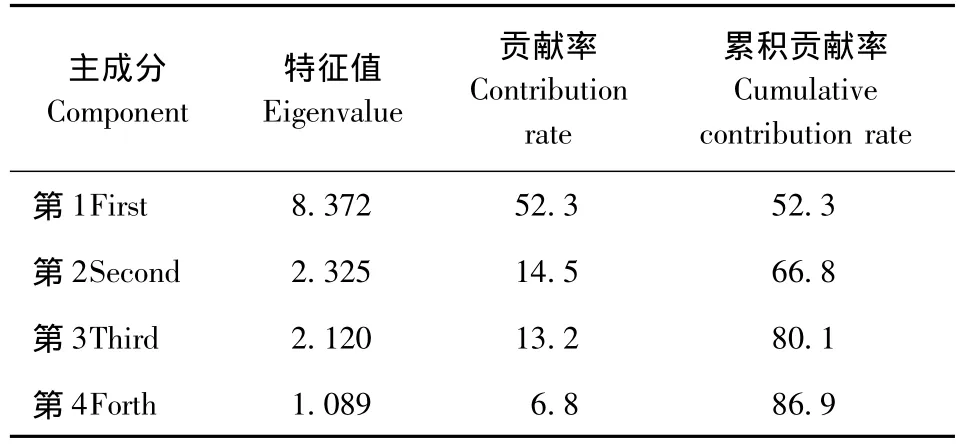
表4 土壤脲酶活性影响因子的主成分分析及结果Tab.4 Principal component analysis and results of influencing factors on soil urease activity
4 结论与讨论
1)黄河三角洲盐碱地地区植被恢复后,土壤中脲酶活性有较大的增加,且表现出混交林优于纯林的趋势。
2)刺槐混交林地土壤脲酶质量分数与全氮、碱解氮、有机质质量分数显著正相关,与全P、速效钾质量分数及pH值相关性不显著,与含盐量负相关。表明土壤脲酶质量分数与土壤养分具有一定的相关关系,可在一定程度上反映土壤的肥力水平。
研究土壤微生物数量和土壤酶活性与林地土壤肥力的关系,能够揭示林地土壤发育的现状和趋势,可用于评价林地土壤肥力以及各种林业技术措施的效果,为林业的持续健康发展提供科学依据[20]。微生物数量越多,土壤物质转换越强[19]。本研究刺槐混交林地脲酶质量分数与土壤中主要微生物种类(细菌和放线菌)的相关性均较好,进一步表明脲酶可以作为评价土壤肥力的指标。
3)刺槐混交林地土壤养分、土壤微生物、土壤水文物理特型和蓄水性能对土壤脲酶的活性均有一定的影响,其中总孔隙度、细菌个数、固氮菌个数、全N质量分数和有机质质量分数的影响较大,因此可作为评价土壤脲酶活性的主要指标。
本实验涉及的影响脲酶的因子较多,工作量较大,通过主成分分析方法,可以用较少的指标代表大量指标,既可以达到较准确反映土壤脲酶活性的作用,又可以减少工作量。
[1] 孙权,陈茹,宋乃平,等.宁南黄土丘陵区马铃薯连作土壤养分、酶活性和微生物区系的演变[J].水土保持学报,2010,24(6):208-212
[2] 孙波,赵其国,张桃林,等.土壤质量与持续环境:Ⅲ.土壤质量评价的生物学指标[J].土壤,1997(5):225-234
[3] 董丽洁,陆兆华,贾琼,等.造纸废水灌溉对黄河三角洲盐碱地土壤酶活性的影响[J].生态学报,2010,30(24):6821-6827
[4] 万忠梅,吴景贵.土壤酶活性影响因子研究进展[J].西北农林科技大学学报:自然科学版,2005,33(6):87-92
[5] 薛冬,姚槐应,何振立,等.红壤酶活性与肥力的关系[J].应用生态学报,2005,16(8):1455-1458
[6] 关松荫.土壤酶及其研究法[M].北京:农业出版社,1986:294-297
[7] 于占辉,陈云明,杜盛.黄土高原半干旱区人工林刺槐展叶期树干液流动态分析[J].林业科学,2009,45(4):53-59
[8] 李军,王学春,邵明安.黄土高原不同密度刺槐林地水分生产力与土壤干旱化效应模拟[J].生态学报,2008,28(7):3125-3141
[9] 郗金标,邢尚军,宋玉民,等.黄河三角洲不同造林模式下土壤盐分和养分的变化特征[J].林业科学,2007,43(增刊 1):33-38
[10]陈立新.土壤实验实习教程[M].哈尔滨:东北林业大学出版社,2005:17-82
[11]鲁如坤.土壤农业化学分析方法[M].北京:中国农业科学出版社,1999:147-211
[12]沈萍,范秀容,李广武.微生物学实验[M].北京:高等教育出版社,2004:50-74
[13]李传荣,许景伟,宋海燕,等.黄河三角洲滩地不同造林模式的土壤酶活性[J].植物生态学报,2006,30(5):802-809
[14]王成秋,王树良,杨剑虹,等.紫色土柑橘园土壤酶活性及其影响因素研究[J].中国南方果树,1999,28(5):7-10
[15]唐艳,杨林林,叶家颖.银杏园土壤酶活性与土壤肥力的关系研究[J].广西植物,1999,19(3):277-281
[16] Pastor J,Binkley D.Nitrogen fixation and the mass balances of carbon and nitrogen in ecosystems[J].Bingeochemistry,1998,43(1):63-78
[17]张超,刘国彬,薛萐,等.黄土丘陵区不同林龄人工刺槐林土壤酶演变特征[J].林业科学,2010,46(12):23-29
[18]安韶山,黄懿梅,郑粉莉,等.黄土丘陵区草地土壤脲酶活性特征及其与土壤性质的关系[J].草地学报,2005,13(3):233-237
[19]周德庆.微生物学教程[M].北京:高等教育出版社,2002:247-248
[20]张猛,张健.林地土壤微生物、酶活性研究进展[J].四川农业大学学报,2003,21(4):347-351
