采用HBL101萃取石煤高酸浸出液中的钒
2013-12-15李青刚齐兆树莫兴德廖宇龙
李青刚,许 亮,齐兆树,莫兴德,廖宇龙
(中南大学 冶金科学与工程学院,长沙 410083)
我国石煤提钒工艺起步于20世纪70年代末期,经过 30年的发展,目前在钒行业中已占据重要的地位。据统计,目前石煤提钒的产量已达到我国钒总产量的45%左右。近年来,由于钒的市场价格急剧下降,环境要求日益严格,生产成本较高,大部分石煤提钒厂处于停产状态,仍在生产的少数几家也处于亏本或持平状态,因此技术改革、降低生产成本迫在眉睫。目前石煤提钒的生产工艺主要有:钠化焙烧、钙化焙烧、酸浸萃取、碱法工艺等。钠化焙烧工艺对环境造成巨大破坏,在我国很多地方已禁止使用。钙化焙烧由于技术的原因,目前在国内还没有产业化的先例。碱法工艺对矿石适应性差,目前国内只有两家工厂采用。酸浸萃取工艺具有钒的回收率高、可自动化操作的特点,应用广泛,成为目前石煤提钒的主流工艺。
当前国内萃取钒的工业中常用的萃取剂有碱性萃取剂、中性萃取剂、酸性萃取剂等,其中应用较为成熟的是酸性磷类萃取剂 P204[1]。在P204萃取石煤酸浸液的钒之前一般需要用碱中和石煤酸浸出液中的酸,再用硫代硫酸钠还原溶液中高价态的钒,由于料液的中的酸经中和后减少,很难循环使用,因此试剂消耗量大[2-8]。伯胺N1923萃取钒(Ⅴ),在pH值为2时,钒(V)萃取率能达到95%以上,而pH大于6时萃取率不到35%[9-10]。刘波等[11]采用N263从钒(Ⅴ)溶液中回收钒(Ⅴ),研究发现萃取料液的pH值控制在5~7时,萃取率达90%以上。张云等[12]在石煤酸浸液中采用三正辛胺萃取钒(Ⅴ),并以TBP为协萃剂,结果发现在pH值为2~3时萃取速度快,萃取率大于98%。伯胺N1923、N263和三正辛胺用于萃取钒(V)时,对溶液的pH要求比较苛刻,工业上一般不采用。姚宝书[13]采用TBP对偏钒酸铵进行萃取研究,发现在浓度为0.5 mol/L NH4VO3的HCl溶液中,O/A=1/1、室温下,萃取率可达98%以上,关于其工业应用未见报道。沈明伟等[14]研究了P507分离钒(Ⅳ)、钼(Ⅵ),发现在用P507+磺化煤油组成的有机相萃取石煤酸性浸出液中的钒(Ⅳ)的同时,溶液中的钼也被萃取,且常温下,O/A=1/2时,经5级逆流萃取,钼(Ⅵ)、钒(Ⅳ)的萃取率均达到98%以上。P507对钒(Ⅳ)、钼(Ⅵ)的选择性较差,因此难以应用于工业生产中。刘玉国等[15]研究了P538环己烷溶液萃取硫氰酸钒(Ⅴ)的机理,研究发现在温度为20℃的条件下,萃取机理为 VO+2离子与萃取剂电离出的H+交换,萃合物的组成中n( VO+2):n(HA-)=1:1,但其萃取效果并未见详细报道。KIM等[16]报道了采用乙酰丙酮从废催化剂苏打浸出液中萃取钼(Ⅵ)、钒(Ⅴ)的研究,钒(Ⅴ)的萃取率接近100%。但没有关于该研究成果更进一步的详细报道。
综上所述,目前钒萃取的研究及工业生产上存在工艺流程长、循环利用效果差、生产成本高、萃取剂选择性差、溶液的酸碱度要求严格等不足。此外,未见从高酸浸出液中直接萃取钒的报道。为了克服上述不足,同时解决高酸条件下萃取钒的问题,本文作者首次提出了在不对石煤高酸浸液进行中和处理的情况下,用氧化剂将高酸溶液中低价态钒氧化为钒(Ⅴ),然后用肟类萃取剂HBL101直接从高浓度的硫酸浸出溶液中选择性萃取钒;其中萃余液的酸度不降低,可返回用于浸出;减少了 P204萃取工艺中浸出液的中和、还原和反萃液氧化等工序,降低了试剂的消耗,节约了生产成本,提高了生产效率。肟类萃取剂常用于从水溶液中萃取铜、钴、镍等,其用于萃取钒曾有学者研究。ZENG等[17]进行了用肟类萃取剂LIX63从酸性溶液中萃取回收钼(Ⅵ)、钒(Ⅴ)的研究,结果显示,在pH值为1~2时该萃取剂可以从含Fe的溶液中选择性萃取钼(Ⅵ)、钒(Ⅴ),其研究也停留在酸度较低的条件下,未见高酸条件下萃取钒研究的报道。
1 实验
1.1 实验试剂与设备
1.1.1 实验试剂
萃取剂主要有 HBL101,这是一种肟类螯合萃取剂,国内某厂提供;稀释剂为磺化煤油。
料液为国内某公司提供的高浓度的石煤硫酸浸出液,料液酸度为1.458 mol/L,在本实验中提到的酸度均为H+浓度,其单位均为mol/L,其成分见表1。
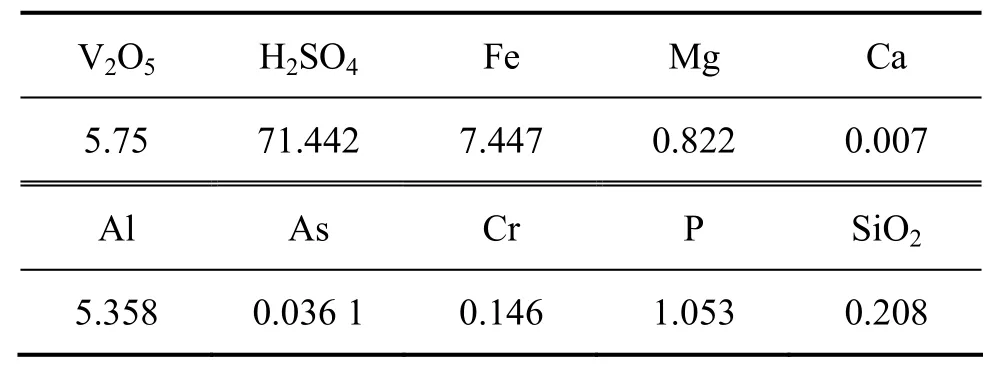
表1 料液各组分的浓度Table1 Chemical components of feed solution (g/L)
1.1.2 实验设备
125 mL/250 mL梨型分液漏斗,康氏振荡器,pH/ORP-4571酸度计/氧化还原电位计,电感耦合等离子体发射光谱仪。
1.2 实验原理
由于萃取剂是肟类螯合萃取剂,被萃取的金属阳离子与HL作用生成螯合物MLn,进入有机相生成萃合物,其反应方程如下:
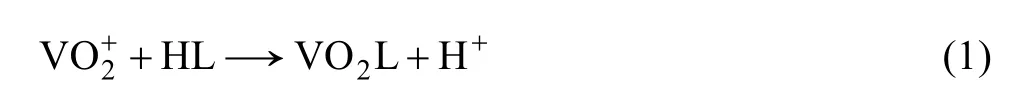
负载有机相反萃采用NaOH溶液,其中Na+与萃合物中的 VO+2交换,Na+进入有机相发生反萃反应,其反应方程式如下:
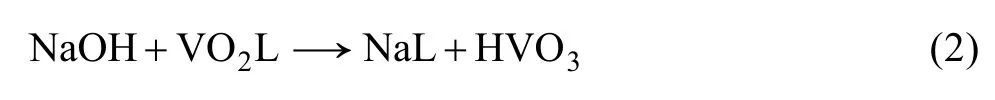
1.3 实验方法
(1) 料液预处理:实验前将沉淀过滤后,向料液中加入氯酸钠进行氧化,氧化时搅拌30 min,搅拌结束后静置8~24 h。(2) 有机相的配制:按萃取剂与稀释剂体积比为1:9,量取有机相于烧杯内,充分搅拌,使其混合均匀即得所需的有机相。(3) 萃取实验:先量取一定体积有机相装入125 mL分液漏斗,再量取需要量的料液,加入装有有机相的分液漏斗,根据要求的萃取条件,将分液漏斗放入水浴恒温振荡器中匀速振荡,根据实验要求的时间等条件来控制振荡过程,振荡结束后,取出分液漏斗,置于萃取架分层。分析萃余液中各元素的浓度,计算萃取率(E)。

式中:[Me]a为萃余液中离子浓度,g/L;[Me]o为料液中离子浓度,g/L;Va为萃余液的体积,L;Vo为料液的体积,L。
2 结果与讨论
2.1 料液酸度对各元素萃取率的影响
实验料液:用NaClO3将料液氧化到电位950 mV,静置24 h以上开始实验,料液中V2O5浓度5.75 g/L。
萃取条件如下:O/A为1/2,萃取时间为10 min,分相时间3 min,温度为28℃,水相体积为60 mL,实验结果如图1所示。
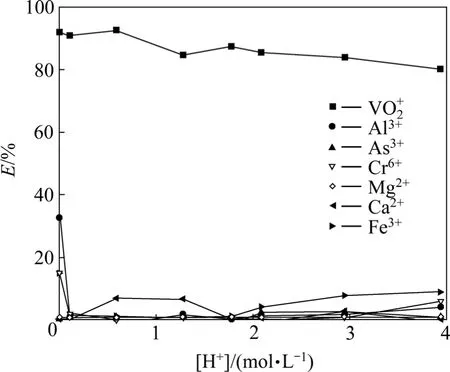
图1 酸度对各元素萃取率的影响Fig.1 Effect of [H+]on extraction of elements
从图1可看出,溶液酸度对钒的萃取率影响不显著。随着酸度的增加,钒的萃取率呈略微下降的趋势,在O/A=1/2、酸度为4 mol/L时钒的单级萃取率仍然达到80%以上。从萃取原理 Mn+(aq)+nHL(org)=MLn(org)+nH+(aq)看出,在高酸条件下钒与萃取剂的结合能力大于H+及其他金属杂质离子的结合能力。随着酸度的降低,从图1可以出,少量Fe、Al离子被萃取,分析认为,酸度的降低使萃取平衡反应向右移动,有利于萃取金属离子,Fe3+、Al3+与萃取剂结合能力随着酸度的降低而增强,故有少部分 Fe3+、Al3+在低酸条件下被萃取。其中,Ca2+在酸度为0.5~1.5 mol/L时,也有少部分被萃取,但Ca2+的总浓度为0.007 g/L,可能是由于存在分析误差,使其萃取率接近 8%。而在各酸度条件下钒的萃取率均在80%以上,而其他杂质的萃取率较低,说明该萃取剂在0~4 mol/L酸度条件下对钒(Ⅴ)具有较好的选择性,可以直接从高酸溶液中萃取钒(Ⅴ),同时达到与Fe3+、Al3+等杂质分离的效果。
2.2 料液电位对钒、铁、钙、镁萃取率的影响
实验料液:用NaClO3将料液氧化到电位分别为445、578、605、782、884、956、1 072、1 135 mV,静置24 h后再萃取,料液酸度为1.458 mol/L。
萃取条件如下:O/A为1/1,萃取时间为10 min,分相时间3 min,温度为28℃,水相体积为50 mL,考察溶液电位对萃取的影响,实验结果如图2所示。
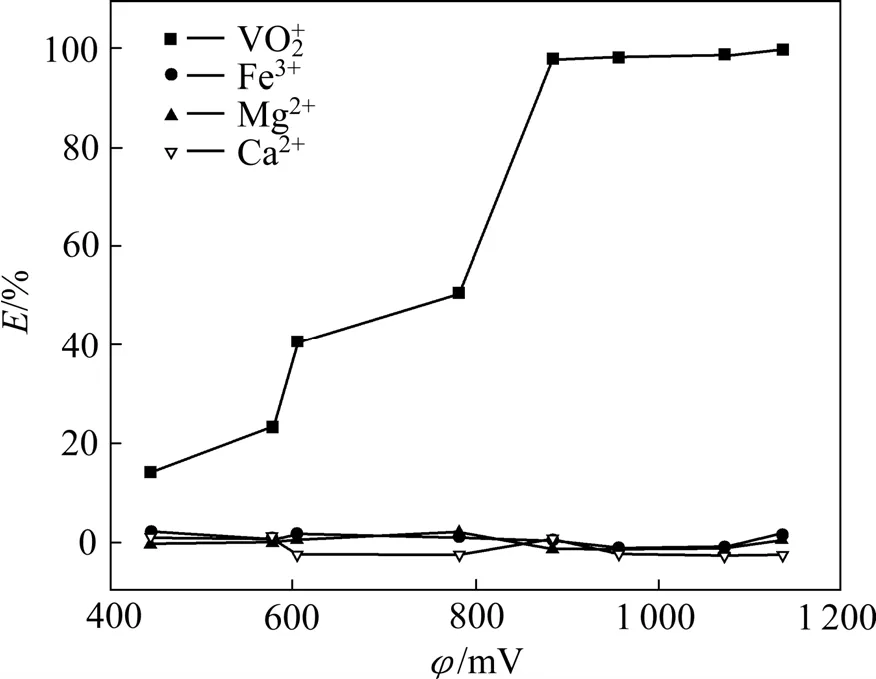
图2 料液电位与萃取率的关系Fig.2 Effect of potential of feed solution on extraction of metals
由图2可看出,钒的萃取率随电位的增大呈上升趋势。且当电位在850~900 mV 时,钒的萃取接近100%,而高于该电位范围时,钒的萃取率基本不发生改变。根据钒水溶液φ—pH图[18]可知,在溶液酸度为1 mol/L、电位在900 mV以上钒是以VO+2形式存在。结合图2可知,在电位低于850 mV时,钒大部分是以VO+2和VO2+阳离子形式存在,随着电位的升高,溶液中 VO+2占的比例升高,而萃取率也随着电位的增大而升高,说明该萃取剂对VO+2具有较好的萃取效果。随着电位的变化,溶液中Fe的价态也在变化,在低电位时,Fe以Fe2+形式存在,随着电位的升高,由Fe2+变成Fe3+,而Fe的萃取率不管电位如何变化几乎为零。溶液中的Ca2+、Mg2+的价态不随电位的变化而发生改变,其萃取率几乎都为零,实验结果表明该萃取剂对VO+2具有较高的选择性,避免了Fe2+、Fe3+、Mg2+、Ca2+等离子给湿法冶金分离带来的困扰。
2.3 萃取时间对钒和铁萃取率的影响
实验料液:用NaClO3将料液氧化到电位880 mV,静置24 h开始实验,料液[H+]为1.458 mol/L,料液中V2O5浓度为5.75 g/L。在本文作者的后续实验的料液均与本实验的相同。
萃取条件如下:O/A为1/1,分相时间为3 min,温度为28℃,水相体积为50 mL,实验结果如图3所示。
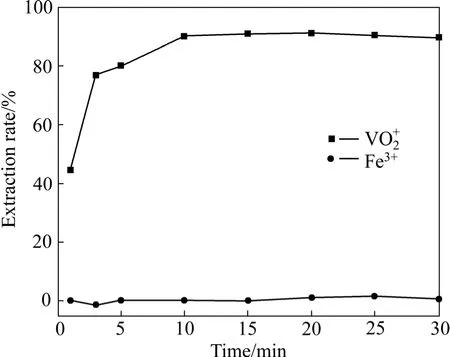
图3 萃取时间与钒萃取率的关系Fig.3 Effect of time on extraction of metals
从图3可看出,在10 min内,VO+2萃取率随着时间的延长而提高,当萃取时间超过10 min时萃取率基本不变,即该萃取剂萃取钒在10 min左右达到了萃取平衡,故选择最佳萃取时间为10 min。而不管时间如何变化铁萃取率几乎为零,由于料液经过预处理,料液中的铁为Fe3+,说明该萃取剂能有效地分离 VO+2和Fe3+。
2.4 萃取相比对钒萃取率的影响
萃取条件如下:萃取时间为10 min,温度为28℃,分相时间为3 min,有机相体积为30 mL,实验结果如图4所示。
从图4可以看出,随着O/A的减小钒萃取率降低,对于含10%的肟类萃取剂,O/A=1/1时其单级萃取率在95%以上,相比越小,水溶液中的钒(Ⅴ)含量越高。为了保证浸出液的萃取率,应采取相比1/1。在实际生产中,采用相比1/1,通过改变水相和有机相流量来保证有机相的饱和萃取。
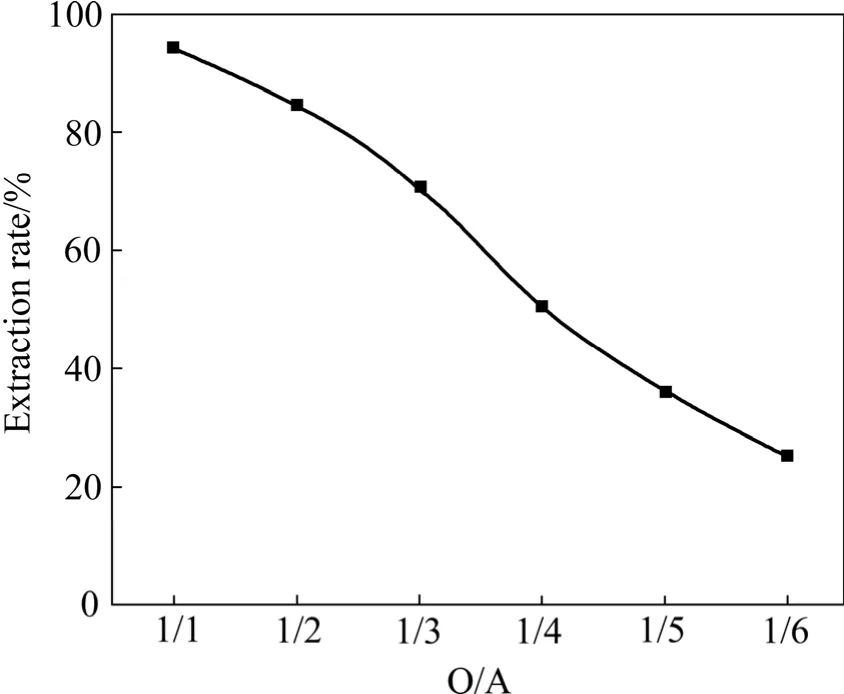
图4 相比对钒萃取率的影响Fig.4 Effect of O/A on extraction of vanadium
2.5 萃取温度对钒和铁萃取率的影响
萃取条件如下:O/A=1/1,萃取时间为10 min,分相时间为3 min,水相体积为50 mL,实验结果如图5所示。

图5 温度对萃取的影响Fig.5 Extraction of temperature on extraction of vanadium
从图5可看出,肟类萃取剂在低温下其萃取钒(Ⅴ)的效果并没有达到最佳,这可能与温度低萃取反应的活性低有关。35~45℃时,萃取率达到最高,随着温度升高萃取率反而降低。因为温度过高,肟类萃取剂会发生突变[19],有机相的挥发增大,造成有机相的损失增大。同时温度越高对能源的需求也越多。故萃取钒的最佳温度应该为35~45℃。不管温度如何变化,Fe的萃取率几乎为0,说明温度改变不会使该萃取剂萃取铁。
2.6 钒萃取等温曲线
在相比O/A=1/1、温度为28℃、萃取时间为10 min时,采用相比法测定萃取饱和量,绘制萃取等温曲线如图6所示。
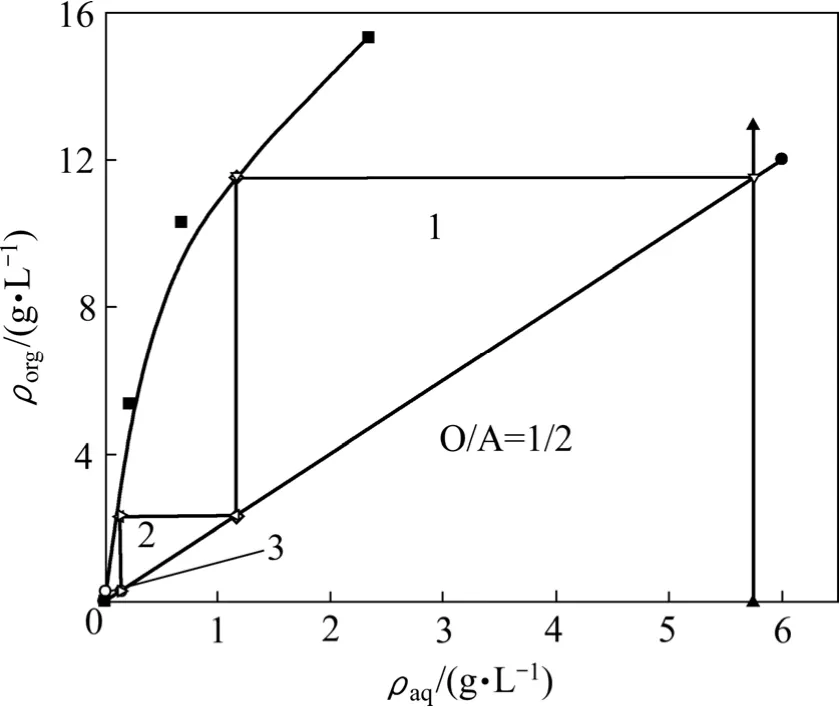
图6 钒(Ⅴ)的萃取等温曲线Fig.6 Isotherm extraction curves of vanadium(V)
从图6可以看出,在有机组成为10%HBL101+90%磺化煤油的饱和萃钒量(V2O5)为15.28 g/L左右。由图6可知,钒(Ⅴ)的萃取等温线的斜率较大,说明钒(Ⅴ)在该萃取体系中萃取性能较好。依照逆流萃取原理,绘制马克凯勒—齐利图,设萃余液中钒(Ⅴ)浓度为0.03 g/L时,按照相比 O/A=1/2操作线,绘制钒(Ⅴ)的操作曲线,从图6可以看出,通过三级逆流萃取,水相中的钒(Ⅴ)浓度可以降低至0.03 g/L。因此,该萃取体系需经过三级逆流萃取提取钒(Ⅴ)。
2.7 三级逆流实验
在本实验中,进行了6组三级逆流萃取实验,操作流程图如图7,图中A代表水相,O代表有机相,方框代表梨形分液漏斗。萃取条件如下:t=30℃,O/A=1/2.4,接触时间10 min,分相时间3 min,V0=30 mL。图7中,A1、A2、A3、A4、A5、A6分别表示三级迸流萃取后的萃余液,O1、O2、O3、O4、O5、O6分别表示三级迸流萃取的负载有机相。实验结束后,用硫酸亚铁铵滴定法分析 A1、A2、A3、A4、A5、A6中的钒浓度,用ICP分析A6中各杂质金属离子的浓度。实验结果分别见表2和表3。由表2可知,采用三级逆流萃取,萃余液中钒浓度低于0.02 g/L,钒的萃取率达到99.7%以上。从表3可以看出,料液中的杂质金属离子萃取率几乎为零,说明萃取剂对钒具有较高的选择性。
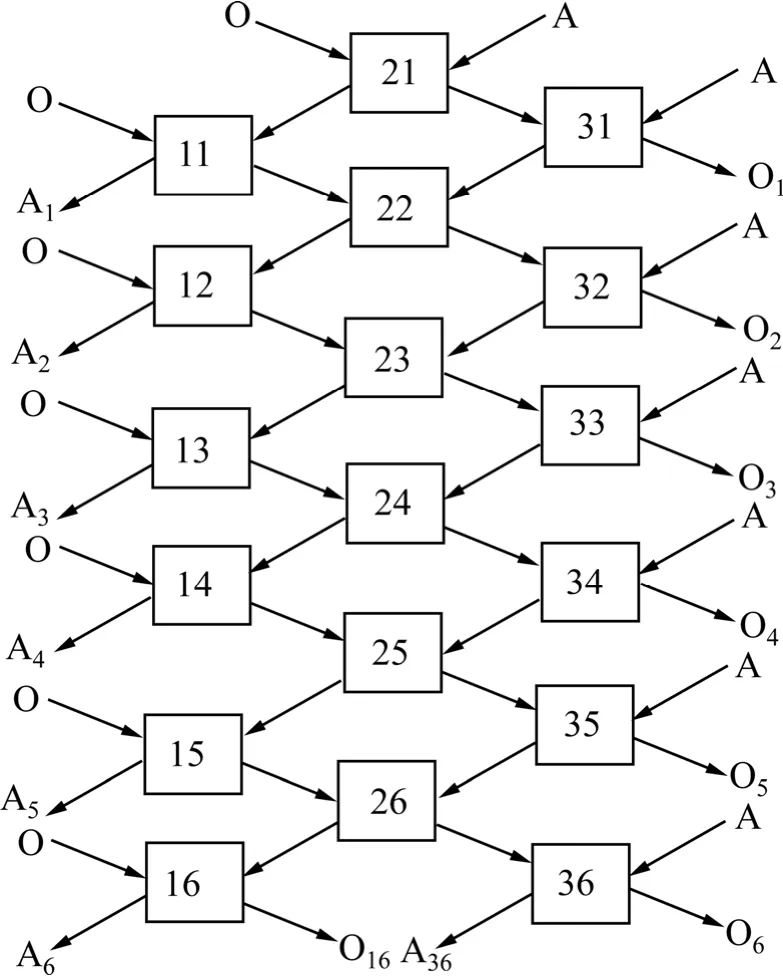
图7 三级逆流萃取模拟实验流程Fig.7 Flowchart of simulated three-stages counter current extraction
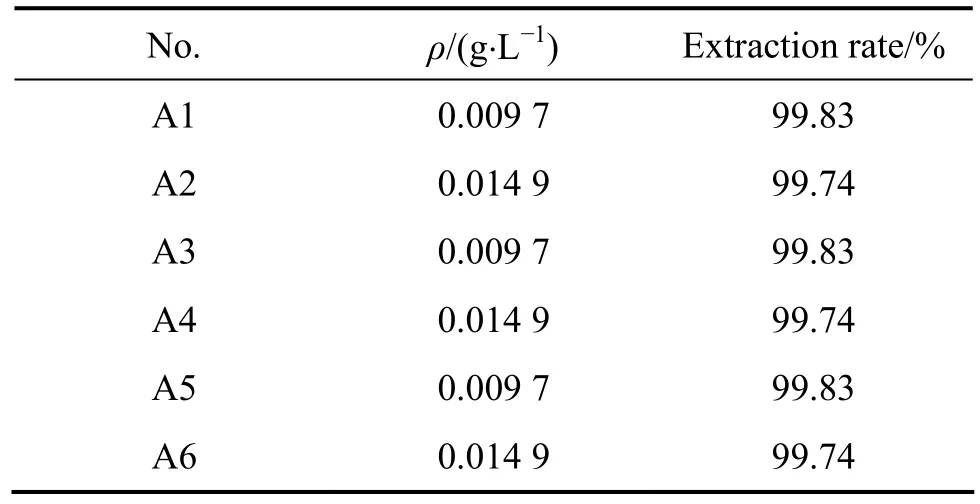
表2 钒的三级逆流模拟试验结果Table2 Vanadium of simulated three-stage counter current extraction
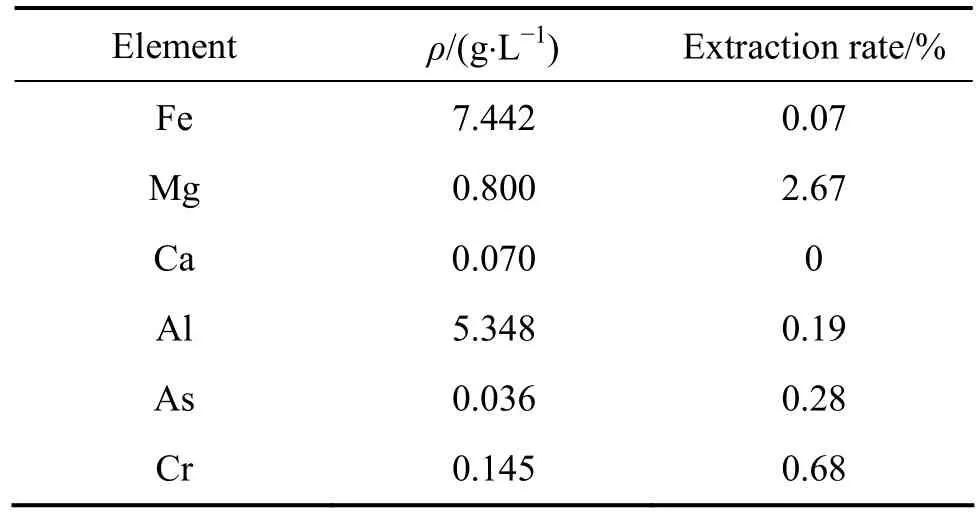
表3 A6中各种杂质金属离子的实验结果Table3 Metals of simulated counter current extraction in A6
将按照图7所示操作流程图实验得到的负载有机相O1、O2、O3、O4、O5、O6混合后,用1 mol/L 的NaOH按O/A=1/1,在室温下反萃30 min得到的反萃液调节pH为8.8后采用铵盐直接沉钒,得到的偏钒酸铵烘干后煅烧得到V2O5,采用ICP分析V2O5中各杂质含量,结果见表4。
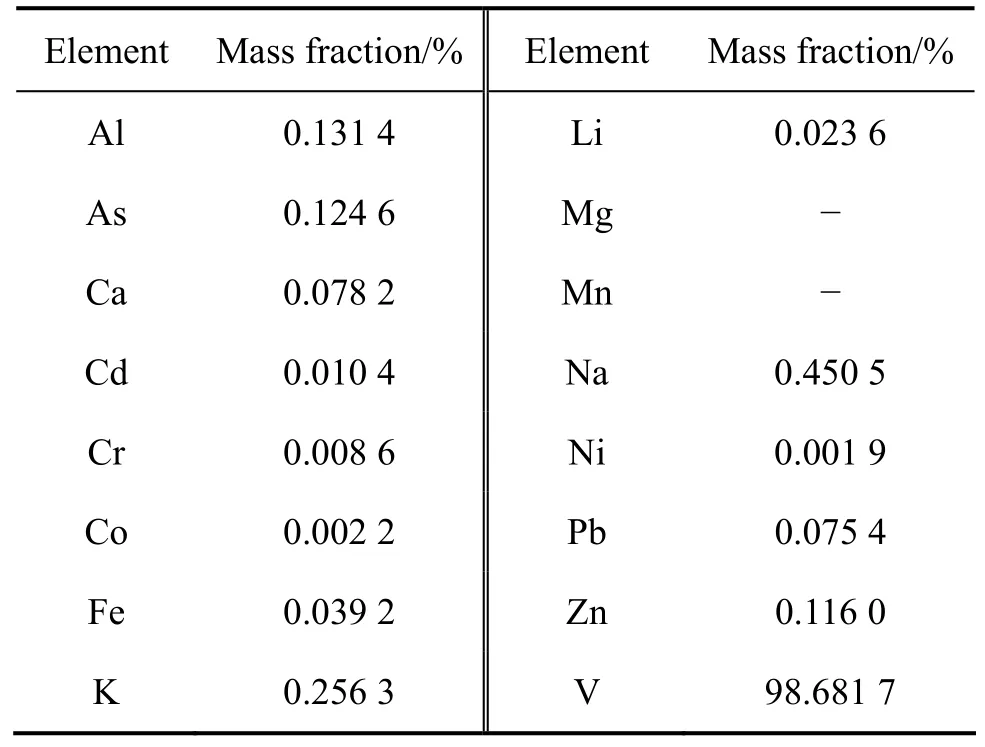
表4 五氧化二钒中主要杂质元素的质量分数Table4 Major impurity contents in V2O5
从表4可以看出,负载有机相直接反萃后得到反萃液,反萃液直接沉钒得到的产品纯度达到98.68%。该萃取剂不萃取料液中的Fe等元素,所得萃余液的钒(Ⅴ)含量均较低,且分相速度快,得到的反萃液可直接沉钒,最终得到的产品纯度达到98.68%以上。
3 结论
1) HBL101能在酸度为0~4 mol/L的范围内萃取VO+2,且不萃取Fe3+、Al3+、Ca2+、Mg2+等杂质金属,具有较优良的选择性。
2) HBL101萃取石煤高酸溶液中V2O5的最佳萃取条件如下:温度 35~45℃,萃取时间 10 min,O/A=1/1,在该条件下钒(Ⅴ)的单级萃取率达到95%以上。
3) 通过 HBL101萃取等温曲线求得逆流萃取的理论级数为3级,经3级逆流萃取,钒的萃取率达到99.68%以上。
4) HBL101不需要调节酸度,可直接萃取料液,节约了生产成本,降低了环境污染。其萃取饱和量相比P204大,达到15.28 g/L,该萃取剂应用于工业生产能有效地避免 P204萃取工艺中的中和调酸、还原等步骤,且该萃取剂 VO+2具有较高的选择性,避免了湿法冶金中Fe3+的干扰。负载有机相反萃后,反萃液经调节pH值后,可直接用氯化铵沉钒,同样也避免了P204萃取工艺中反萃液氧化后沉钒。
[1]李尚勇, 谢 刚, 俞小花.从含钒的浸出液中萃取钒的研究现状[J].有色金属, 2011, 63(1): 100-104.LI Shang-yong, XIE Gang, YU Xiao-hua.Vanadium extraction with acidic medium[J].Nonferrous Metals, 2011, 63(1):100-104.
[2]鲁兆伶.用酸法从石煤中提取五氧化二钒的试验研究与工业实践[J].湿法冶金, 2002, 21(4): 175-183.LU Zhao-ling.Investigation and industrial practice on extraction of V2O5from stone coal containing vanadium by acid process[J].Hydrometallurgy of China, 2002, 21(4): 175-183.
[3]王晓丹, 朱 云.制酸废催化剂回收钒[J].有色金属, 2010,62(4): 62-64.WANG Xiao-dan, ZHU Yun.Vanadium recovery from spent acid-making catalyst[J].Nonferrous Metals, 2010, 62(4): 62-64.
[4]胡建锋, 朱 云.P204萃取硫酸体系中钒的性能研究[J].稀有金属, 2007, 31(7): 367-370.HU Jian-feng, ZHU Yun.Extraction of vanadium by P204 from sulfuric acid solution[J].Chinese Journal of Rare Metals, 2007,31(7): 367-370.
[5]LI Xing-bin, WEI Chang, DENG Zhi-gan, LI Min-ting, LI Cun-xiong, FAN Gang.Selective solvent extraction of vanadium over iron from a stone coal/black shale acid leach solution by D2EHPA/TBP[J].Hydrometallurgy, 2010, 105: 359-363.
[6]李兴彬, 魏 昶, 樊 刚, 邓志敢, 李旻廷, 李存兄.溶剂萃取-铵盐沉钒法从石煤酸浸液中提取五氧化二钒的研究[J].矿冶, 2010, 19(3): 49-53.LI Xing-bin, WEI Chang, FAN Gang, DENG Zhi-gan, LI Min-ting, LI Cun-xiong.Research of vanadium pentoxide from an acid leaching solution of stone coal using solvent extraction and ammonium precipitation[J].Mining & Metallurgy, 2010,19(3): 49-53.
[7]李晓健.酸浸-萃取工艺在石煤提钒工业中的设计与运用[J].湖南有色金属, 2000, 16(3): 21-23.LI Xiao-jin.Design and application of acid leaching—Extraction processing in bone coal extracting vanadium industry[J].Hunan Nonferrous Metals, 2000, 16(3): 21-23.
[8]曹耀华, 高照国, 刘红召, 李 琦.萃取法从含钒酸浸液中提取钒的研究[J].河南化工, 2007, 24(6): 20-23.CAO Yao-hua, GAO Zhao-guo, LIU Hong-zhao, LI Qi.Study on vanadium extraction from vanadium acid leaching solution[J].Henan Chemical Industry, 2007, 24(6): 20-23.
[9]WANG Yu-xing, LUO Qin-ge, LIU Shu-me.A study on extraction mechanism of vanadium(Ⅴ) by primary amine N1923[J].Natural Science Journal of Xiangtan University, 1990,19(3): 139-146.
[10]刘彦华, 杨 超.用溶剂萃取法从含钒浸出液中直接沉淀钒[J].湿法冶金, 2010, 29(4): 263-267.LIU Yan-hua, YANG Chao.Research on direct precipitate of vanadium in vanadiferous leaching solution[J].Hydrometallurgy of China, 2010, 29(4): 263-266.
[11]刘 波, 冯光熙, 黄祥玉, 张 敏.用N263从钒溶液中回收钒[J].化学研究与应用, 2003, 15(1): 54-57.LIU Bo, FENG Guang-xi, HUANG Xiang-yu, ZHANG Min.Recovery of vanadium pentoxide from contained vanadium solution with methyltri (C9-11 alkyl) ammonium chloride[J].Chemical Research and Application, 2003, 15(1): 54-57.
[12]张 云, 范必威, 彭达平, 陈细发.从石煤酸浸液中萃取钒的工艺研究[J].成都理工学院学报, 2001, 28(1): 107-109.ZHANG Yun, FAN Bi-wei, PENG Da-ping, CHEN Xi-fa.Technology of extracting V2O5from the stone coal acid-leaching solution with TOA[J].Journal of Chengdu University of Technology, 2001, 28(1): 107-109.
[13]姚宝书.TBP萃取偏钒酸铵的条件[J].化学世界, 1990, 31(1):12-14.YAO Bao-shu.The conditions of ammonium metavanadate extraction using TBP[J].Chemical World, 1990, 31(1): 12-14.
[14]沈明伟, 朱昌洛, 李华伦.P507-煤油体系在钒钼萃取分离中的试验研究[J].矿产综合利用, 2007(4): 14-18.SHENG Ming-wei, ZHU Chang-luo, LI Hua-lun.P507-Kerosene system in extraction separation of vanadium and molybdenum[J].Multipurpose Utilization of Mineral Resources,2007(4): 14-18.
[15]刘玉国, 安 悦, 付晓东, 杨 东.P538萃取钒(Ⅳ)的研究[J].光谱实验室, 1998, 15(5): 32-34.LIU Yu-guo, AN Yue, FU Xiao-dong, YANG Dong.Study on vanadium(Ⅳ) extracted by P538[J].Chinese Journal of Spectroscopy Laboratory, 1998, 15(5): 32-34.
[16]KIM K, CHO J W.Selective recovery of metals from spent desulphurization catalyst[J].Korean Journal of Chemical Engineering, 1997, 14(3): 162-167.
[17]ZENG L, CHENG C Y.Recovery of molybdenum and vanadium from synthetic sulphuric acid leach solutions of spent hydrodesulphurisation catalysts using solvent extraction[J].Hydrometallurgy, 2010, 101: 141-147.
[18]POST K, RIBINS R G.Thermodynamic diagram for the vanadium-water system at 298.15 K[J].Electrochimica Acta,1976, 21: 401-405.
[19]BARNARD K R, TURNER N L.The effect of temperature on hydroxyoxime stability in the LIX63-versatic 10-tributyl phosphate synergistic solvent extraction system under synthetic nickel laterite conditions[J].Hydrometallurgy, 2011, 109:245-251.
