重组猪IFNα的构建及原核可溶性表达研究
2013-12-14蔡家利户国达孙加燕尹忠宝张存亮陈文毫
蔡家利,户国达,孙加燕,尹忠宝,张存亮,陈文毫
病毒性传染病是困扰我国养猪业发展最突出的问题之一,每年因病毒感染引起猪死亡和生长障碍而造成的经济损失无法估计。干扰素(interferon,IFN)是一种可抑制病毒复制的细胞因子,是由病毒或其他IFN诱导剂作用于易感细胞后产生的一种小分子糖类蛋白,具有广谱的抗病毒、抗肿瘤及免疫调节等功能[1]。据报道在各种类型的IFN 中,IFN-α 的抗病毒作用最强[2,3]。
目前,市售的猪α-干扰素由猪白细胞和原核表达系统获得,仅猪白细胞IFN获得农业部新兽药的批文[4]。白细胞干扰素来源极其有限,大大制约了其应用。原核表达系统,尤其是大肠杆菌表达虽然表达效率高,但表达出的重组猪α-干扰素多是以不溶的无功能的包涵体形式存在,必须通过复杂的变性复性过程才能获得有功能的蛋白,并且成功率较低。近年来,很多专家学者将研究重心转移到酵母菌[5]、杆状病毒、腺病毒[6]、转基因植物[7]上,并取得了重大成果,但是始终存在一些技术瓶颈,如猪α-干扰素的表达水平偏低、高密度发酵工艺复杂等,还无法实现猪IFN-α的规模化生产。据报道,猪IFN-α无需翻译后加工修饰,采用新的可溶表达策略即可实现其在大肠杆菌表达系统中的可溶性表达,大大加快了猪α-干扰素规模化生产进程。
本研究采用新的可溶性策略,构建了原核表达载体pET32a-poIFNα,通过与Trx融合表达,实现了猪α-干扰素的可溶性表达,只需一步纯化,即可获得纯度较高的猪α-干扰素重组产物。这对猪α-干扰素作为新的生物药物的进一步开发利用具有极其重要的意义。
1 材料与方法
1.1 材料
1.1.1 载体与菌株
pET32a+、大肠杆菌 DH5α和 BL21菌株,由重庆富进生物医药有限公司馈赠。
1.1.2 工具酶及其他材料
DNA抽提试剂盒、蛋白Marker购自天根公司;TaqDNA聚合酶、DNA Marker、限制性内切酶EcoR I和Xho I、T4连接酶、质粒提取试剂盒、胶回收试剂盒均购自TaKaRa公司;Ni-NTA亲和树脂来源于分子生物学实验室;其他试剂均为国产分析纯产品。
1.1.3 抗体
抗猪α-干扰素鼠源单抗;羊抗鼠IgG-HRP。
1.2 PCR扩增IFN-α
提取新鲜猪肝脏组织基因组DNA,根据Gen-Bank中猪IFN-α基因序列(登录号为M28623.1)设计引物。上游引物为5’-GGAATTCTGTGACCTGCCTCAG-3’;下游引物 5’-CCGCTCGAGTCACTCCTTCTTCCTGAGT-3’。在上、下游引物中分别引入 EcoR I、Xho I酶切位点(下划线表示)。PCR反应体系按照TaqDNA聚合酶附带的说明书制定。反应条件为:95℃预变性5 min,然后经历94℃ 45 s、61℃ 45 s、72℃ 1 min 共35 个循环,72℃延伸7 min。PCR产物鉴定后回收纯化,-20℃保存。
1.3 重组质粒pET32a-IFN-α的构建
分别回收EcoR I、Xho I酶双酶切后的PCR产物和pET32a质粒,按体积比7∶1,16℃连接过夜。将连接反应产物转化新鲜制备的DH5α感受细胞,使用含终浓度为100 μg/mL Amp的LB进行筛选。过夜培养后,进行菌落PCR鉴定,对阳性克隆提取质粒进行双酶切鉴定,然后送TaKaRa公司测序,并对结果进行分析。
1.4 工程菌的构建
将测序为阳性的重组质粒转化表达菌株BL21(DE3),用含Amp的LB平板进行筛选。过夜培养后,进行菌落PCR鉴定,对阳性克隆提取质粒进行双酶切鉴定。
1.5 rpoIFN-α的诱导表达
挑选筛选出的阳性BL21(DE3)单克隆菌株,接种于5mL含终浓度为100 μg/mL Amp的LB液体培养基,37℃过夜培养。将菌液按体积比1∶100接种到20 mL含 Amp的培养基中,37℃培养至OD600为0.6~0.8时加入终浓度为0.5 mmol/L的IPTG,22℃培养8 h后收集菌液,5 000 r/min离心取沉淀。按照每1 g菌加入10 mL PBS的比例,使其重悬,然后超声破菌。破菌液离心后,分别取上清和沉淀进行SDS-PAGE分析[8]。
1.6 rpoIFN-α的纯化
22℃诱导表达3L菌液,离心收集菌体。按体积比1∶3~1∶10的比例加入裂解液,超声破碎后离心收集破菌上清。用0.45 μm的水系过滤器过滤一次,随流动相进入已平衡好的Ni柱。用平衡Buffer平衡柱子,收集穿透液,再用 20、50、100、200、400 mmol/L咪唑梯度洗脱,每次洗脱体积为40 mL,用SDS-PAGE分析纯化效果。
1.7 Western-blot鉴定
取纯化后的表达产物10 μL,进行SDS-PAGE电泳。在100 V条件下电转2 h,将rpoIFN-α从SDS-PAGE胶上转移到NC膜上。用5%的脱脂奶粉(用PBST配置)37℃封闭2 h,再用PBST洗膜3次。加入抗猪α-干扰素鼠源单抗(1∶2000稀释),37℃孵育1 h,再用PBST洗膜3次。加入羊抗鼠IgG-HRP(1∶4000稀释),37℃孵育1 h。再用PBST洗膜3次。加入DAB显色液暗区反应5~10 min,用水进行漂洗。
2 结果
2.1 重组质粒pET32a-IFN-α的鉴定
2.1.1 PCR鉴定
菌落PCR产物经1%琼脂糖凝胶电泳分析,在501bp附近位置有明显的条带(见图1),与预期相符。
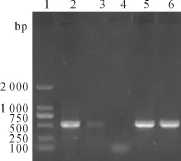
图1 重组pET32a+-PoIFNα质粒菌落PCR鉴定结果
2.1.2 双酶切鉴定
重组质粒pET32a+-PoIFNα经限制性内切酶EcoRⅠ和XhoⅠ双酶切后可见线性质粒的条带及501bp的目的基因片段,与PoIFNα基因的大小相吻合(见图2)。

图2 重组pET32a+-PoIFNα质粒双酶切鉴定结果
2.1.3 测序结果与分析
经比对,克隆得到的基因序列与Genebank上登录号为AY776246、M28623的poIFNα同源性分别为99%、97%(见图3),初步认定克隆得到的基因是PoIFNα基因,可以用来制备PoIFNα。

图3 DNA序列比对
2.2 PoIFNα的表达
经过对诱导剂浓度、诱导温度和诱导时间的研究,确定出可溶性表达最佳诱导条件为22℃,10 h,0.5 mmol/L IPTG。用最佳条件诱导后,破菌上清与沉淀经SDS-PAGE分析,poIFNα多以可溶性表达的形式出现在破菌上清中(见图4)。

图4 重组蛋白可溶性分析
2.3 PoIFNα的纯化结果
梯度洗脱,收集到的蛋白经SDS-PAGE分析后,浓度为20 mmol/L时可以洗去几乎所有的杂蛋白,在50 mmol/L时进一步纯化,在100 mmol/L时洗脱即可得到纯度很高的PoIFNα,为大量产物纯化奠定了基础(见图5)。
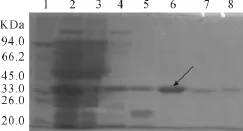
图5 PoIFNα纯化电泳图
纯化后的PoIFNα经Western blot检测在膜上有特异性的条带出现(见图6),进一步证实产物为PoIFNα。
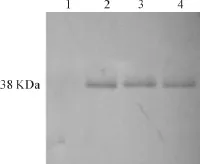
图6 Western blot结果
3 讨论
大肠杆菌表达真核蛋白时,多形成不溶性的、无功能的包涵体。因此,如何实现真核蛋白在大肠杆菌表达系统中的可溶性表达是摆在我们面前亟待解决的问题。
在众多学者的不断探索创新中,人们已经积累了一些实现蛋白可溶性表达的经验:①选择合适的宿主菌[9],例如选择蛋白酶缺失的菌株;②共表达一种或多种分子伴侣或折叠酶[10-11];③ 选择适宜的载体,实现融合表达[12];④ 通过定点突变,改变蛋白结构[13];⑤ 优化培养条件和诱导条件[14-15]。由于蛋白种类繁多,理化性质各异,目前很难找到一种通用的方法。对于某一蛋白可溶性表达策略的选取,只能在研究中摸索、积累经验,并同时关注相关领域的研究进展。
本实验尝试使用前人在猪α-干扰素原核表达中未曾使用的质粒pET32a+,实现了PoIFNα的可溶性表达,并取得了成功。pET32a+含有TrxA基因,可以与下游多克隆位点插入的目的基因融合表达,所编码的硫氧还原蛋白可大大提高目的蛋白的溶解度和活性,并且载体上带有His标签,通过镍柱亲和层析一步纯化即可得到融合蛋白。这为实现其他真核蛋白在大肠杆菌中可溶性表达提供了重要参考。
下一步工作的重心是PoIFNα活性的测定。将采用细胞病变抑制法测定PoIFNα在动物细胞上对动物病毒的抑制作用。
[1]Liu H,Jiao D,Ge J Q.The actuality and develop analysis of interferon in home markert[J].China Pharmaceticals,2001,10(10):13.
[2]Toniutto P,Fabris C,Pirisi M.Antiviral treatment of hepatitis C[J].Expert Opin Phar-macother,2006,7(15):2025-2035.
[3]Tas F,Kurul S,Camlica H,et al.Interm-ediate dose interferon alpha in adjuvant treatment for high-risk melanoma:a single institution’s experience[J].Med Oncol,2006,23(4):471-477.
[4]王艳晓.猪干扰素在临床生产中的作用[J].广东畜牧兽医科技,2011(6):18.
[5]Min-Jie Gao,Zhi-Yong Zheng.Methanol/sorbitol co-feeding induction enhanced porcine interferon-α production by P.pastoris associated with energy metabolism shift[J].Applied Microbiology and Biotechnology,2012,93(4):1437-1445.
[6]崔尚金.猪干扰素基因在腺病毒的表达及应用[J].养猪,2011(3):61-64
[7]Matvieieva N A,Shakhovskij A M,Kuchuk M V.Features of lettuce transgenic plants with the IFN-α2b gene regenerated after Agrobacterium rhizogenes-mediated transformation[J].Cytology and Genetics,2012,46(3):150-154.
[8]萨母布鲁克 J,拉萨尔 D W.分子克隆实验指南[M].3版.黄培堂,译.北京:科学出版社,2005:713-23.
[9]Seddi R,Chaix J C,Puigserver A.Expression of a soluble and activatable form of bovine procarboxypeptidase A in Escherichia coli[J].Protein Expr Purif,2003,27(2):220.
[10]Lee K H,Kim H S,Jeong H S.Chaperonin GroESL mediates the protein folding of human liver mitochondrial aldehyde dehydrogenase in Escherichia coli[J].Biochem Biophys Res Commun,2002,298(2):216.
[11]Qiu J,Swartz J R,Georgiou G.Expression of active human tissue type plasminogen activases in Escherichia coli[J].Appl Env Microbio1,1998,64:4897.
[12]Austin C.Novel approach to obtain biologically active recombinant heterodimeric proteins in Escherichia coil[J].J Chromatogr B Analyt Technol Biomed Life Sci,2003,786(1/2):93.
[13]Dale G E,Broger C,Langen H,et al.Improving protein solubility through rationally designed amino acid replacements:solubilization of the trimethoprin-resistant type S1 dihydrofolate reductase[J].Protein Eng,1994,7:933.
[14]Majumder A,Basak S,Raha T,et al.Effect of Osmolytes and Chaperone-like Action of P-protein on Folding of Nucleocapsid Protein of Chandipura Virus[J].J Biol Chem,2001,276(33):30948.
[15]Chou C H,Aristidou A A,Meng S Y,et al.Characterization of a pH-inducible promoter system for high-level expression of recombinant proteins in Escherichia coli[J].Biotechnology and Bioengineering,1995,47:186.
