基于拓扑规则Pb-S-O体系优势区图的绘制与应用
2013-12-14姚腾猛刘常青陈启元张平民
姚腾猛,谭 军,刘常青,李 洁,陈启元,王 辉,廖 舟,张平民
(1.中南大学 化学化工学院 有色金属资源化学教育部重点实验室,长沙 410083;2.株洲冶炼集团股份有限公司,株洲 412000)
Pb-S-O体系优势区图是高温炼铅过程热力学分析的重要工具,对火法炼铅工艺具有指导意义。在火法炼铅工艺中,Kivcet法是一种新型的直接炼铅法,主要包括氧化、还原和烟化3个冶金化学过程,该法具有节能、高效、环保等优点[1]。氧化阶段,在Kivcet闪速功能区中鼓入 95%(体积分数)的工业纯氧,铅精矿在悬浮状态下氧化形成高硫位并生成大量粗铅,这是 Kivcet直接炼铅法的一个重要特点[2-3]。采用优势区图来解释直接炼铅原理已有相关报道[4-5],但这些优势区图给出的直接炼铅区域较窄,氧位、硫位相对较低,工艺上较难控制。
CHAKRABOTI和JHA[6]应用基因算法分析了Pb-S-O体系的热力学,但仅考察了蒸汽组分的反应平衡。SCHUHMANN等[7]建立了Pb-S-O体系直接炼铅的热力学平衡模型,但热力学计算及优势区图只反映了氧压和温度的影响,没有对硫压的影响进行进一步分析。KELLOGG[8]通过构建Pb-S-O体系的平衡方程,得到了 PbSO4、PbOPbSO4、(PbO)2PbSO4和(PbO)4PbSO4等组分的热力学数据,但未通过热力学计算建立相应的优势区图。ERIC和TIMUCIN[9]对Pb-S-O体系凝聚相进行了热力学分析,虽然得到了Pb-PbS和PbO-PbSO4熔体的优势区图,但没有反映Pb、PbS、PbO和PbSO4等单组分的稳定存在区域。
利用计算机绘制优势区图的传统方法主要有逐点法、线消除法和凸多边形法等[10-11]。优势区图由共存点和单变线构筑而成,结合地理绘图中的拓扑思路[12],可以确定优势区图的构型。地图中的点、线将平面分隔成多个区域,用有限的颜色可给多个区域填色而且存在多种填色方式[13]。根据此思路,有限的指定物种在平面图中也有多种分布方式,由于每一组分在优势区图中具有唯一稳定存在的区域,所以可确定优势区图的构筑方式。
本文作者对 Pb-S-O体系的凝聚相共存点进行热力学计算[14-15],以基于拓扑规则的方式绘制 Pb-S-O体系优势区图,并将其用于解释Kivcet直接炼铅过程。
1 相律与拓扑分析
在含N个组分r个独立化学反应的体系中,独立组元n=N-r,相律可表示为

式中:f为自由度;Ф为体系的相数;2表示温度和压力两个变量。
Pb-S-O体系内凝聚态组分可能有Pb、PbO、PbO2、PbS、PbS2、PbSO4、PbO·PbSO4和2PbO·PbSO4等[5],气态组分可能有S、S2、S3、S4、S5、O2、SO2和SO3等[16]。对于Pb-S-O体系,独立组元n始终为3,体系最多只能5相共存,其中1个气相,4个凝聚相。在以氧位lgp(O2)和硫位lgp(S2)为坐标的优势区图中,为了简单表示金属硫化物高温反应的平衡条件,选定4个理想凝聚相为Pb、PbO、PbS和PbSO4。
若温度恒定,当自由度f=0时,Ф=4,即气相和3个凝聚相共存,此时可能形成 4个三相(凝聚相)点:A(Pb、PbS、PbO),B(PbS、PbO、PbSO4),C(Pb、PbS、PbSO4)和D(Pb、PbO、PbSO4)。当自由度f=1时,Ф=3,即气相和两个凝聚相共存,此时在优势区图上表现为一条单变线。
A、B、C和D4个三相点在优势区图处于不同的位置,每个三相点由3种不同的凝聚相共存形成,以γ、δ、ε和ζ表示Pb、PbO、PbS和PbSO44个凝聚相,2个凝聚相间用单变线隔开。结合地图填色的拓扑思路,存在如图1中(a)、(b)和(c) 3种类型的平面图。由于每类平面图可以旋转且存在多种填充方式,在此,将此类平面图定义为拓扑图。
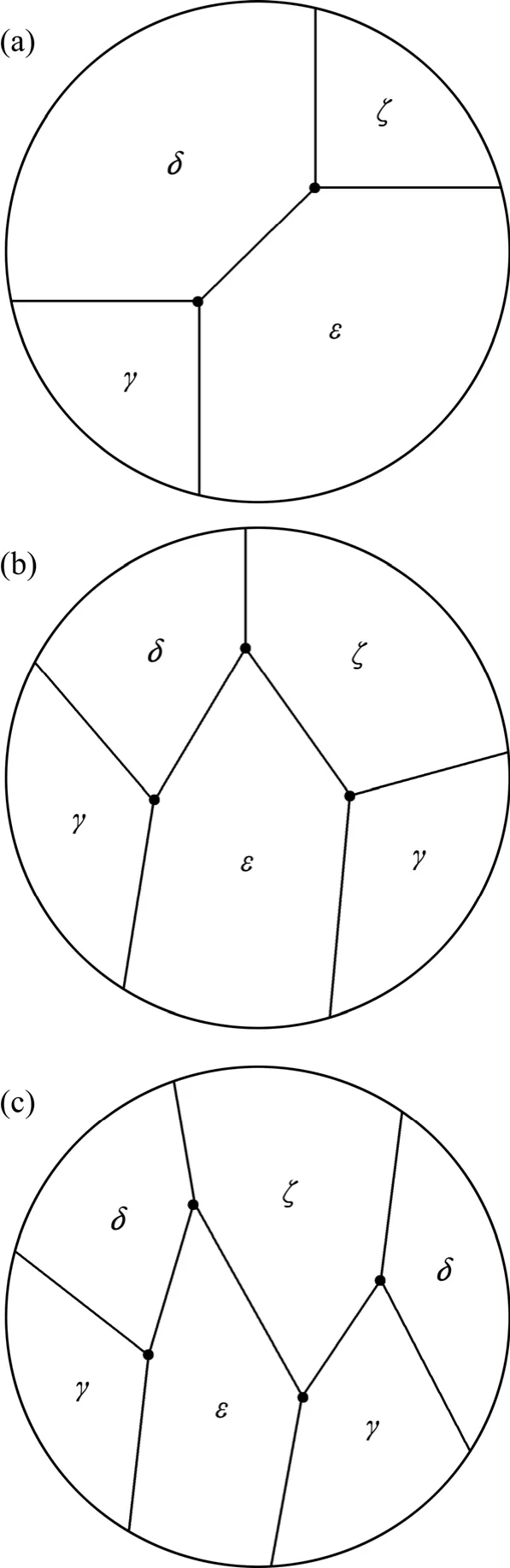
图1 组合方式不同的3类拓扑图Fig.1 Three kinds of topological diagrams with different combination modes: (a) Two coexisting points; (b) Three coexisting points; (c) Four coexisting points
在优势区图中,由于同一凝聚相不能在多个区域同时存在,则只能利用图1中(a)类拓扑图来构造优势区图,且若直角坐标系选取的位置不同,优势区图的构型也会不同。在以氧位lgp(O2)和硫位lgp(S2)为坐标的优势区图中,根据Pb、PbO、PbS和PbSO4的热力学稳定存在区域,Pb-S-O体系优势区图可能为图2中(a)和(b)两类拓扑图中的一种。
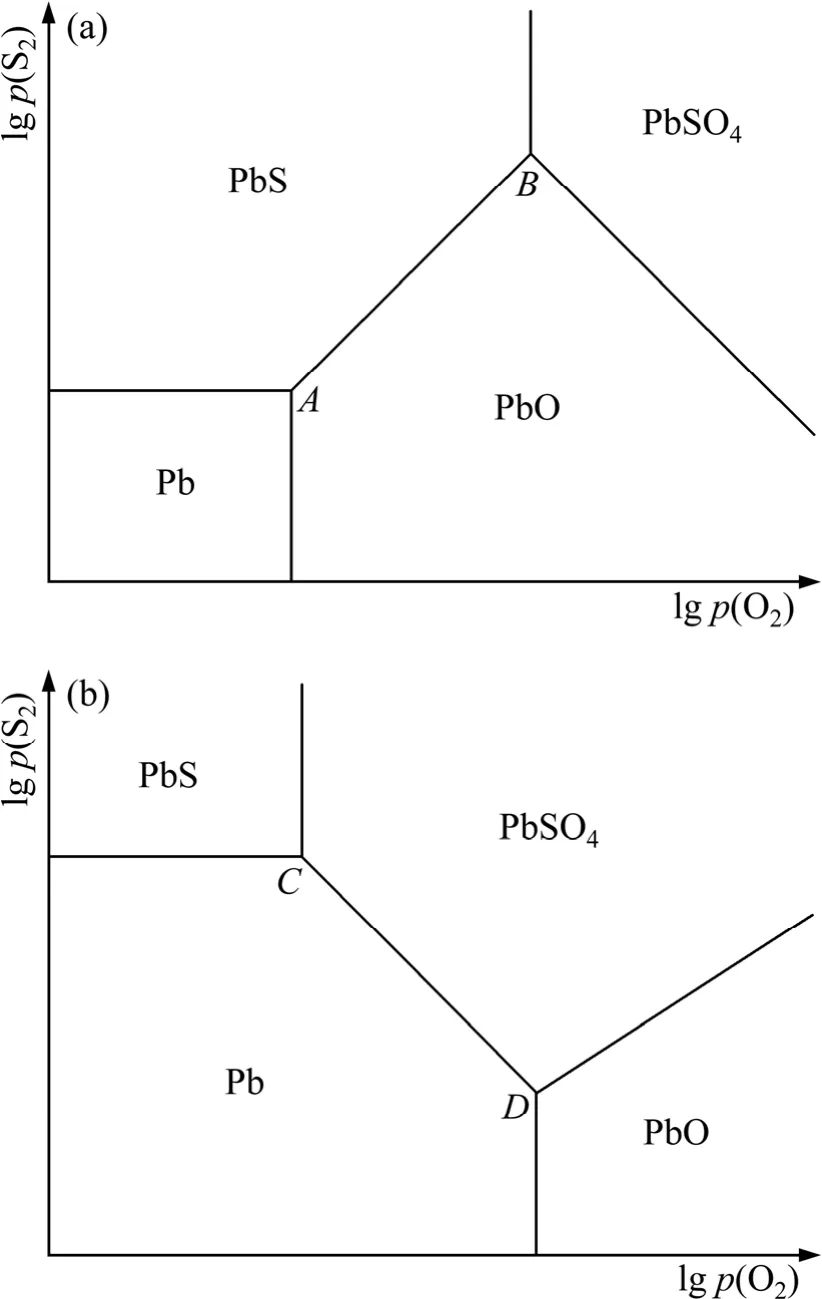
图2 三凝聚相共存点构成的两类Pb-S-O体系拓扑图Fig.2 Two kinds of topological diagrams of Pb-S-O system comprised of three condensed phases coexisting points: (a) α type; (b) β type
如图2中(a)和(b)所示,三相点A(Pb、PbS、PbO)和B(PbS、PbO、PbSO4)构筑了一种平面图(α型平面拓扑图),三相点C(Pb、PbS、PbSO4)和D(Pb、PbO、PbSO4)构筑了另一类型的平面图(β型平面拓扑图)。
热力学分析表明,Pb-S-O体系中A、B、C和D4个三相点都是可能存在的宏观状态,α型平面拓扑图表示三相点A和B共存时优势区图的构型,β型平面拓扑图表示三相点C和D共存时优势区图的构型。
2 热力学计算
根据拓扑思路确定了 Pb-S-O体系的两种平面拓扑图:α型拓扑图和β型拓扑图,为了精确绘制这两种拓扑图,需要对体系三相点和单变线位置进行热力学计算。
对于α型平面拓扑图,三相点Ai( Pb、PbS、PbO)和Bi(PbS、PbO、PbSO4)分别由表1所示两组反应同时平衡确定,同时建立相应热力学关系表达式。给定温度为1 200、1 300和1 400 K,根据相应的热力学数据[17],且理想凝聚相的活度a=1,联立求解可得三相点Ai和Bi对应的硫位和氧位值,结果如表2所列。
同理,对于β型平面拓扑图,三相点Ci(Pb、PbS、PbSO4)和Di(Pb、PbSO4、PbO)分别由表3所示两组反应同时平衡确定,建立相应热力学关系表达式并得到相应温度下Ci和Di对应的硫位和氧位值,结果如表4所列。
恒温条件下,Pb-S-O体系平面拓扑图中单变线由反应(2)~(5)确定,反应(2)~(4)为单一气相组分,故对应的单变线均为与相应坐标轴垂直的直线段。反应(5)达到平衡时,氧位和硫位的单变线方程如式(6)所示:

表1 α型平面拓扑图三相点平衡反应及其热力学表达式Table1 Equilibrium reactions of coexisting points of three condensed phases and their thermodynamic expressions in α planetopological diagram
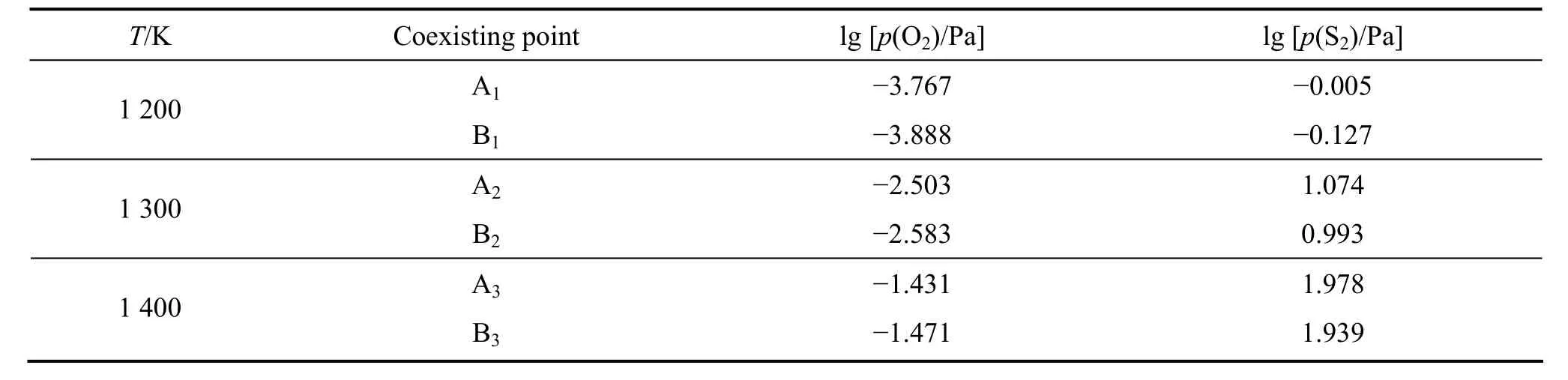
表2 α型平面拓扑图三相点氧位及硫位值Table2 Oxygen and sulfur pressures of coexisting points of three condensed phases in α plane-topological diagram
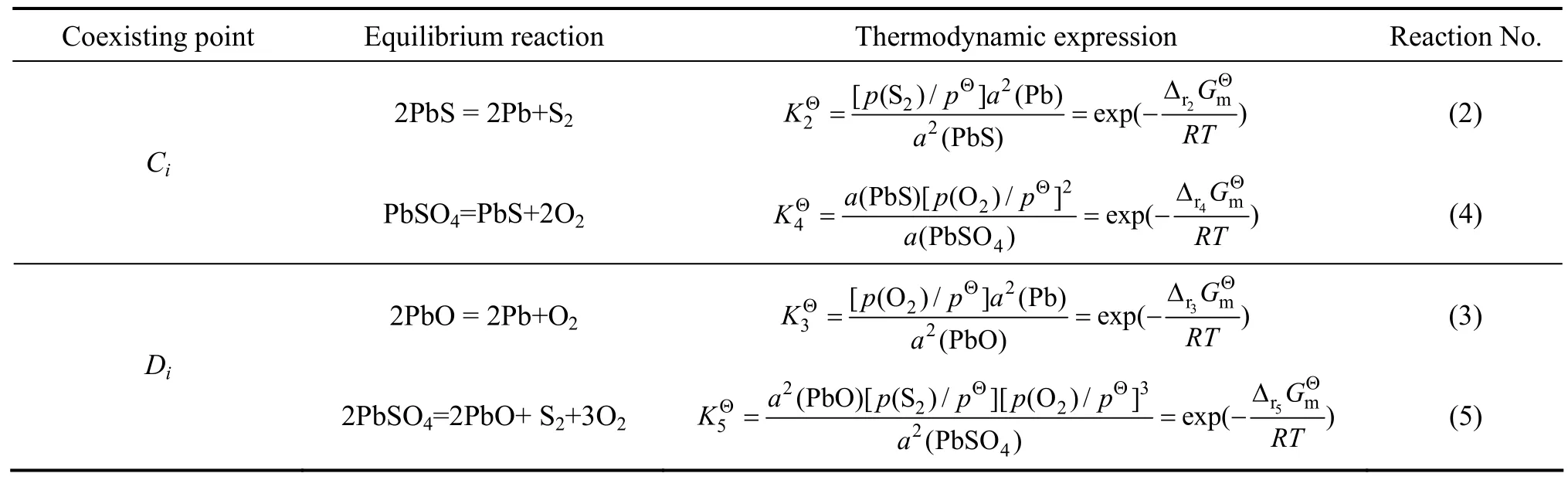
表3 β型平面拓扑图三相点平衡反应及其热力学表达式Table3 Equilibrium reactions of coexisting points of three condensed phases and their thermodynamic expressions in β planetopological diagram
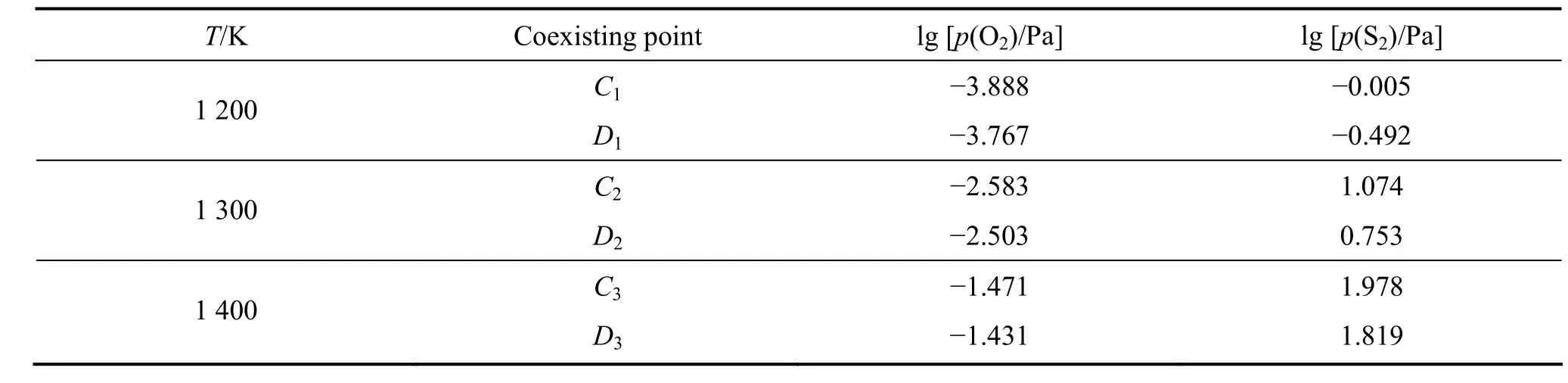
表4 β型平面拓扑图三相点氧位及硫位值Table4 Oxygen and sulfur pressures of coexisting points of three condensed phases in β plane-topological diagram
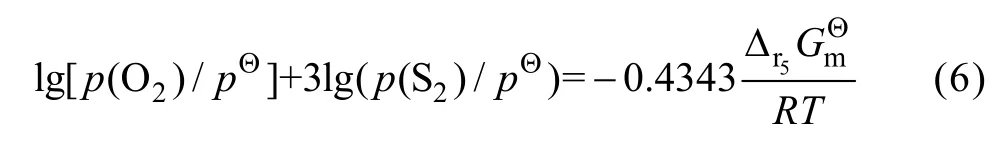
由式(6)可知,一定温度下,lgp(O2)与lgp(S2)呈线性关系,给定氧位值可得相应的硫位值,即得到平面拓扑图中的一个点,再结合相应三相点即可作出反应(5)对应的单变线,在1 200、1 300和1 400 K时PbO与PbSO4之间的单变线方程给定的对应氧位值和硫位值如表5所列。

表5 PbO与PbSO4单变线方程中的相关氧位及硫位值Table5 Related oxygen and sulfur pressures of single variation equation between PbO and PbSO4
3 平面拓扑图的绘制和分析
在一定温度下,以氧位 lgp(O2)为横坐标,硫位lgp(S2)为纵坐标,由表2可确定三相点Ai(Pb、PbS、PbO)和Bi(PbS、PbO、PbSO4)的位置,由表4可确定三相点Ci(Pb、PbS、PbSO4)和Di(Pb、PbSO4、PbO)的位置,再结合表5所列数据绘制出1 200、1 300和1 400 K时Pb-S-O体系α型和β型平面拓扑图,分别如图3~5所示。
图3~5中三相点Ai、Bi、Ci和Di的氧位和硫位值都随温度的升高而增大,但α型拓扑图中Ai与Bi或β型拓扑图中Ci与Di在数值上都很接近,即相应的热力学条件较难控制和实现。
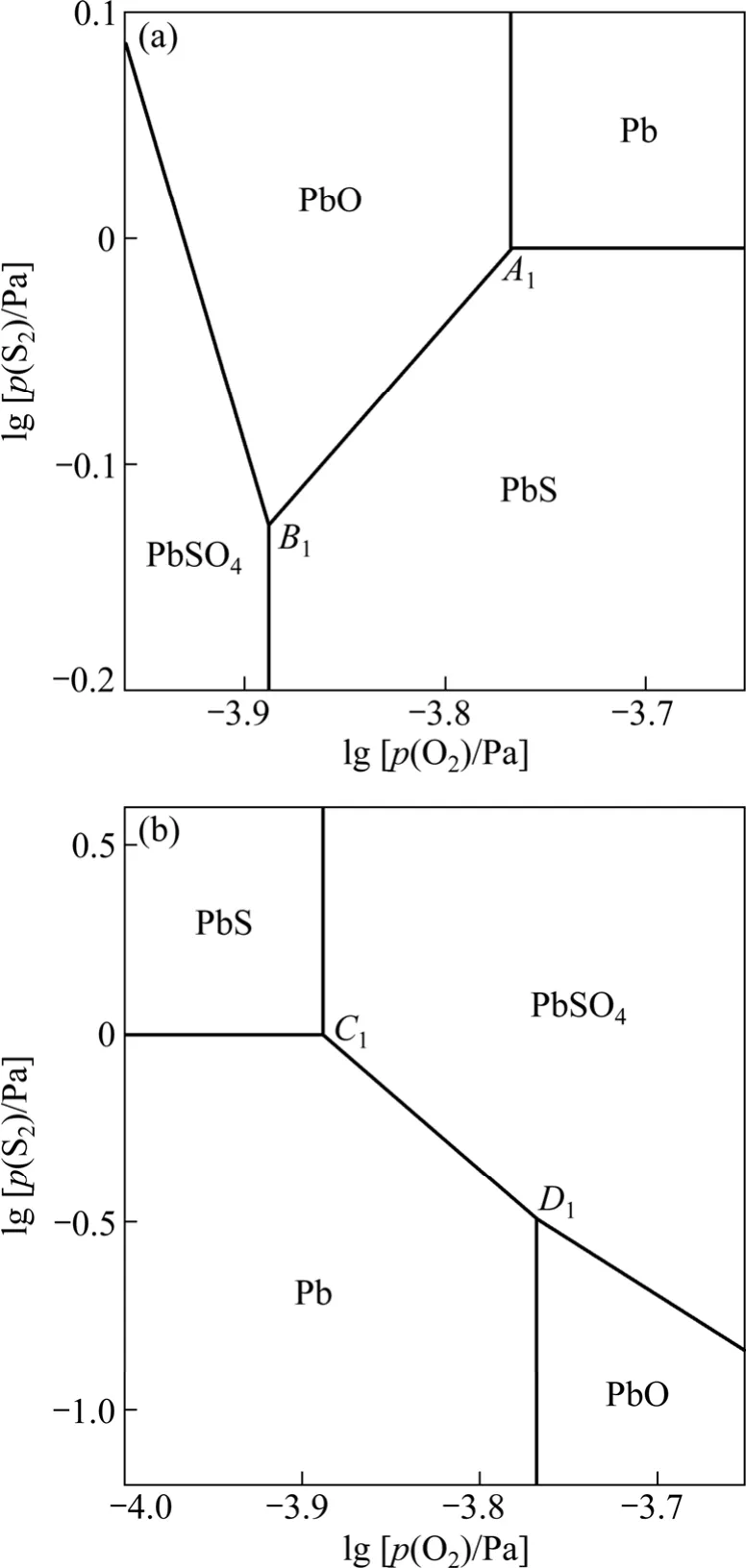
图3 1 200 K时Pb-S-O体系的平面拓扑图Fig.3 Plane-topological diagrams of Pb-S-O system at 1 200 K: (a) α type; (b) β type
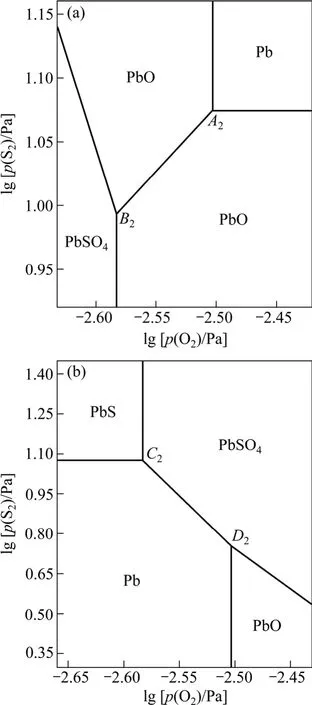
图4 1 300 K时Pb-S-O体系的平面拓扑图Fig.4 Plane-topological diagrams of Pb-S-O system at 1 300 K: (a) α type; (b) β type
α型拓扑图中,当硫位降低时,反应(2)朝生成PbS的方向进行;氧位降低时,反应(3)朝生成PbO方向进行。即硫位或氧位降低时 Pb不稳定,这违背相应热力学稳定存在准则——硫位或氧位降低时金属 Pb应为稳定相。同理,结合反应(2)~(5)及相应的氧位和硫位值,α型拓扑图中PbO、PbS和PbSO4的存在区域在热力学上也是不稳定的,而β型拓扑图中Pb、PbS、PbO和PbSO4的存在区域则是稳定的。
三相点C(Pb、PbS、PbSO4)和D(Pb、PbO、PbSO4)共同构筑了β型拓扑图,4个凝聚相的存在区域都符合热力学稳定存在准则。事实上,β型平面拓扑图与传统的Pb-S-O体系平面优势区图[4]是一致的,故可以认为β型平面拓扑图就是本研究中要绘制的Pb-S-O体系优势区图。值得注意的是,β型拓扑图中凝聚相的分布与图2(b)相符,而常见的 Zn-S-O、Cu-S-O 和Ni-S-O体系优势区图[18]中相关凝聚相的分布与图2(a)相符,这一差别反映铅冶炼工艺具有一定的特殊性。在传统的火法冶金模式中,铜和镍是通过硫化精矿造熔锍后吹炼产生的,而铅和锌是通过硫化精矿造氧化物后碳热还原产生的,且铅精矿焙烧成氧化物不如锌精矿彻底[5]。
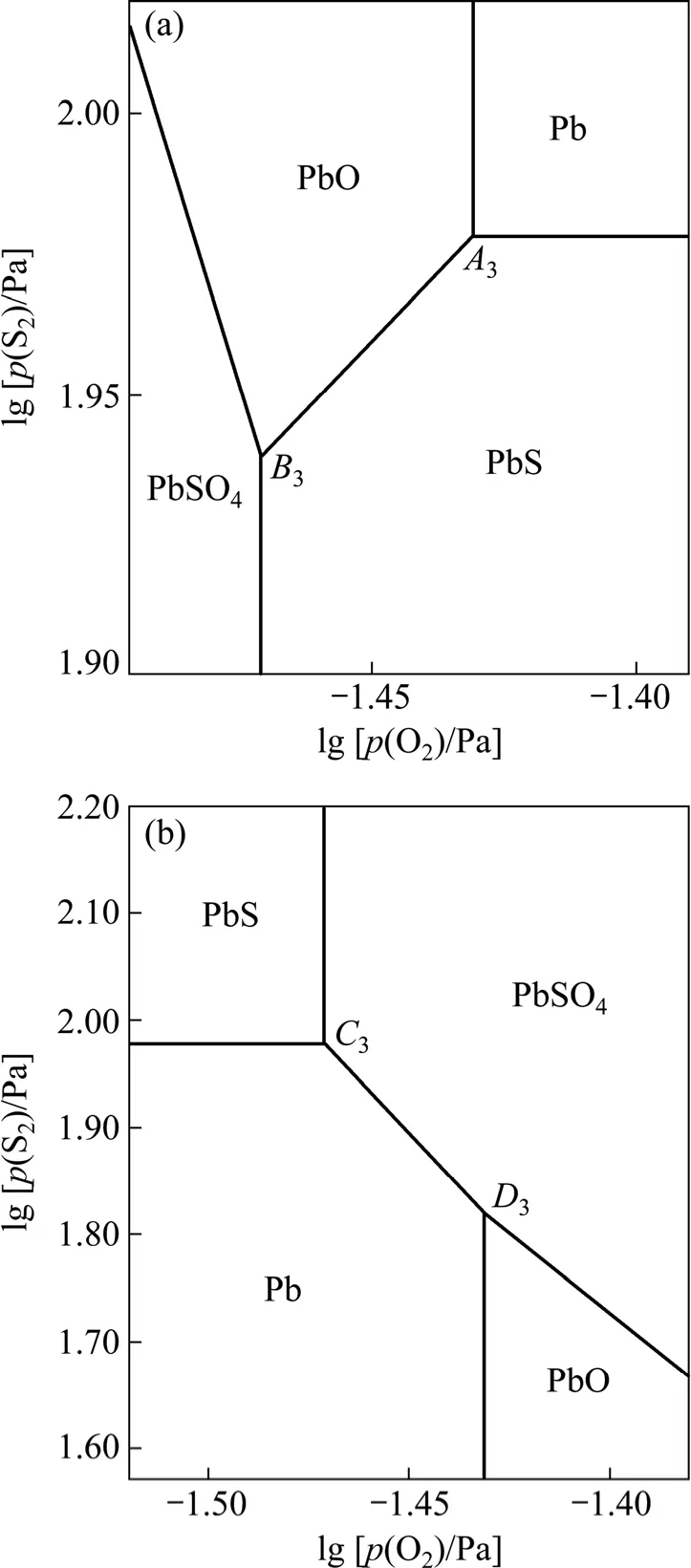
图5 1 400 K时Pb-S-O体系的平面拓扑图Fig.5 Plane-topological diagrams of Pb-S-O system at 1 400 K: (a) α type; (b) β type
铅冶炼工艺最大的特殊性在于Kivcet直接炼铅工艺,而对铜、镍和锌3种金属,仍没有由其精矿直接冶炼成金属的工艺。对此,如果应用α型Pb-S-O体系平面拓扑图,就可以很好解释铅冶炼具有直接炼铅的特殊工艺。
在直接炼铅工艺中,将95%的工业纯氧喷入Kivcet炉闪速区内形成高氧位,呈悬浮状态的PbS精矿颗粒瞬间被氧化生成 Pb和PbO,并在闪速区内形成高硫位,由于产生的SO2及时排出参与制酸,PbSO4的生成量较少。在此条件下,三相点A(Pb、PbS、PbO)与三相点B(PbS、PbO、PbSO4)共存形成如图3~5所示的α型拓扑图。在α型拓扑图中,Pb存在于氧位、硫位同时较高的区域,虽然此状态在热力学上不稳定,但这可用于解释Kivcet炼铅工艺在高氧位和高硫位的条件下出现大量粗金属Pb的现象。
α型拓扑图表明三相点A和B同时存在时的拓扑逻辑关系,β型拓扑图表明三相点C和D同时存在时的拓扑逻辑关系[19],两种拓扑图都符合热力学平衡原理。Kivcet炉中进行的是高温多元多相的复杂过程,冶炼过程符合何种拓扑图与具体条件有关,当条件有利于三相点A和B共存时,利用α型拓扑图就可解释Kivcet炉闪速功能区直接出铅的现象。
4 结论
1) Pb-S-O体系的两个三凝聚相点间存在多种组合方式,基于拓扑规则确定了优势区图的两种类型:α型拓扑图和β型拓扑图。对两种拓扑图中的三相点和单变线进行严密地论证和计算,以氧位、硫位为坐标绘制了α型和β型拓扑图。
2) 表示三相点的关系时符合拓扑规则,绘制拓扑图时也严格遵循热力学平衡共存的原理。因此,用氧位、硫位为坐标轴绘制的拓扑图是合理的。α型平面拓扑图中Pb、PbS、PbO和PbSO4的存在区域在热力学上不稳定,但可用于解释Kivcet炉闪速区直接出铅的现象;β型平面拓扑图中Pb、PbS、PbO和PbSO4的存在条件都是稳定的,与传统的Pb-S-O体系优势区图表现出一致性,说明基于拓扑规则可以绘制Pb-S-O体系优势区图。
[1]CHAUDHURI K B, KOCH M, PATINO J L.The technical-scale realization of the Kivcet process for lead[J].Canadian Mining and Metallurgical Bulletin, 1980, 73(817): 146-150.
[2]蒋继穆.我国铅锌冶炼现状与持续发展[J].中国有色金属学报, 2004, 14(S1): 52-62.JIANG Ji-mu.Status and sustainable development of lead and zinc smelting industry in China[J].The Chinese Journal of Nonferrous Metals, 2004, 14(S1): 52-62.
[3]SANNIKOV Y I, LIAMINA M A, SHUMSKIJ V A, GRININ Y A, RADASHIN M V.A physical and chemical description of the Kivcet lead flash smelting process[J].Canadian Mining and Metallurgical Bulletin, 1988, 91(1022): 76-81.
[4]彭容秋.铅冶金[M].长沙: 中南大学出版社, 2004: 65-66.PENG Rong-qiu.Metallurgy of lead[M].Changsha: Central South University Press, 2004: 65-66.
[5]彭容秋.铅锌冶金学[M].北京: 科学出版社, 2003: 180-183.PENG Rong-qiu.Metallurgy of lead-zinc[M].Beijing: Science Press, 2003: 180-183.
[6]CHAKRABORTI N, JHA P K.Pb-S-O vapor system re-evaluated using genetic algorithms[J].Journal of Phase Equilibria and Diffusion, 2004, 25(5): 421-426.
[7]SCHUHMANN R J, CHEN P C, PALANISAMY P, SARMA D H R.Thermodynamics of converting lead sulfide[J].Metallurgical Transactions B, 1976, 7(1): 95-101.
[8]KELLOGG H H.Critical evaluation of the thermochemical properties of lead sulfates[J].Metallurgical and Materials Transactions B, 1989, 20(1): 77-85.
[9]ERIC R H, TIMUCIN M.Thermodynamic analysis of the direct converting of lead sulphide[J].Journal of the South African Institute of Mining and Metallurgy, 1989, 89(2): 33-39.
[10]LINKSON P B, PHILLIPS B D.Computer methods for the generation ofEh—pH diagrams[J].Miner Sci Eng, 1979, 11(2):65-79.
[11]FRONING M H, SHANLEY M E, VERINK E D.An improved method for calculation of potential—pH diagrams of metal-ion-water systems by computer[J].Corrosion Science,1976, 16(6): 371-377.
[12]宋小冬, 钮心毅.地理信息系统实习教程(ArcGIS 9.x)[M].北京: 科学出版社, 2007: 300-313.SONG Xiao-dong, NIU Xin-yi.The practical tutorial of geographic information system (ArcGIS 9.x)[M].Beijing:Science Press, 2007: 300-313.
[13]马俊海, 王文福, 祁向前.现代地图学理论与技术[M].哈尔滨: 哈尔滨地图出版社, 2008: 120-128.MA Jun-hai, WANG Wen-fu, QI Xiang-qian.The theory and technology of modem cartography[M].Harbin: Harbin Cartographic Publishing House, 2008: 120-128.
[14]刘小文, 杨建广, 李 静, 陈永明, 孙亚辉, 唐谟堂.Bi2S3-ZnO-Na2CO3体系热力学分析及应用[J].中国有色金属学报, 2012, 22(1): 310-314.LIU Xiao-wen, YANG Jian-guang, LI Jing, CHEN Yong-ming,SUN Ya-hui, TANG Mo-tang.Thermodynamic analysis of Bi2S3-ZnO-Na2CO3and its application[J].The Chinese Journal of Nonferrous Metals, 2012, 22(1): 310-314.
[15]马爱琼, 蒋明学.TiB2合成反应机理的优势区相图分析[J].中国有色金属学报, 2011, 21(6): 1409-1414.MA Ai-qiong, JIANG Ming-xue.Predominance area phase diagram analysis about synthetic reaction mechanism of TiB2[J].The Chinese Journal of Nonferrous Metals, 2011, 21(6):1409-1414.
[16]de ASHOK K, CHAKRABORTI N.Thermodynamic analysis of the Pb-S-O vapor system[J].Materials Research and Advanced Techniques, 1985, 76(8): 538-541.
[17]BARIN I.纯物质热化学数据手册[M].程乃良, 等, 译.北京:科学出版社, 2003: 1273-1306.BARIN I.Thermochemical data of pure substances[M].CHENG Nai-liang, et al, transl.Beijing: Science Press, 2003: 1273-1306.
[18]张传福, 刘海霞, 钟大龙, 曾德文.硫化镍精矿熔炼的热力学分析[J].中国有色金属学报, 1999, 9(4): 805-810.ZHANG Chuan-fu, LIU Hai-xia, ZHONG Da-long, ZENG De-wen.Thermodynamical analysis of smelting process of nickel sulfides concentrate[J].The Chinese Journal of Nonferrous Metals, 1999, 9(4): 805-810.
[19]ARMSTRONG M A.基础拓扑学[M].孙以丰, 译.北京: 人民邮电出版社, 2010: 1-17.ARMSTRONG M A.Basic topology[M].SUN Yi-feng, transl.Beijing: People’s Posts and Telecommunications Publishing House, 2010: 1-17.
