Pb胁迫对香豌豆幼苗部分生长和生理生化指标的影响
2013-12-14司卫静原海燕韩玉林
司卫静,原海燕,韩玉林,①,许 敏
〔1.江西财经大学艺术学院园林系江西省生态环境实验教学示范中心,江西南昌330032;2.江苏省·中国科学院植物研究所(南京中山植物园),江苏南京210014〕
近年来,由于工矿业的发展使得大量的有害重金属不断流入人类的生存和生活环境。重金属铅(Pb)对环境有显著毒性,具有极强的累积性和不可逆性,在环境中滞留时间很长,Pb污染难以治理且能够对人类健康产生极大危害[1],因而,研究Pb对植物生长和生理的影响具有重要的理论和实践意义。目前,有关Pb污染对植物影响方面的研究多采用水培法[2-4],实验条件与植物的实际生长环境差别较大,研究结果具有一定的局限性。
多数豆科(Fabaceae)植物具有耐高温、耐贫瘠和较抗旱的特性,不但可为人类提供高质量的植物性蛋白质,而且可通过生物固氮作用增加土壤的含氮量、提高土壤肥力。当前很多国家都很重视豆科植物对重金属的耐受性研究,并取得了一系列的研究成果[5-6]。缪福俊等[7]对16株分离自兰坪铅锌尾矿区的豆科植物根瘤菌进行了Pb耐性研究,结果表明大多数菌株具有良好的Pb耐性。香豌豆(Lathyrus odoratus Linn.)是一种观赏价值很高的豆科植物,在园林绿化中应用广泛,目前尚未见有关其Pb耐性方面的研究报道。
作者以香豌豆幼苗为实验材料,研究了土壤中添加不同质量浓度Pb对香豌豆幼苗部分生长和生理生化指标的影响,以期为探讨豆科植物对重金属Pb的耐性机制及其对Pb污染环境的修复功能提供参考依据。
1 材料和方法
1.1 材料
供试香豌豆种子为当年自然结实的种子,购于江苏连云港苏北花卉园艺公司。
1.2 方法
1.2.1 幼苗培养及Pb处理方法 采用 Han等[8]的方法培养香豌豆幼苗。选择生长健壮、长势一致的幼苗(株高约5 cm)栽植于规格为10 cm×15 cm的塑料花盆中,每盆种植3株苗;盆内套2层塑料袋以避免土壤中Pb的流失,栽培基质为质量相同且已消毒的园土(用质量体积分数 0.15%HgCl2溶液消毒5 min),Pb以Pb(NO3)2形式一次性加入园土中;土壤中Pb的质量浓度分别设置为0(CK)、150、300、450和600 mg·kg-1,每处理3盆,每盆视为1次重复。实验期间每隔2天浇1次水。
1.2.2 生长及生理生化指标的测定 胁迫处理48 d后取出每一处理的所有植株,用自来水冲洗干净后再用蒸馏水洗净全株,吸干表面水分后用于各项生长和生理生化指标的测定。
从每一处理的各重复中任意选取2株苗,用直尺分别测量幼苗的株高(最长叶的长度)和根长(最长根的长度),结果取平均值。将幼苗分为地上部分和地下部分,置于105℃杀青2 h,然后于60℃条件下干燥至恒质量,分别称取地上部分和地下部分的干质量,并计算耐性指数。
分别取香豌豆幼苗地上部分和地下部分相同部位的鲜样测定各项生理指标。采用Zhou等[9]的方法测定相对电导率;参照李合生[10]的方法测定脯氨酸(Pro)含量、超氧化物歧化酶(SOD)活性和过氧化物酶(POD)活性;参考 Kampfenkel等[11]的方法测定抗坏血酸(AsA)含量;参考Ma等[12]的方法测定谷胱甘肽(GSH)含量。
1.3 数据计算和统计分析
按以下公式计算耐性指数:耐性指数=(处理组根长/对照组根长)×100%。应用Excel 2007和SPSS 13.0统计分析软件对实验数据进行统计和方差分析(ANOVA),并采用邓肯氏新复极差法对实验数据进行差异显著性分析。
2 结果和分析
2.1 Pb胁迫对香豌豆幼苗生长指标的影响
不同质量浓度Pb胁迫条件下香豌豆幼苗株高、根长、地上部分和地下部分干质量以及耐性指数的变化见表1。
由表1可以看出:随土壤中Pb质量浓度的提高,香豌豆幼苗的株高和根长基本呈不断下降的趋势。在Pb质量浓度为450和600 mg·kg-1的胁迫条件下香豌豆幼苗的株高和根长与对照均有显著差异(P<0.05),其中,在 Pb质量浓度为600 mg·kg-1的条件下香豌豆幼苗的株高和根长均最低,较对照分别降低24.0%和 27.5%。
由表1还可见:随土壤中Pb质量浓度的提高,香豌豆幼苗的地上部分与地下部分干质量也均呈现逐渐下降的趋势,且各处理组与对照均有显著差异(P<0.05)。在600 mg·kg-1Pb胁迫条件下,香豌豆的生长受到显著抑制,其地上部分和地下部分的干质量分别比对照降低42.9%和35.7%。
在Pb胁迫条件下,各处理组的耐性指数均低于对照,且随Pb质量浓度的提高,香豌豆幼苗的耐性指数表现为低质量浓度时增加、高质量浓度时降低的变化趋势。在300 mg·kg-1Pb胁迫条件下,香豌豆的耐性指数较对照降低幅度最小,仅下降6.04%,说明低质量浓度Pb胁迫对香豌豆幼苗生长的影响不大;而在600 mg·kg-1Pb胁迫条件下,香豌豆的耐性指数降低幅度最大,较对照下降27.51%,说明高质量浓度Pb胁迫条件下香豌豆对Pb的耐性降低,香豌豆幼苗生长受到明显抑制。
2.2 Pb胁迫对香豌豆幼苗生理生化指标的影响
2.2.1 对相对电导率和脯氨酸含量的影响 不同质量浓度Pb胁迫条件下香豌豆幼苗地上和地下部分相对电导率和脯氨酸(Pro)含量的变化见表2。
从实验结果(表2)可以看出:与对照相比,在不同质量浓度Pb胁迫条件下香豌豆幼苗地上部分和地下部分的相对电导率均随Pb质量浓度的提高呈逐渐增加的趋势。其中,150和300 mg·kg-1Pb处理组的相对电导率与对照无显著差异(P>0.05);而在450和600 mg·kg-1Pb胁迫条件下,幼苗地上和地下部分的相对电导率均显著高于对照 (P<0.05),其中,600 mg·kg-1Pb处理组地上和地下部分的相对电导率分别较对照增加65.3%和59.3%,说明在较高质量浓度Pb胁迫条件下,香豌豆的细胞膜受到较为严重的破坏。
表1 不同质量浓度Pb胁迫对香豌豆幼苗生长指标的影响(±SD)1)Table 1 Effect of Pb stress with different mass concentrations on growth indexes of Lathyrus odoratus Linn.seedlings(±SD)1)
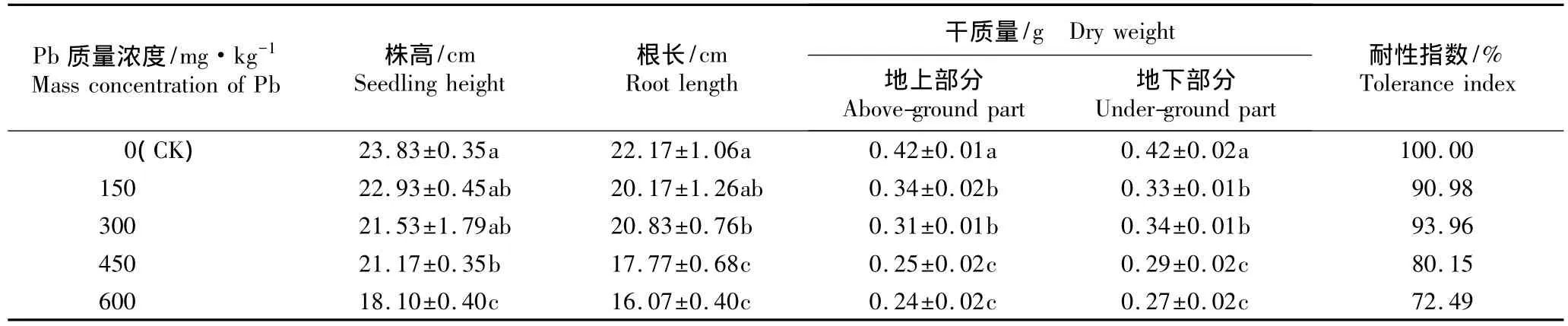
表1 不同质量浓度Pb胁迫对香豌豆幼苗生长指标的影响(±SD)1)Table 1 Effect of Pb stress with different mass concentrations on growth indexes of Lathyrus odoratus Linn.seedlings(±SD)1)
1)同列中不同的小写字母表示经邓肯氏新复极差检验差异显著(P<0.05)Different small letters in the same column indicate the significant difference by Duncan’s new multiple range test(P<0.05).
?
表2 不同质量浓度Pb胁迫对香豌豆幼苗不同部位相对电导率和脯氨酸含量的影响(±SD)1)Table 2 Effect of Pb stress with different mass concentrations on relative electric conductivity and proline content in different parts of Lathyrus odoratus Linn.seedlings(±SD)1)
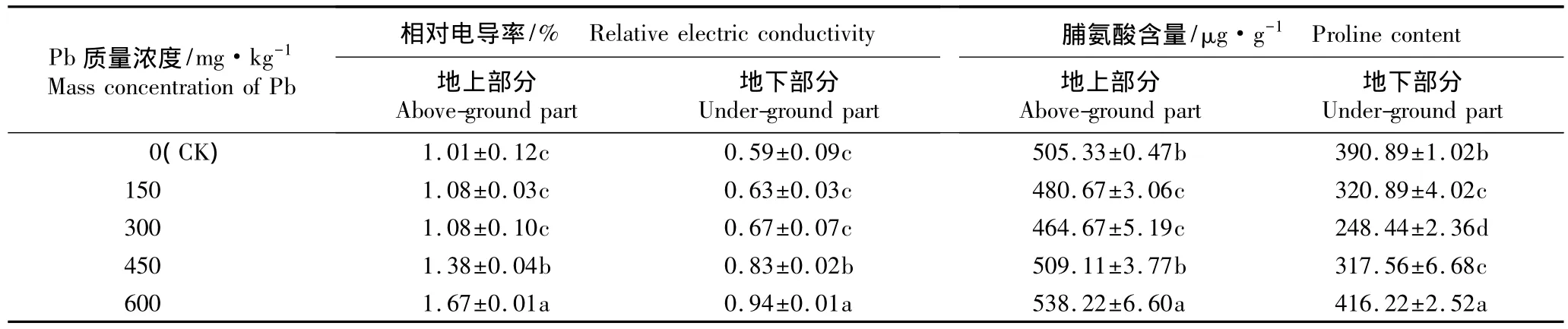
表2 不同质量浓度Pb胁迫对香豌豆幼苗不同部位相对电导率和脯氨酸含量的影响(±SD)1)Table 2 Effect of Pb stress with different mass concentrations on relative electric conductivity and proline content in different parts of Lathyrus odoratus Linn.seedlings(±SD)1)
1)同列中不同的小写字母表示经邓肯氏新复极差检验差异显著(P<0.05)Different small letters in the same column indicate the significant difference by Duncan’s new multiple range test(P<0.05).
?
由表2还可见:在不同质量浓度Pb胁迫条件下,香豌豆幼苗地上部分和地下部分的Pro含量均呈低浓度时降低、高浓度时增加的变化趋势。150和300 mg·kg-1Pb处理组地上部分和地下部分的Pro含量均显著低于对照(P<0.05),且在300 mg·kg-1Pb胁迫条件下地上部分和地下部分的Pro含量均达最低,分别较对照降低8.0%和36.4%。随Pb质量浓度的提高,地上部分和地下部分的Pro含量呈大幅增加的趋势,其中600 mg·kg-1Pb处理组的Pro含量均显著高于对照(P<0.05)。表明较高质量浓度Pb胁迫可诱导香豌豆体内Pro的积累以便提高植株的相对抗性,但较高质量浓度的Pb胁迫也可能导致其体内渗透调节物质的代谢失调,并最终影响植株的生长。
2.2.2 对SOD和POD活性的影响 不同质量浓度Pb胁迫条件下香豌豆幼苗地上和地下部分SOD和POD活性的变化见表3。
表3 不同质量浓度Pb胁迫对香豌豆幼苗不同部位SOD和POD活性的影响(±SD)1)Table 3 Effect of Pb stress with different mass concentrations on SOD and POD activities in different parts of Lathyrus odoratus Linn.seedlings(±SD)1)
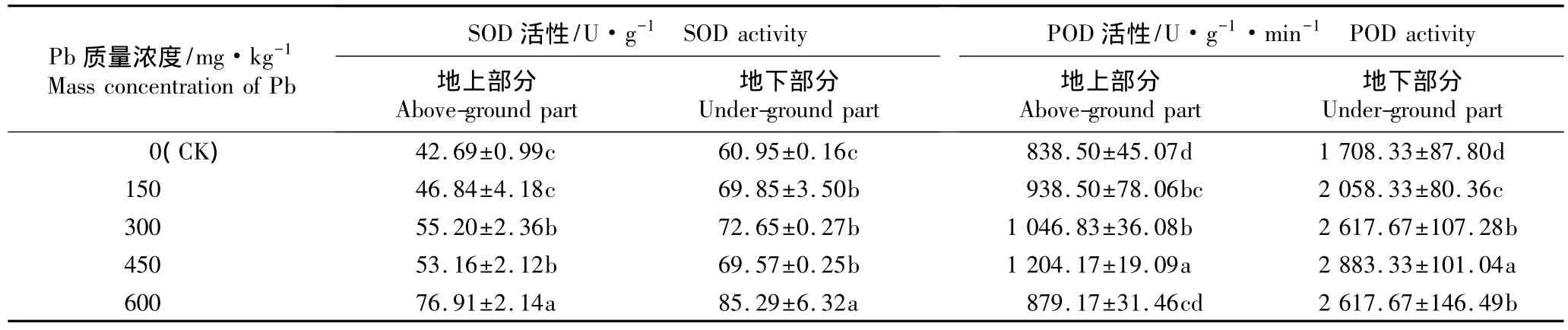
表3 不同质量浓度Pb胁迫对香豌豆幼苗不同部位SOD和POD活性的影响(±SD)1)Table 3 Effect of Pb stress with different mass concentrations on SOD and POD activities in different parts of Lathyrus odoratus Linn.seedlings(±SD)1)
1)同列中不同的小写字母表示经邓肯氏新复极差检验差异显著(P<0.05)Different small letters in the same column indicate the significant difference by Duncan’s new multiple range test(P<0.05).
?
实验结果(表3)表明:在不同质量浓度Pb胁迫条件下香豌豆幼苗地上部分和地下部分的SOD活性均高于对照,总体上与对照有显著差异(P<0.05)。在300 mg·kg-1Pb胁迫条件下香豌豆幼苗地上部分和地下部分的SOD活性分别仅较对照增加29.3%和19.2%;随Pb质量浓度的提高,地上和地下部分的SOD活性总体上呈逐渐增加的趋势,在600 mg·kg-1Pb胁迫条件下达到最高且显著高于对照和其他处理组(P<0.05),分别较对照增加 80.2% 和 39.9%。说明Pb胁迫对香豌豆幼苗叶片的保护酶系统未造成明显的伤害,这可能与Pb胁迫刺激了抗氧化酶的生物合成有关;随Pb胁迫的增强SOD对香豌豆细胞的保护作用也随之增强,表明SOD在香豌豆耐Pb过程中可能起到重要作用。
由表3还可见:在不同质量浓度Pb胁迫条件下香豌豆幼苗地上部分和地下部分的POD活性均高于对照,总体上与对照有显著差异(P<0.05)。在150~450 mg·kg-1Pb胁迫条件下,地上部分和地下部分的POD活性均随Pb质量浓度的提高呈逐渐增加的趋势,且450 mg·kg-1Pb处理组地上和地下部分的POD活性均达到最高,分别较对照增加43.6%和68.8%,说明在此浓度下香豌豆幼苗对Pb胁迫有较强的响应,POD活性的提高表明其体内抗氧化酶保护体系启动以保护香豌豆幼苗免受Pb胁迫的进一步伤害。然而,在Pb质量浓度为600 mg·kg-1的胁迫条件下,香豌豆幼苗地上部分和地下部分的POD活性均显著下降(P<0.05),说明高质量浓度Pb胁迫对香豌豆幼苗的保护酶系统造成破坏。
2.2.3 对谷胱甘肽和抗坏血酸含量的影响 不同质量浓度Pb胁迫条件下香豌豆幼苗地上部分和地下部分谷胱甘肽(GSH)和抗坏血酸(AsA)含量的变化见表4。
从实验结果(表4)可以看出:在150 mg·kg-1Pb胁迫条件下,香豌豆幼苗地上部分和地下部分的GSH含量均高于对照,分别比对照增加13.2%和6.0%;在450和600 mg·kg-1Pb胁迫条件下,香豌豆幼苗地上部分和地下部分的GSH含量均显著低于对照以及150和300 mg·kg-1Pb 处理组(P<0.05),其中,在600 mg·kg-1Pb胁迫条件下,香豌豆幼苗地上部分和地下部分的GSH含量均最低,与对照相比分别下降22.6%和38.0%。说明高质量浓度Pb胁迫对香豌豆幼苗地上部分和地下部分GSH的积累有显著抑制作用,导致其抗氧化能力降低。可见:低质量浓度Pb胁迫可促进香豌豆体内GSH的合成和积累,而高质量浓度Pb胁迫则对其有抑制作用。
由表4还可见:随Pb质量浓度的提高,香豌豆幼苗地上和地下部分的AsA含量呈低质量浓度条件下增加、高质量浓度条件下降低的趋势,但均与对照无显著差异(P>0.05)。其中,在300 mg·kg-1Pb胁迫条件下,香豌豆地上和地下部分的AsA含量均最高,但分别仅比对照增加9.7%和8.9%;在600 mg·kg-1Pb胁迫条件下,香豌豆地上和地下部分的AsA含量水平与对照基本一致。实验结果说明低质量浓度Pb胁迫对香豌豆体内AsA的合成和积累有一定的诱导作用,而高质量浓度Pb胁迫对AsA的合成及积累无明显的抑制作用。
表4 不同质量浓度Pb胁迫对香豌豆幼苗不同部位谷胱甘肽(GSH)和抗坏血酸(AsA)含量的影响(±SD)1)Table 4 Effect of Pb stress with different mass concentrations on glutathione(GSH)and ascorbic acid(AsA)contents in different parts of Lathyrus odoratus Linn.seedlings(±SD)1)
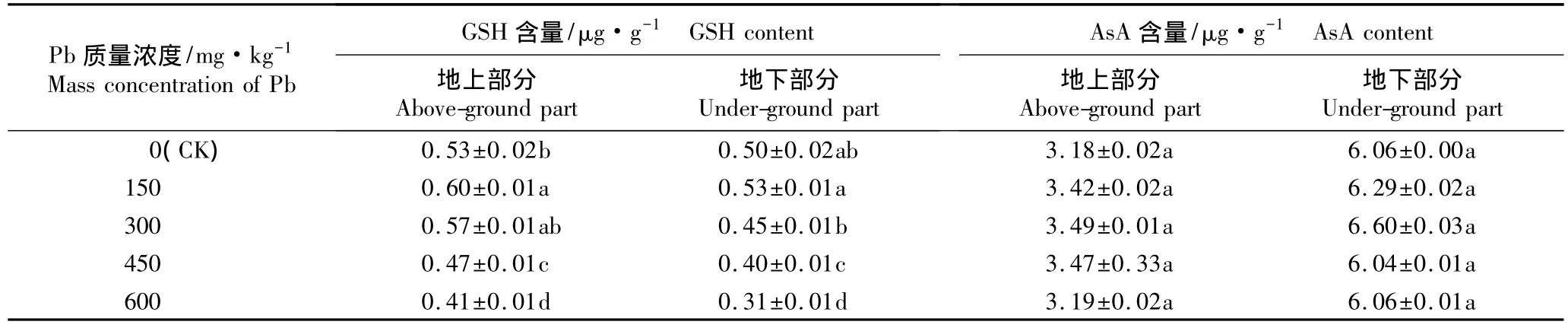
表4 不同质量浓度Pb胁迫对香豌豆幼苗不同部位谷胱甘肽(GSH)和抗坏血酸(AsA)含量的影响(±SD)1)Table 4 Effect of Pb stress with different mass concentrations on glutathione(GSH)and ascorbic acid(AsA)contents in different parts of Lathyrus odoratus Linn.seedlings(±SD)1)
1)同列中不同的小写字母表示经邓肯氏新复极差检验差异显著(P<0.05)Different small letters in the same column indicate the significant difference by Duncan’s new multiple range test(P<0.05).
?
3 讨论和结论
Pb是土壤中的主要重金属污染元素之一。已有的研究结果表明:适量的Pb能够促进植物生长,但过量的Pb可导致植物体内Pb累积并对植物造成毒害作用,严重时可导致植株死亡[1,3]。干物质含量直接反映了植物的产出能力,是重金属胁迫条件下分析植物生长状况的重要参考指标之一。本研究结果表明:在不同质量浓度Pb胁迫条件下,各处理组香豌豆幼苗的株高、根长以及地上部分和地下部分的干质量均低于对照,而且随土壤中Pb质量浓度的提高总体上呈现逐渐降低的趋势。说明在Pb胁迫条件下香豌豆幼苗的生长均受到一定的影响,由此也可以看出,香豌豆对Pb胁迫的耐性并不强,其耐性指数的变化也说明了这一点。
实验结果显示:Pb胁迫使香豌豆的膜系统受到损伤,导致细胞内电解质外渗;随Pb质量浓度的提高,相对电导率呈上升趋势;在600 mg·kg-1Pb胁迫条件下香豌豆地上和地下部分的相对电导率显著高于对照,说明其膜系统受到明显的损害。脯氨酸(Pro)是植物细胞内重要的渗透调节物质,与植物体内活性氧自由基的清除以及细胞膜脂过氧化程度的减轻密切相关[13];而香豌豆体内Pro含量也均随Pb质量浓度的提高呈逐渐增加的趋势,与细胞膜系统的损伤趋势基本一致。
超氧化物歧化酶(SOD)和过氧化物酶(POD)是植物体内清除氧自由基的酶类,重金属胁迫诱发植物体内的活性氧含量增加,也使其体内SOD和POD活性随之增强,以有效减轻活性氧对植物体的伤害程度[13]。在本实验中,香豌豆幼苗的SOD活性随着Pb质量浓度的提高而增强,说明在Pb胁迫条件下,香豌豆清除自由基的能力增强,从而提高植株的抗逆能力。重金属胁迫下植物体内POD活性的提高在一定程度上可以减轻细胞受毒害的程度。本实验中,在Pb质量浓度低于450 mg·kg-1的胁迫条件下随Pb质量浓度的提高香豌豆幼苗地上和地下部分的POD活性不断升高,而当Pb质量浓度继续升高时POD活性降低,说明香豌豆对Pb胁迫的耐性是有限的,当Pb质量浓度过高时细胞内的POD合成受到影响,表明植物体受到明显的伤害。
谷胱甘肽(GSH)和抗坏血酸(AsA)是普遍存在于植物体内的水溶性抗氧化成分,在植物抗氧化胁迫、清除活性氧自由基等方面都具有重要作用[12]。本实验结果表明:低质量浓度(150 mg·kg-1)Pb胁迫对香豌豆体内GSH的合成有促进作用,而高质量浓度Pb胁迫则抑制GSH的合成,从而导致香豌豆的抗氧化能力降低,生长也受到抑制[14]。本实验结果还证实:在较低质量浓度Pb胁迫条件下,AsA在增强香豌豆抗Pb性方面发挥了重要作用;而高质量浓度Pb胁迫下AsA含量仅略有下降,说明香豌豆对Pb胁迫具有一定的耐性。总体上看,Pb胁迫导致香豌豆体内产生大量的活性氧自由基,打破了活性氧产生与清除的平衡,致使体内的活性氧不能及时清除,最终导致植株受到伤害[15]。
经过综合分析可见:在不同质量浓度Pb胁迫条件下,香豌豆植株的生物量、膜系统的完整性及透性、保护酶的活性和活性氧的代谢均受到不同程度的影响,但总体上表现出对低浓度Pb胁迫具有一定的耐性,可用于轻度Pb污染环境的修复。
[1]高文谦,陈玉福.铅污染土壤修复技术研究进展及发展趋势[J].有色金属,2011,63(1):131-136.
[2]张丽丽,赵九洲,赵婷婷,等.重金属铅和镉对溪荪生理特性的影响[J].湿地科学,2011,9(2):198-202.
[3]付佳佳,韩玉林,李亚亚,等.Pb、Cd单一及复合胁迫对花菖蒲幼苗生长及部分生理指标的影响[J].植物资源与环境学报,2010,19(3):23-27.
[4]陈丽娜,唐明灯,艾绍英,等.Pb胁迫条件下3种叶菜的生长和生理响应及其抗性差异[J].植物资源与环境学报,2010,19(4):78-83.
[5]HARRIS J A,BIRCH P,PALMER J P.Land Restoration and Reclamation:Principles and Practice[M].Singapore:Addison-Wesley Longman,1996.
[6]HERRERA M A,SALAMANCA C P,BAREA J M.Inoculation of woody legumes with selected arbuscular mycorrhizal fungi and rhizobia to recover deseritified Mediterranean ecosystems[J].Applied and Enviromental Microbiology,1993,59(1):129-133.
[7]缪福俊,熊 智,孙 浩,等.兰坪铅锌尾矿区豆科植物根瘤菌耐受性研究[J].安徽农业科学,2010,38(21):11365-11367,11426.
[8]HAN Y L,YUAN H Y,HUANG S Z,et al.Cadmium tolerance and accumulation by two species of Iris[J].Ecotoxicology,2007,16(8):557-563.
[9]ZHOU Y Q,HUANG S Z,YU S L,et al.The physiological response and sub-cellular localization of lead and cadmium in Iris pseudacorus L.[J].Ecotoxicology,2010,19(1):69-76.
[10]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[11]KAMPFENKEL K,Van MONTAGU M,INZÈ D.Extraction and determination of ascorbate and dehydroascorbate from plant tissue[J].Analytical Biochemistry,1995,225(1):165-167.
[12]MA F W,CHENG L L.The sun-exposed peel of apple fruit has higher xanthophyll cycle-dependent thermal dissipation and antioxidants of the ascorbate-glutathione pathway than the shade peel[J].Plant Science,2003,165(4):819-827.
[13]HUANG S Z,HAN Y L,YU S L,et al.The effect of lead and copper on the growth and physiological response of water flower Iris pseudacorus L.[J].Fresenius Environmental Bulletin,2011,20(9):2246-2250.
[14]钱琼秋,宰文珊,朱祝军,等.外源硅对盐胁迫下黄瓜幼苗叶绿体活性氧清除系统的影响[J].植物生理与分子生物学学报,2006,32(1):107-112.
[15]耶兴元,何 晖,仝胜利.抗坏血酸与植物抗氧化性的关系[J].信阳农业高等专科学校学报,2009,19(1):123-124.
