早产儿、足月儿缺血缺氧性脑损伤的MRI表现
2013-12-13汤易刘影
汤易,刘影
安徽医科大学附属省立医院影像科,合肥 230001
新生儿缺血缺氧性脑损伤(hypoxic-ischemic brain damage, HIBD),尤其是重度窒息所致的足月儿缺血缺氧性脑病(hypoxic-ischemic encephalopathy, HIE)是新生儿死亡或致残的主要病因之一[1]。然而,目前用于评估HIBD的指标主要依赖于临床表现及Apgar评分,缺乏客观标准。MRI能够敏感地检测出HIBD病灶,明确病灶范围、性质。在HIBD的诊断及预后评估中MRI展现出广阔的前景。笔者分析40例HIBD MR影像资料,比较早产儿及足月儿HIBD的MRI特点。
1 材料与方法
1.1 临床资料
搜集HIBD患儿40例,男21例,女19例。其中早产儿20例,平均胎龄(33.7±5.5)周;足月产20例,平均胎龄(40.4±3.6)周。所有患儿均有不同程度的窒息史,早产儿轻-中度窒息17例,重度窒息3例;足月患儿组分别为12例及8例,其中符合足月儿HIE诊断标准者5例。所有患儿均排除由新生儿高胆红素血症、新生儿低血糖、炎症、代谢性疾病及先天性疾病等所致脑损伤的可能。
1.2 成像方法
患儿均于出生后10 d内进行1.5 T Avanto MR 扫描。扫描前患儿服用10%的水合氯醛0.3~0.5 ml/(kg/次),镇静入睡。扫描序列:轴面T1WI TR 202.0 ms,TE 4.8 ms,层厚 4~5 mm);T2WI TR 4000.0 ms,TE 92.0 ms,层厚4~5 mm;矢状面T1WI TR 202.0 ms,TE 4.8 ms,层厚4~5 mm;FLAIR TR 9850.0 ms,TE 92.0 ms,TI 2560.0 ms,层厚4~5 mm,FOV 230 mm×230 mm,NEX为2;DWI采用单次激发快速自旋回波序列(SSFSE)b=1000 s/mm2,TR 3600.0 ms,TE 102.0 ms,层厚4~5 mm;SWI TR 49.0 ms,TE 40.0 ms,层厚4~5 mm;MinIP后处理以层厚4 mm、层间距1 mm重建轴面像。
1.3 图像分析
由2名副主任医师在1.5 T M R扫描仪syngoMMWP工作站(软件版本:VE32B)对所有图像进行分析,记录所见损伤部位,包括异常信号部位(室周白质、分水岭区白质、基底节区核团、内囊区、胼胝体、脑干、小脑、海马区域等),异常信号范围(室周白质异常信号描述为局灶性、多发斑片状、片状,皮层异常信号描述为局灶性、局限性、弥漫性皮层损伤)。异常信号包括基底节核团区、室周白质、皮层及分水岭白质区,不能具体某一主要损伤类型时,则定义为弥漫性损伤。两者意见不一致时,以年资较高的医师意见为准,最终形成一致结论。
1.4 统计学方法
采用SPSS 13.0统计软件,将2名医师对所有序列像评估结果进行一致性检验。定义Kappa值≤0.4为一致性不够理想、0.5~0.75之间为一致性较为满意、0.76~1.00为一致性相当满意;计数资料比较采用卡方检验,不符合卡方检验的条件,改用确切概率法。以P<0.05为差异有统计学意义,分析损伤类型在早产儿、足月产儿及轻-中度、重度组内的差异。
2 结果
2.1 HIBD患儿病变分布部位
40例HIBD患儿病灶分布于基底节核团区、室周白质、皮层及皮层下白质、分水岭区白质、胼胝体、小脑、脑干、海马区。2名医师对上述病灶部位及形态判断均取得较满意和相当满意的一致性。病灶分布及观察者一致性检验结果见表1。
2.2 HIBD患儿病变类型
基底节核团区损伤可见于早产儿及足月儿,病灶可累及尾状核、豆状核、背侧丘脑、内囊区及其辐射区;单纯室周白质缺血性损伤可见于早产儿、足月儿,但就病灶形态而言,早产儿与足月儿确有不同;室周出血性损伤主要见于早产儿,包括室管膜下生发基质层、室周白质斑片状出血灶;皮层及分水岭区白质损伤主要见于足月产患儿,损伤主要表现为旁矢状区皮层及前、后分水岭区局限性损伤;胼胝体损伤见于早产、足月儿,多伴随其他部位的损伤出现,胼胝体膝部、压部表现为单独或同时损伤。40例早产、足月HIBD患儿主要损伤类型差异见表2。
2.3 不同窒息程度HIBD患儿脑损伤类型
轻-中度窒息在早产儿主要导致室周白质缺血性及脑室旁出血性损伤,而在足月儿则主要导致皮层及分水岭区损伤;重度窒息可导致早产、足月儿基底节核团区、脑干、小脑、海马区损伤,以及足月儿脑内弥漫性损伤,后者表现为脑皮层及皮层下白质、基底节核团区、室周白质区等部位弥漫性损伤;轻度-中度及重度窒息均可导致早产、足月儿胼胝体损伤。40例不同程度窒息HIBD患儿损伤类型差异见表3。

表1 40例患儿HIBD病灶(分布及形态)评估结果(例)Tab.1 40 neo nates HIBD lesions (distribution and morphology) evaluated results (case)

表2 早产儿(20例)、足月儿(20例)HIBD类型(例)Table 2 preterm neo nates (20 cases) and full-term neo nates (20 cases) HIBD types (case)
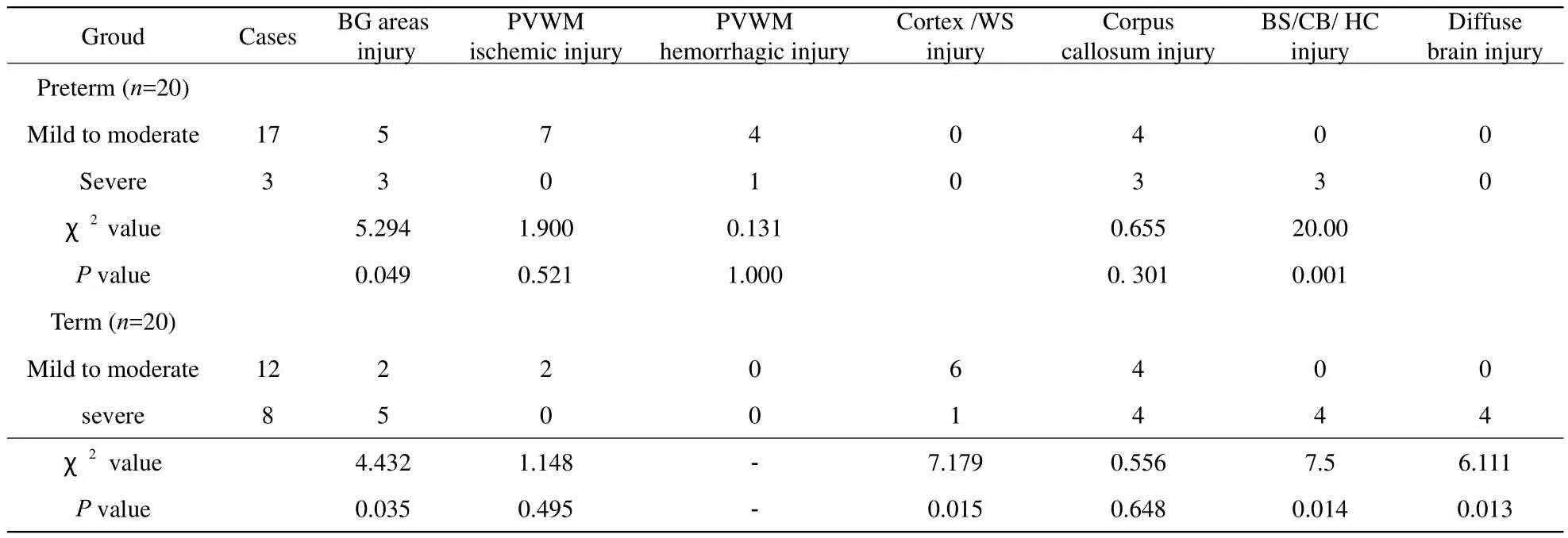
表3 40例轻-中度及重度窒息HIBD患儿损伤类型(例)Tab.3 40 mild to moderate and severe asphyxia neonates HIBD types (case)
3 讨论
3.1 HIBD发病机制
HIBD是围生期新生儿脑损伤的主要疾病之一。缺氧是发病机制中的关键,在细胞能量代谢异常基础上产生一系列病理生理变化即瀑布效应,如再灌注损伤,氧自由基、钙超载,兴奋性氨基酸毒性作用及炎症反应等,最终导致细胞死亡。上述病理生理变化使脑血流量减少,加重细胞能量代谢障碍,两者互为因果,共同促进疾病的进一步发展[1]。与成人重度窒息所致脑灰质弥漫性受损不同,HIBD对新生儿脑组织的损伤具有选择性,这同新生儿脑血管解剖生理、脑组织各部位对能量需求强弱及缺血缺氧发生的时间、性质等有关。因此处于不同成熟度的早产儿、足月儿在遭遇不同性质缺氧的情况下,脑损伤展示出不同特点[2-5]。
3.2 早产儿、足月儿HIBD主要损伤类型及MRI表现
3.2.1 基底节核团区损伤
基底节核团区损伤包括基底节核团、内囊、背侧丘脑损伤(图1),多源于急性完全性窒息,少数患儿伴随着明确的围生期“前哨事件”,如子宫破裂、胎盘早剥等。当发生急性完全性窒息时,脑内血流再分布的代偿机制失效,损伤常发生于代谢能量需求最旺盛的基底节、丘脑等部位。本组中早产儿8例,足月儿7例(P=0.744)出现基底核团区损伤,与Logitharajah等[6]的研究结果一致,表明此种损伤类型同胎龄无关。于T1WI、T2WI、FLAIR,像基底节核团区损伤表现为核团分界不清,呈不均性信号,扩散成像可见明显扩散受限,足月产患儿中常可见到内囊后肢高信号缺如(posterior limb of the internal capsule,PLIC),中央沟附近皮层区信号异常。远期MR影像可见基底核团萎缩、背侧丘脑囊变及中央皮层区的持久T2WI高信号。结局可导致严重的运动障碍,常表现为脑瘫。大量报道肯定PLIC对HIBD不良结局的预后价值,尤其在基底节核团损伤类型中[7]。
3.2.2 室周白质损伤
室周白质损伤主要包括室周白质缺血性损伤、室周出血性损伤。脑室周围深部白质由大脑动脉长穿支供血,皮层下白质区供血是大脑动脉的短穿支。室周白质缺血性损伤病灶常位于侧脑室体部、前角旁及三角部外侧白质深部区域,对应于上述早产儿大脑动脉的分界区及终末区,MRI表现为多发斑片、片状异常信号(图2)。上述异常信号来源不明[8],可能为细胞坏死后蛋白局限性聚集、局部的胶质反应增生或者出血成分等;室周白质缺血性损伤在足月产患儿则表现为散在点状异常信号(图3),常伴随着其他部位的损伤存在。
Rutherford等[4]称足月患儿白质局灶性损伤而无基底核团受损的情况不常见,如果存在常表明在产前或较早胎龄时损伤情况已发生,临床病程不典型,预后常较好。
本组病例中足月儿室周白质损伤9例,其中仅2例为单纯白质缺血性损伤,表现为点状短T1、短T2信号,临床表现为非典型性脑损伤症状。而早产儿7例单纯室周白质缺血性损伤,其中5例表现为室周多发斑片状异常信号,2例表现为融合成片状的异常信号;足月儿及早产儿单纯室周白质缺血性损伤在本组研究数据中未见明显统计学差异(P=0.130),且轻-中度及重度窒息均可表现为单纯室周白质缺血性损伤(P=0.521、P=0.495),但就早产、足月儿HIBD病灶的形态如上述确有差别,前者远期结局很有可能演变为PVL。
室周出血性损伤主要指生发基质层出血(germinal matrix hemorrhagic,GMH)。GMH发生率与胎龄密切相关,Volpe[9]较早的研究表明其发生率与胎龄、体重呈反比,胎龄>34周患儿发生率显著下降。
本组中5例室周出血性损伤均见于早产患儿,统计分析其在早产与足月儿组中发生率有统计学差异(P=0.047)。轻-中度及重度窒息均可导致此种损伤(P=1.000);生发基质形成于第7周左右,消失于第28周左右,分布于侧脑室和第三脑室周围,最后退缩于尾状核头部,MRI信号表现为T1WI高信号,T2WI低信号。生发基质以薄片形态分布于室壁周围,相应区域血管密度及面积大,但由于血管常为单层内皮,缺少平滑肌,周围亦缺少弹力纤维支持,故对抗血流冲击能力差,易破损出血或可破入脑室,于T1WI、FLAIR像出血灶表现呈高信号,T2WI为低信号,SWI可见明显磁敏感效应,呈极低信号(图4)。病灶也可导致髓质引流静脉血栓引起脑室旁静脉出血性梗死等。

图1 胎龄38周,成像时间生后8 d,重度窒息。T1WI(A、B)示正常内囊后肢生理高信号消失,基底核团、丘脑、罗兰多皮层区信号增高。DWI示基底核团、背侧丘脑及罗兰多皮层区弥散受限。图2 胎龄34周,成像时间生后4天,轻-中度窒息,患儿嗜睡、四肢肌张力低。DWI示室周白质损伤 图3 患儿3天,胎龄38周,轻度窒息,无典型HIBD症状。T1WI示室周白质散在异常信号分布。与图2病灶融合成片不同 图4 患儿3天,胎龄32周,重度窒息,拥抱反应活跃,抽搐。轴位T1WI(A、B)示右侧室旁及侧脑室内高信号。SWI (C、D)示室管膜下生发基质层出血、脑室积血Fig.1 Born at 38 weeks, images taken on day 8 after birth.Severe asphyxia, the normal myelinated PLIC is not visible and diffuse inhomogeneous hyperintensity signal is prsesent at the level of basal ganglia, thalami (A) and Perirolandic cortex (B) on the T1WI.DWI (C, D) shows restricted diffusion in the basal ganglia, thalami and perirolandic cortex.Fig.2 Born at 34 weeks.Images taken on day 4 after birth.Mild to moderate asphyxia, the infant being lethargic and hypotonic.DWI clearly demonstrates restricted diffusion in periventricular white matter.Fig.3 Born at 38 weeks.Images taken on day 3 after birth.Mild asphyxia, the infant being without typical symtoms of HIBD.T1WI show scattered abnormal signal distribution in the periventricular white matter.It is markedly different from conf l uent abnormal signal that depicted Fig2.Fig.4 Born at 32 weeks.Images obtained on day 3 after birth.Severe asphyxia, the infant being embrace ref l ex activity and with seizures.Axial T1WI (A, B) show hyperintensity periventricular and interaventricular.SWI (C, D) suggest hemorrhages inside in the region of the germinative matrix and interaventricular.
3.2.3 皮层及皮层下白质损伤
皮层及皮层下白质损伤主要包括旁矢状区皮层及分水岭区白质损伤,为足月产儿损伤的主要形式(图5)。
本组中7例皮层及分水岭区白质损伤均见于足月儿(P=0.013),包括1例为局灶性皮层出血性损伤,1例弥漫性皮层损伤,5例旁矢状区皮层损伤,4例分水岭区白质损伤(合并皮层损伤)。此种类型损伤主要与脑灌流障碍有关,多源于慢性不完全性窒息。对本组病例分析中,可见其在轻-中度及重度窒息患儿组中有统计学差异(P=0.015)。慢性不全性窒息情况下血液重新分布以保证心、脑血供,但持续的血压下降,导致脑内血液二次分布,即前循环血管收缩,后循环循环扩张,丘脑、脑干、小脑血供增加,因而大脑后旁矢状区则较易受损,常累及大脑前-中及中-后动脉分界处皮层及白质,可为单或(和)双侧、前或(和)后分水岭区。MRI表现为T1WI呈局灶性、局限性及弥漫性皮层信号增高,T2WI脑白质肿胀,脑灰白质分界不清,扩散成像示病灶区呈明显扩散受限。结局可导致行为、语言、认知障碍等[10];值的一提的是在重度、持续窒息情况下,可导致包括基底节核团区、室周白质、皮层及分水岭区白质等部位弥漫性损伤(图6),此时难以归于具体损伤类型。本组中有4例重度HIBD所致的脑内弥漫性损伤均见于足月产患儿。

图5 胎龄40+4周,成像时间生后9 d,轻-中度窒息。T1WI像(A)示双侧大脑半球皮层信号增高, DWI清楚显示部分皮层,双侧后分水岭区及胼胝体压部弥散受限 图6 患儿41周,成像时间生后1 d。重度窒息,拥抱反射活跃,频繁抽搐。DWI示双侧基底节核团,双侧大脑半球皮层及前、后分水岭区白质,胼胝体,海马区弥散受限 图7 胎龄38+4周,成像时间生后4 d,否认窒息史。严持续低血糖伴频繁抽搐。DWI、ADC图(A、B)清楚显示枕叶(后旁矢状区)弥散受限。同典型的皮层及分水岭区HIBD表现相似 图8 胎龄40周,成像时间生后8 d,否认窒息史。FLAIR (A)像可见双侧苍白球高信号,DWI (B)示丘脑底核可疑异常高信号。选择性的苍白球及有或无丘脑底核受累有助于HIBD鉴别Fig.5 Born at 40+4 weeks.Images obtained on day 9 after birth.Mild to moderate asphyxia.T1WI (A) show the cortex of both hemispheres increased signal intensity.DWI clearly demonstrates restricted diffusion in the cortex, both posterior watershed areas.Fig.6 Born at 41 weeks.Images obtained on day 1 after birth.Severe asphyxia, the infant being embrace ref l ex activity and frequently seizures.DWI demonstrates restricted diffusion in the basal ganglia, corpus the cortex of both hemispheres and the anterior, posterior watershed as well as the callosum and hippocampal areas.Fig.7 Born at 38+4 weeks.Images obtained on day 4 after birth, denied history of asphyxia.severe lasting neonatl hypoglycamia with frequently seizures.DWI and ADC map (A,B) is demonstrated clearly diffusion restriction in the occipital lobes (posterior parasagittal cortex) resembling in some way the characteristic HIBD Cortex and watershed areas injury. Fig.8 Born at 40 weeks.Images obtained on day 8 after birth, denied history of asphyxia.FLAIR hyperintensity (A) is visible on both globi pallidi.DWI shows doubtful abnormal hyperintensity on the subthalamic nuclei (B).The selectiveness of pallidal involvement, together with or without the thalami, however, contribute to differentiate bilirubin encephalopathy from HIBD.
3.2.4 胼胝体损伤及脑干、小脑、海马区损伤
扩散成像对胼胝体损伤的显示有独特的优越性,本组中15例胼胝体受损(包括6例胼胝体膝部、压部同时受损)均是在扩散成像上观察到。Barkovich等[8]指出胼胝体膝部或压部扩散异常不能够预测远期的结局,但胼胝体后期形态的变薄却同不良结局有显著的关系。诊断方面,他们认为胼胝体扩散信号的改变继发于皮层或皮层下白质损伤,因此胼胝体扩散异常的出现可能较延迟。但Twomey等[11]的研究却观察到出现胼胝体扩散异常的病例组检查时间早于胼胝体扩散正常的病例组。
本研究组中,胼胝体扩散异常见于早产及足月儿(P=0.744),且在轻-中度及重度窒息患儿组中无统计学差异(P=0.301,P=0.648)。扩散异常组检查时间上早产儿7例,平均7.5 d,无胼胝体扩散异常13例,平均时间4.3 d;而在足月产儿8例,平均6.0 d,12例平均4.5 d。早产儿组、足月产儿组中胼胝体扩散异常组检查时间均晚于无胼胝体扩散异常组。
早产儿、足月儿均可见脑干、小脑或海马区损伤(P=1.000)。本组中7例脑干受累病例,其中1例合并小脑损伤,1例合并海马损伤,均见于重度窒息患儿组(P=0.001,P=0.014)。内囊、大脑脚及延髓水平下行皮质纤维束继发损伤又被称为Prewallerian变性[12],通常在6~12周或者稍长时间内可出现。出生时Wallerian变性常提示患儿脑在产前已受损,预示先天性脑瘫的可能性大。扩散成像对此损伤显示有其独特的优越性。
3.3 鉴别诊断
新生儿低血糖脑病、高胆红素脑病、炎症等所致脑损伤常与HIBD MRI表现相似,尤其是前两者。严重的低血糖脑病可致顶枕叶皮层及皮层下损伤(图7),同前述的HIBD脑损伤相似,但后者仅限于脑的后半部分损伤[13]。新生儿胆红素脑病可致双侧苍白球T1WI高信号(图8),常与HIBD所致的豆状核损伤相混淆,但前者常为典型的苍白球、有或无丘脑底核损伤,而后者常弥漫累及双侧尾状核、壳核及丘脑其余部分[14]。
综上所述,由于新生儿胎龄、窒息程度不同,HIBD MRI表现出典型损伤特点。尽管本研究采取多序列像信息相互补充,力求准确判断损伤的性质及其具体类型。但在临床最为困难的是很多情况下损伤发生的确切时间不明,HIBD病灶MRI表现可能随时间演变对损伤类型的判断结果造成影响。本研究另一不足之处在于尽管采取多名医师共同判断的研究方法,以求克服主观误判,但主观局限性也不免存在,随访研究可能增强结果的可信度;可能由于不同部位脑组织对HIBD的反应及随时间演变不同,造成不同序列像对HIBD病灶的检出的敏感性及特异性不同。有报道肯定了DWI在HIBD检查中的早期检出病灶优越性,同时也指出其早期低估病灶范围、稍晚期(1周末)出现假正常化的局限性[15]。因此就提高HIBD的MRI诊断准确性而言,有必要对各成像序列像的特点及其检出病灶的价值做进一步研究,也是本笔者将进一步深入的方向。
[References]
[1]Han YK, Yang YJ, Shao XM.Neonatal hypoxic-ischemic encephalopathy.Beijing: People’s Medcal Publishing House, 2010:255-265.韩玉坤, 杨于嘉, 邵肖梅, 等.新生儿缺血缺氧性脑病.北京: 人民卫生出版社, 2010: 255-265.
[2]de Vries LS, Groenendaal F.Patterns of neonatal hypoxic-ischemic brain injury.Neuoradiology, 2010, 52(6): 555-566.
[3]Shroff MM, Soares-Fernandes JP, Whyte H, et al.MR imaging for diag nostic evaluation of encephalopathy in the newborn.Radiographics, 2010, 30(3): 763-780.
[4]Rutherford M, Biarge MM, Allsop J, et al.MRI of perinatal brain injury.Pediatr Radiol, 2010, 40(6): 819-833.
[5]JI X, Fan GG.Continuous arterial spin labeling MR perfusion imaging in diagnosis of hypoxic ischemic encephalopathy in full-term neonates:Preliminary study.Chin J Magn Reson Imaging, 2011, 2(1): 60-64.冀旭, 范国光.连续动脉自旋标记磁共振灌注成像对足月缺氧缺血性脑病患儿的初步研究.磁共振成像, 2011, 2(1): 19-23.
[6]Logitharajah P, Rutherford MA, Cowan FM.Hypoxic ischaemic encephalopathy in the preterm infant: antecedent factors, brain imaging and outcome.Pediatr Res, 2009, 66(2): 222-229.
[7]Liauw L, van der Grond J, vanden Berg-Huysmans AA, et al.Hypoxic-ischemic encephalopathy: diagnostic value of conventional MR imaging pulse sequences in term-born neonates.Radiology, 2008,247(10): 204-212.
[8]Barkovich AJ, Miller SP, Bartha A, et al.MR imaging MR spectroscopy, and Diffusion tensor imaging of sequential studies in neonates with encephalopathy.AJNR Am J Neuroradiol, 2006, 27(3):533-547.
[9]Volpe JJ.Brain injury in the premature infant: overview of clinical aspects, neuropathology, and pathogenesis.In: Volpe JJ.Neurology of the newborn.Philadelphia: Elsevier Inc, 2008: 279-347.
[10]Steinman KJ, Gorno-Tempini ML, Glidden DV, et al.Neonatal watershed brain injury on magnetic resonance imaging correlates with verbal IQ at 4 years.Pediatrics, 2009, 123(3): 1025-1030.
[11]Twomey E, Twomey A, Ryan S, et al.MR imaging of term infants with hypoxic-ischemic encephalopathy as a predictor of neurodevelopmental outcome and late MRI appearances.Pediatr Radiol, 2010, 40(9): 1526-1535.
[12]Domi T, de Veber G, Shroff M, et al.Corticospinal tract pre-wallerian degeneration: a novel outcome predictor for pediatric stroke on acute MRI.Stroke, 2009, 40(3): 780-787.
[13]Burns CM, Rutherford MA, Boardman JP, et al.Patterns of cerebral injury and neurodevelopmental outcomes after symptomatic neonatal hypoglycemia.Pediatrics, 2008, 122(1): 65-74.
[14]Govaert P, Lequin M, Swarte R, et al.Changes in globus pallidus with(pre)term kernicterus.Pediatrics, 2003, 112(6): 1256-1263.
[15]Mu L, Yang J, Yu BL.Neonatal hypoxic-ischemic encephalopathy:detection with diffusion-weighted and diffusion-tensor MR imaging.Chin J Magn Reson Imaging, 2010, 1(1): 60-64.穆靓, 杨健, 鱼博浪.磁共振弥散加权及张量技术在新生儿缺血缺氧性脑病中的应用.磁共振成像, 2010, 1(1): 60-64.
