产类细菌素乳酸菌的筛选及培养条件优化
2013-12-10陈宏伟地力扎尔阿扎提张秀萍
陈宏伟 地力扎尔·阿扎提 张秀萍*
(1 新疆生产建设兵团畜牧科技重点实验室,阿拉尔新疆 843300)
(2 塔里木大学动物科学学院,阿拉尔新疆 843300)
乳酸菌(Lactic acid bacteria,LAB)是一群形态代谢性能和生理学特征不完全相同的能发酵碳水化合物产生乳酸的革兰氏阳性细菌的通称[1]。乳酸菌产品以其独特的生物学功能呈现出前所未有的商业开发利用价值。乳酸菌产生具有抑菌或杀菌效果的有机酸、过氧化氧、双乙酰和细菌素。乳酸菌细菌素以其安全、高效、无毒副作用和无抗药性等优点,已经引起广大从事食品防腐剂、饲料添加剂以及医药开发人员的研究热情,成为国内外研究的热点[2-3]。本研究从苜蓿青贮、牛奶及奶酪、酸菜中的分离到4个可产生类细菌素菌株:戊糖乳杆菌、植物乳酸菌、戊糖片球菌、丙酸杆菌。并对其产类细菌素条件的发酵条件进行优化,旨在为其进一步开发提供理论依据。
1 材料与方法
1.1 实验材料及培养基
苜蓿青贮、牛奶、酸菜、奶酪。分离株粗提发酵液。MRS、M17培养基,乳酸菌成套生化鉴定管(青岛海博生物技术有限公司),3%H2O2溶液。指示菌:大肠杆菌、金黄色葡萄球菌(塔里木大学预防兽医学实验室提供)。
1.2 方法
1.2.1 乳酸菌分离鉴定
分离培养将苜蓿青贮、牛奶、酸菜、奶酪制备成10倍梯度稀释液,吸取10-4、10-5和10-6三个稀释度的稀释液1ml于灭菌平皿中,向平皿中倒入适量 MRS、M17琼脂培养基混匀冷却后,放置在30℃培养箱中培养24~48 h,挑取使培养基变黄的单菌落,在平板上划线分离,经革兰氏染色,反复纯化后保存斜面。
产乳酸的鉴定将分离菌株以接种于MRS、M17琼脂液体培养基中,30℃静置培养48 h,得各菌株的发酵液。采用纸层析法定性测定乳酸[4]。
生化特性鉴定糖醇类发酵试验。将分离菌株以接种于生化鉴定管中,放置在30℃培养箱中培养24~48 h后,鉴定细菌的属、种。
1.2.2 产类细菌素菌株的筛选
发酵液的制备将分离株纯培养物接种到MRS液体培养基中,30℃培养48 h,4℃离心15 min,上清液用滤膜过滤,除去菌体及其他杂质,得到发酵滤液。
纸片法预测抑菌效果将50片直径为6 mm无菌滤纸片浸泡于0.5 ml发酵液中,过夜干燥后,分别测试对指示菌的抑菌效果。
H2O2、乳酸作用的排除[5]设3个不同处理发酵滤液:发酵液原液组,发酵滤液不做任何处理,测试对指示菌的抑制效果。排H2O2作用组,发酵滤液中加入等量10 mg/mL的过氧化氢酶液,30℃水浴60 min后对指示菌进行抑菌试验。排乳酸作用组,将乳酸调无菌水pH与待测发酵滤液pH相同(pH=6.0),分别测定乳酸水与发酵上清液对指示菌抑菌活性。
抑菌物质效价的测定采用牛津杯平板扩散法测试3个试验组发酵滤液对指示菌的抑制效果[6]。将指示菌涂布接种于MRS或M17琼脂平皿中,将发酵滤液吸取100 μL加入到牛津杯中,30℃培养24 h,测量抑菌圈的大小,并计算抑菌物质效价。
抑菌物质效价(Ru/mL)=(X-6)×1000/V
式中:X为抑菌圈直径,mm;牛津杯直径6 mm;V为样品加入量,μL。
1.2.3 产细菌素条件的优化
对生长的主要影响因素碳源、氮源和缓冲因子,具体为蛋白胨:牛肉膏:酵母提取物的质量比,碳氮总质量分数优化进行调节,A组为常规配方,蛋白胨:牛肉膏:酵母提取物的质量比为2:2:1和碳氮总质量分数4.5%,B 组为1:1:1,4%,C为2:1:1,和5%,D组为2:1:1和6%,设计三因素正交实验,以分离菌形成抑菌圈直径的大小比较为评估依据,以得到优化培养基。

表1 MRS培养基的成分变动表(重量g/100ml)
1.2.4 类细菌素的理化和生物学特性
以金黄色葡萄球菌为指示菌,按参考文献[7]中的方法测试分离株发酵液的pH值敏感性、热敏感性、蛋白酶敏感性。温度试验处理:分别在60℃、80℃、100℃加热15 min。pH值试验处理:发酵液调pH 至3.0,4.0,5.0,6.0,7.0,8.0。蛋白酶试验处理:加入胰蛋白酶、胃蛋白酶、酸性蛋白酶,在30℃温育2 h之后,将pH值调至6.0;对照为未经处理的发酵液。30℃温育反应,牛津杯法进行抑菌试验。
2 结果
2.1 菌株分离、鉴定
经分离纯化得到3株菌球菌,6株杆菌革兰氏阳性细菌。通过纸层析试验,细菌发酵液与标准乳酸具有相近的Rf值0.72,可初步确定这9株细菌为乳酸菌。
结合细菌形态学及接触酶试验特性,对9分离菌株进行18种碳水化合物发酵利用特性研究,参考《伯杰氏鉴定细菌学手册》[8]第8版及《乳酸细菌分类鉴定及实验方法》[9],认为9株细菌是戊糖片球菌、木糖葡萄球菌(Staphylococcus aureus)、模仿葡萄球菌(Staphylococci)、丙酸杆菌、异常芽孢杆菌(Abnormal Bacillus)、戊糖乳杆菌、植物乳酸菌、地衣芽孢杆菌(Bacillus licheniformis)、微小乳杆菌(Lactobacillus minor)。9株细菌生化特性结果见表2。
2.2 产类细菌素菌株的筛选
通过纸片法预测分离株发酵清液对指示菌的抑菌效果,对金黄色葡萄球菌、大肠杆菌均表现出较好的抑制作用是戊糖乳杆菌、植物乳酸菌、戊糖片球菌、丙酸杆菌。分离株的抑制作用,可能是代谢物细菌素,也可能是H2O2、乳酸、乙酸等有机酸的存在,经处理排除H2O2、乳酸的影响,将发酵上清液中和至pH值为6.0后,4株发酵液抑菌对金黄色葡萄球菌仍具有较强的抑菌活性,而乳酸抑菌作用不明显,说明发酵液中除产生有机酸等抑菌物质外,还产生其他抑菌活性物质;经过氧化氢酶处理的发酵滤液的抑菌活性只有细微的变化,说明发酵液的抑菌效果并不是H2O2产生的。4株发酵液抑菌对大肠杆菌的抑菌活性较弱。

表2 9株细菌生化特性

表3 不同处理发酵液对金黄色葡萄球菌作用试验结果(直径单位,mm)
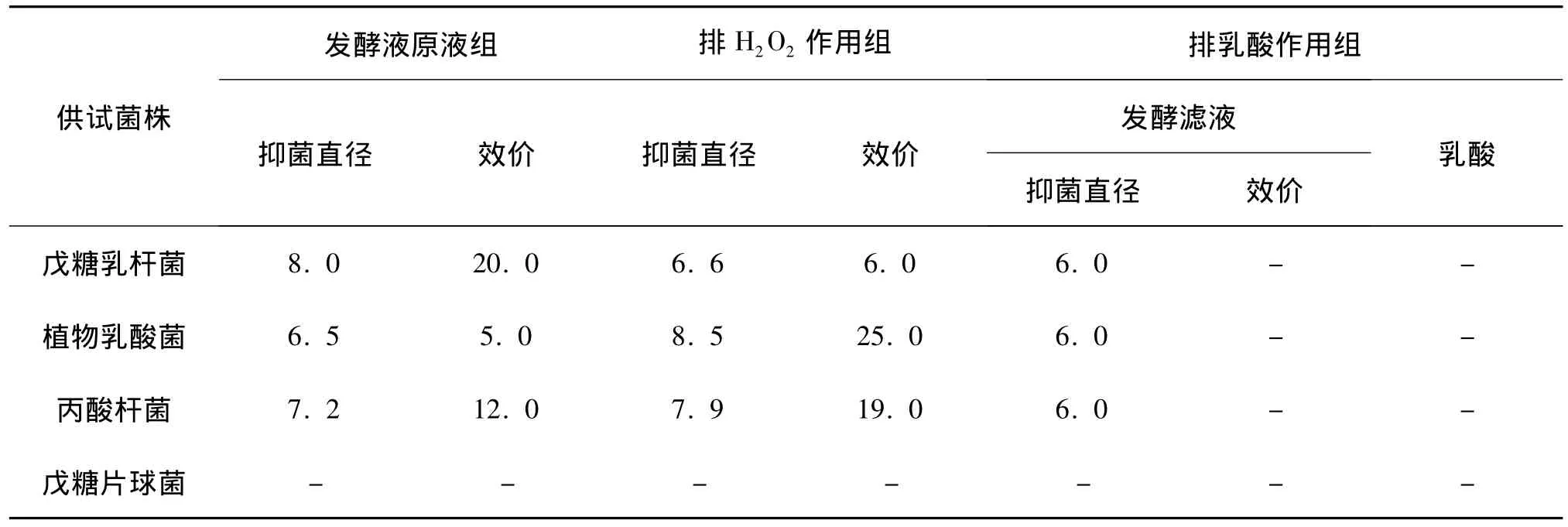
表4 不同处理发酵液对大肠杆菌作用试验结果(直径单位,mm)
2.3 产类细菌素条件的优化
经过对分离株戊糖乳杆菌培养条件优化后,在30℃(pH值为6.0)条件下,选择C组碳氮质量分数为5%、碳氮质量比为3:2,MgSO4的添加量为0.07 g/100 ml,MnSO4的添加量为0.05 g/100 ml,0.2 ml/100 mlTween-80最有利于细菌素的产生,抑菌直径可达18.2 mm,对金黄色葡萄球菌的作用效果是A组的1.2倍,D组高浓度的碳源、氮源、金属离子对细菌素的活性物质的产生有一定的降低作用。

表5 不同配比MRS培养基对戊糖乳杆菌细菌素产量的影响(直径单位,mm)
2.4 类细菌素的理化和生物学特性
经不同温度、pH处理后,发酵上清液的在高温时仍有较强的抑菌能力,在pH为2.0~8.0的环境中对指示菌均有抑制作用,在 pH 3.0,4.0,5.0时较 pH 2.0,pH,6.0,pH7.0 时抑菌直径大。发酵上清液被胰蛋白酶、胃蛋白酶作用后,对金黄色葡萄球菌和沙门氏菌的抑制作用消失,说明该抑菌物质可能是蛋白质类物质。
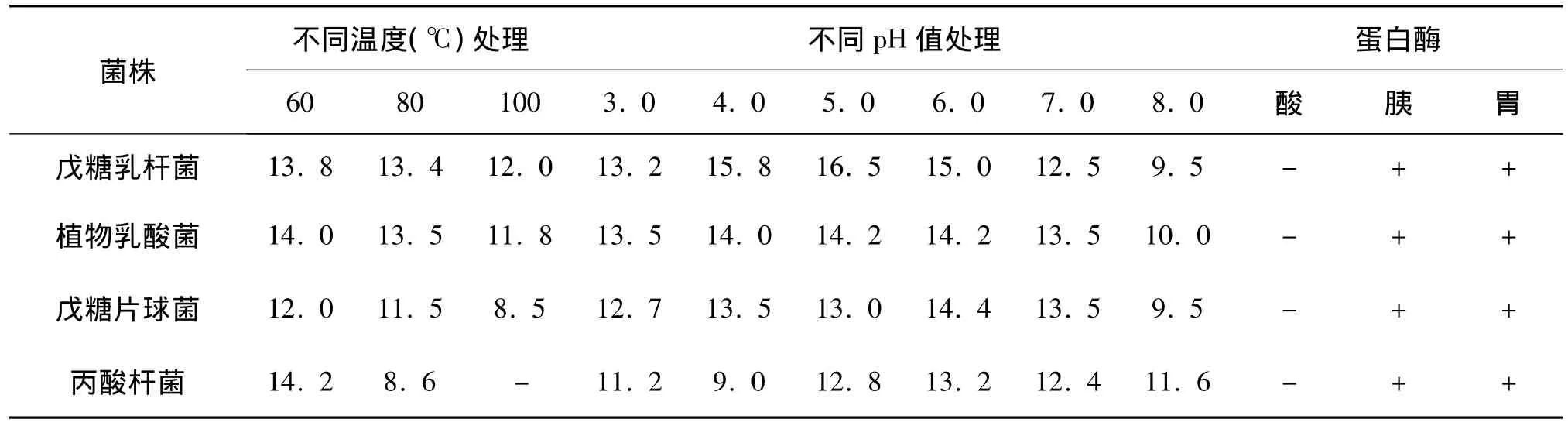
表6 不同温度、pH处理后的对金黄色葡萄球菌作用效果(直径单位,mm)
3 讨论
从不同生境中通过纸片法、牛津杯扩散法筛选出4株可产生抑菌活性的乳酸菌,将发酵上清液在中和到pH7.0,用过氧化氢酶,胰蛋白酶、胃蛋白酶,高温处理仍保持活性表明其本质是蛋白质,但未做蛋白质的纯化,故暂称为类细菌素。80℃和100℃处理15 min后不能使其失活表明该物质有耐热的特性。发酵上清液在pH3.0~8.0范围内均有抑菌活性,在pH3.0~5.0范围内稳定性较好,抑菌物质对温度不敏感,经过蛋白酶的处理后抑菌活性有所降低。通常认为细菌素的抗菌谱通常较窄[10],对革兰氏阳性菌有较强的抑制作用,而对革兰氏阴性菌、酵母和霉没有作用,而本实验获得的分离株抗菌物质对革兰氏阴性细菌也具有一定抗菌活性,表明具有较宽的抑制谱,因而具有潜在的应用前景。
细菌素的产生与生长相联系,有的细菌素在细胞刚开始生长时即有产生,而有的细菌素则在对数生长后期或稳定期才会产生[11]。培养基中碳氮比例对微生物生长繁殖和产物合成的影响极为显著,氮源过多则会使菌体生长过于旺盛,容易引起菌体的衰老和自溶;碳源过多则容易形成较低的pH值,不利于菌体生长。Tween-80作为为一种乳化剂,可以降低菌体细胞与培养基接触面之间的表面张力,从而改善细胞膜的通透性,减弱细胞对细菌素的吸附作用,使细菌素更多的释放到培养基中,从而使细菌素产量增加。本次实验通过对培养基成分调整以优化产类细菌素的条件,实验结果表明碳氮质量分数为 5%、碳氮质量比为 3:2,适量的 MgSO4,MnSO4,0.2 ml/100 mlTween-80对细菌素的产生都有一定的促进作用。
[1]庞会利,谈重芳,蔡义民,等.乳酸菌分类鉴定方法的研究进展[J].中国酿造,2009,207(6):1 -6.
[2]陈静,张玉苍,何连芳.乳酸菌产细菌素的研究进展及其应用前景[J].安徽农业科学,2011,39(4):1925-1927.
[3]杨梅,陈霞,孙志宏.乳酸菌抗生素抗性的研究进展[J].中国乳品工业,2009,37(12):46 -49.
[4]刘晓蓉,邓毛程,连晓蔚.腌肉中乳酸菌的分离选育[J].中国酿造,2009,202(1):46 -48.
[5]刘晓蓉,范瑞,朱美娟.产类细菌素乳酸菌筛选及类细菌素的特性[J].中国乳品工业,2009,37(6):8-11.
[6]王蔚淼.青贮饲料中乳酸菌的鉴定及生物学特性的研究[J].万方数据库.安徽农业大学硕士学位论文,2006.
[7]张子健,刘玉恩,赵谦,等.植物乳杆菌c8—1产类细菌素的初步研究[J].中国乳品工业,2010,38(1):15-18.
[8]R.E.布坎南.伯杰细菌鉴定手册(第八版)[M].科学出版社,1984:729-828.
[9]凌代文,东秀珠.乳酸细菌分类鉴定及实验方法[M]北京:中国轻工出版社,1999:5-13.
[10]周志江,韩烨,韩雪,等.从酸白菜中分离出一株产细菌素的乳酸片球菌[J].食品科学,2006,27(4):89-91.
[11]吕燕妮,李平兰.戊糖乳杆菌31-1菌株产细菌素发酵条件优化[J].微生物学通报,2005,32(3):13-16.
