基于激光共聚焦显微镜图像的黑色素瘤计算机辅助诊断算法研究
2013-12-10WANGTing
王 婷 WANG Ting
后桂荣2 HOU Guirong
张 宁1 ZHANG Ning
余学飞1 YU Xuefei
2.南方医院皮肤科 广东广州 510515
恶性黑色素瘤又称黑色素瘤,是一种恶性程度较高、临床预后较差的恶性皮肤肿瘤,多发生于皮肤,也见于黏膜和内脏器官。恶性黑色素瘤通常由黑色素痣恶变而来,84%来自良性痣[1]。因此,良性痣与黑色素瘤的正确识别,对于黑色素瘤的早期诊断、治疗尤为重要,早期诊断和治疗能有效提高恶性黑色素瘤的治愈率。目前,临床上常用的恶性黑色素瘤诊断方法是通过活体组织检查,依据“ABCD”准则,即形状不对称(asymmetry)、边缘不规则(irregular)、颜色不均匀(nonuniform)、瘤体直径(diameter)通常大于6 mm。这种方法虽然简单快捷,但诊断准确率低、误诊率高,而且需取活体组织进行检查,给患者增加痛苦[2]。随着计算机影像技术的发展,临床医师在计算机辅助诊断系统的帮助下,可诊断早期皮肤肿瘤,并提高诊断准确率。已有的辅助诊断算法根据组织决策分析方法来实现医学图像的自动分析,主要基于共生矩阵的图像纹理特征进行分类判别,但该方法计算复杂度高,正确识别率低[3-5]。
激光共聚焦扫描显微镜(CLSM)又称“皮肤CT”,是一种无创、安全可靠、早期诊断黑色素瘤的新成像工具,目前临床医师主要根据CLSM图像视觉特征和临床经验进行肉眼识别诊断良恶性黑色素瘤,但误诊率高。本研究基于CLSM图像,选取小波变换的图像纹理特征,研究在体恶性黑色素瘤的计算机辅助诊断算法,以协助临床医师实现早期诊断,为进一步治疗和预后提供保障。
1 资料与方法
1.1 研究对象 收集南方医院皮肤科40幅常见良性痣与40幅恶性黑色素瘤图像,所以患者均经病理切片检查证实。
1.2 仪器与方法 采用美国Lucid VivaScope1500 CLSM,光源为830 nm激光束,输出功率为1.0~4.5 MJ/cm2,扫描深度为120 μm以内的表皮层及真皮浅层组织。CLSM图像基于细胞器和组织自身结构的折射率不同而实现高分辨率。最终所得图像为灰度图像,其分辨率为1000×1000像素,每像素8位,图像以BMP格式存储。视野(FOV)0.5 mm×0.5 mm,可以对表皮和真皮组织的细胞级结构进行成像(图1)。
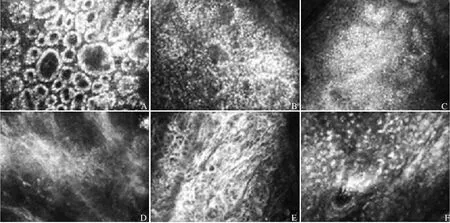
图1 激光共聚焦扫描显微镜皮肤图像。A~C. 常见良性痣图像示明显的建筑结构,如基底结构周的痣细胞群和肿瘤细胞巢;D~F. 黑色素瘤图像示黑色素细胞和结缔组织,无或少有建筑结构。
1.3 算法研究 由皮肤组织的CLSM图像可知,皮肤组织结构,如细胞、血管和其他包裹体等呈现出各种形状。为了避免图像分析过程中一般方法对图像进行自动分割,本文将尺寸归一化后的图像均匀分割成相等大小的正方形单元,然后对单一的单元分别进行分析。
1.3.1 小波变换理论 小波变换是强有力的时频分析处理工具,是在克服傅里叶变换缺点的基础上发展而来的。它的一个重要性质是能在时域和频域均具有很好的局部化特征,能够提供目标信号各频率子段的频率信息。这种信息对于信号分类是非常有用的。
图像的小波变换过程是将图像信号分解成不同尺度、不同频率带、不同方向的子图像信号,从而由粗到细地对图像进行分析。图像的小波变换得到的是一系列小波系数,离散小波变换可通过矩阵操作(WT)来实现,公式为:C=WT(B),B为图像矩阵,C为小波系数矩阵,其中图像 B=f(x,y);x,y=0,…,L-1。C=c(k,l);k,l=0,…,L-1;x,y,k,l为图像像素坐标,L为图像像素尺寸[6]。本文小波基选取为db4,小波分解尺度S=5,因此,每一个正方形单元图像可分解3S+1个子频率带(图2)。图像分解即为图像的小波变换过程,通过小波变换,将图像分解成16个频率带,依次从低频到高频标为0~15。图像的主要信息内容包含在低频系数,而高频系数主要反映图像边缘、细节变换。前4个频率带(0~3)取均值作为低频带,其余为高频带,共可得到13个频率带。

图2 图像分解
1.3.2 基于小波变换的纹理特征提取 基于小波变换的图像纹理分析方法是基于各个频率带的小波系数[7]。图像通过小波变换得到一系列小波系数矩阵,纹理分析方法的核心就是这些小波系数的特征提取,主要特征包括每个子带小波系数的标准差FSTD(i)、能量FE(i)和熵值FENT(i)。公式如下:

不同频率带的特征反映出图像在不同尺度的组织结构和细胞结构。对每一单元,小波分解后得到16个频率带,由于前4个频率带特征参数取均值作为一个频率带,因此只需计算13个频率带,而每个频率带包含标准差、能量、熵值 3个特征参数,共可得到39个特征值。特征提取完成后,利用该特征向量来代表每个正方形单元,表示方法如下:
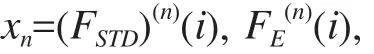

其中,i为第i频率带,n为第n个正方形单元,N为研究集正方形单元的总数,这些特征向量用于下一步分析。
1.3.3 分类 分类是由分类和回归树(CART)算法来实现的。CART是一种具有纵向分析特征的树型结构,其分析结果的过程与临床思维十分相似,因而容易被临床医师理解和接受。CART分析方法分样本数据为训练样本和测试样本,通过两步实现:种树(growing tree)和剪枝(pruning and shrinking)。
CART通过创建简单的二叉树结构来对数据进行分类,算法的输入为特征向量集,如:

CART分类算法过程:①创建初始的根节点,它包含所有的训练样本。②特征向量xn中的每个特征属性,用它构成问题对根结点进行提问测试,按照问题回答将根结点的样本集分裂为左、右2个子集,这样就能为当前根结点生成2个子结点。比如:
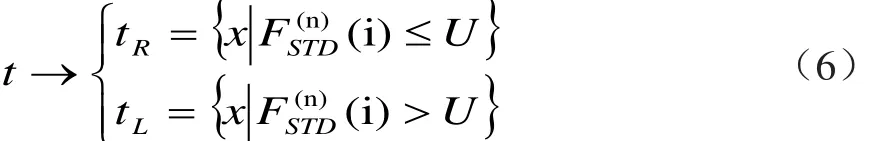
t为根节点,U为阈值。③选择最优的提问将根结点分裂成2个子结点。对每个属性划分,计算其Gini系数,Gini metric用来评估以最优的分裂方式进行结点分裂[8]。④对每个子结点重复上述步骤,从而得到一棵最大的决策树。然后对其进行剪枝,找出分类错误最小的子树作为最终的分类模型。最终叶子结点的类别即作为测试样本的CART预测结果。
本文算法总流程如图3所示。

图3 算法主要流程
2 结果
为了方便分析,将所有图像大小归一化为512×512像素,并进行分块分析(分块大小依具体而定)。图像的每个单元经过小波变换提取其13个频率带的标准差、能量、熵值等特征参数。不同频率带的特征反映出图像在不同尺度的组织结构和细胞结构,在不同频率带内,对良性痣与恶性黑色素瘤局部纹理进行小波变换后所得到分解系数的标准差和能量存在显著差异,图4为两类图像不同尺度的标准差值对比结果,分块大小为128×128像素。结果显示,对良性痣与恶性黑色素瘤局部纹理进行小波变换后所得到的分解系数标准差存在显著差异,在多数中、低频率带中良性痣的值比恶性黑色素瘤偏高。

图4 恶性黑色素瘤与良性痣图像标准差参数对比。A、B分别为良性痣及恶性黑色素瘤图像
所有图像进行分类时,为了减少计算量,分块大小选取256×256像素,每幅图像可分成4个正方形单元,最终将所有单元的特征值作为样本数据进行CART分类。本文共采集80例图像,首先将所有图像作为整个研究集,CART分析采用10倍交叉验证方法进行分类识别。同时,南方医院皮肤科多位临床医师依据相同数据样本图像,利用已有知识与经验来识别与区分良性痣与恶性黑色素瘤,最后结果取各位医师诊断正确率的平均值。然后将整个研究集随机选取40例图像(20例良性痣与20例恶性黑色素瘤)进行训练,另外40例进行测试。
本文在已有方法上选取不同特征参数进行分类(表1)。当进行总样本数据分析时,分别选取标准差为分类指标,标准差、能量为分类指标,标准差、能量、熵值作为指标进行3次试验。结果显示,前2次试验在恶性黑色素瘤和良性痣图像中正确分类率分别为97.50%、88.75%,95.00%、91.25%(正确分类率即分类器的正确率,指分类器正确分类的项目占所有被分类项目的比率)。当输入为所有特征参数分类时正确率最高,在恶性黑色素瘤图像中正确分类率为95.00%,在良性痣中达92.50%,平均正确率为93.75%。与之相比,临床CLSM图像肉眼识别方法对恶性黑色素瘤和良性痣的正确分类率只能达到90%、86%,平均正确率为88%[9,10]。该算法分类结果明显优于肉眼识别,提高了诊断准确率。当图像集被均分为训练集和测试集时,CART分析在训练集中能正确分类96.25%的黑色素瘤图像和93.75%的良性痣图像,平均正确率为95.00%;在测试集中,正确分类率分别为91.25%、87.50%,平均正确率也可达到89.38%。

表1 已有算法与本文算法比较
3 讨论
CLSM是一种用于恶性黑色素瘤早期发现与诊断的理想辅助成像工具。临床医师利用激光共聚焦扫描显微镜通过肉眼来识别恶性黑色素瘤不仅需要接受一定的训练,而且需要观察者具备必要的专业知识和临床诊断经验。由于个体差异以及医师对影像信息观察掌握的局限性,有时不免会产生判断失误或错误。
计算机辅助医学诊断是通过计算机模拟专家思维和推理过程,结合计算机的分析计算,辅助医师发现病灶,提高诊断准确率[11,12]。本文基于CLSM图像,在Matlab开发环境上,提取经典小波变换的纹理特征,该方法简易且区分度高,从而易于图像的检测识别。本文算法提高了临床恶性黑色素瘤的诊断准确率,降低了良性痣的误诊率;与病理“金标准”相比,也具有较好的一致性,并且弥补了传统的病理切片的缺点。因此,对黑色素瘤的诊断和鉴别诊断具有重要意义。
[1] 李泓馨, 张选棉, 高天文. “皮肤CT”——皮肤病诊断的新手段. 中国皮肤性病学杂志, 2007, 21(7): 432-434.
[2] 钟连生, 金鑫, 权晟, 等. 皮肤三维CT在寻常性银屑病诊断中的应用. 中国皮肤性病学杂志, 2011, 25(8): 607-608.
[3] Gareau D, Hennessy R, Wan E, et al. Automated detection of malignant features in confocal microscopy on superficial spreading melanoma versus nevi. J Biomed Opt, 2010, 15(6):061713.
[4] Wiltgen M, Gerger A, Smolle J. Tissue counter analysis of benign common nevi and malignant melanoma. Int J Med Inform, 2003, 69(1): 17-28.
[5] Zhang H, Zhang XB. Texture feature extraction based on wavelet transform. International Conference on Computer Application and System Modeling, 2010, 14(10): 146-149.
[6] Gerger A, Smolle J. Diagnostic imaging of melanocytic skin tumors. J Cutan Pathol, 2003, 30(4): 247-252.
[7] Wiltgen M, Gerger A, Wagner C, et al. Evaluation of texture features in spatial and frequency domain for automatic discrimination of histologic tissue. Anal Quant Cytol Histol, 2007,29(4): 251-263.
[8] 钱揖丽, 荀恩东. 基于分类回归树CART的汉语韵律短语边界识别. 计算机工程与应用, 2008, 44(6): 169-171.
[9] Gerger A, Koller S, Kern T, et al. Diagnostic applicability of in vivo confocal laser scanning microscopy in melanocytic skin tumors. J Invest Dermatol, 2005, 124(3): 493-498.
[10] Gerger A, Hofmann-Wellenhof R, Samonigg H, et al. In vivo confocal laser scanning microscopy in the diagnosis of melanocytic skin tumours. Br J Dermatol, 2009, 160(3): 475-481.
[11] 刘春, 杨韬, 王娟, 等. 计算机辅助诊断技术中图像纹理研究的主要方法及其应用. 中国组织工程研究与临床康复,2009, 13(39): 7721-7727.
[12] Erkol B, Moss RH, Stanley RJ, et al. Automatic lesion boundary detection in dermoscopy images using gradient vector fl ow snakes. Skin Res Technol, 2005, 11(1): 17-26.
