定量超声成像评价骨性关节炎软骨成分含量与超声参数值的相关性
2013-12-10杨依依YANGYiyi
杨依依 YANG Yiyi
王 青1 WANG Qing
黄庆华2 HUANG Qinghua
张文静1 ZHANG Wenjing
冯前进1 FENG Qianjin
陈武凡1 CHEN Wufan
2. 华南理工大学电子与信息学院 广东广州510640
关节软骨是一种表面光滑、富有弹性的结缔组织,可减少运动过程中骨面之间的摩擦,能够最大限度地吸收、缓冲应力作用[1]。然而关节软骨损伤或退化后,其功能降低,导致骨性关节炎发生或进行性加重。软骨基质成分的分解和结构的破坏是骨性关节炎的早期病理特征[2]。骨性关节炎的临床诊断方法各有优缺点,在骨性关节炎软骨成像中均有局限性[3]。定量超声成像(QUI)是定量研究软骨的成熟度、软骨形态、软骨组织修复的一种方法[3-5]。使用QUI可以定量评估软骨表面的粗糙度、胶原蛋白网络的完整性、软骨厚度、组织的反射系数(RC)及衰减系数等,从而判定软骨的退化程度[3]。因此,本研究采用定量超声成像QUI测量退化软骨样本的超声参数,并分析其与蛋白多糖和胶原蛋白含量的相关性,以探讨QUI在评估骨性关节炎软骨中的应用价值。
1 材料与方法
1.1 实验材料 选取21块新鲜成年猪的髌骨,关节软骨表面光滑无破损,髌骨的外侧部分为超声扫描部位。将髌骨样本放入-20℃冰箱保存待用。实验前,将样本置于磷酸缓冲溶液(PBS)中解冻2 h(室温保持25℃)。将21块猪髌骨软骨样本随机平均分为3组:①正常组:作为参考样本,不做任何处理;②胰蛋白酶消化组(Trypsin组):在0.25%胰蛋白酶-EDTA消化液中浸泡4 h,消化降解软骨组织内的蛋白多糖;③胶原蛋白酶消化组(Collagenase组):在30 U/ml胶原蛋白酶溶液中浸泡24 h,破坏软骨组织内的胶原蛋白。这样就建立了经酶退化的软骨离体退化模型以模拟自然骨性关节炎软骨的退化。消化过程在37℃恒温箱内进行。消化完成后,使用pH=7.4的PBS冲洗软骨样本3次后,进行超声扫描测量。
1.2 仪器与方法 采用开放式综合QUI系统(Sonix RP,Ultrasonix, Canada),系统具备一个中心频率为10 MHz的线阵超声探头,-6 dB带宽为5~14 MHz,可进行实时线阵扫描。系统内配置采样频率为40 MHz的10位模/数转换卡,以45帧/s的采样速度获取二维超声图像。扫描软骨样本时,先将耦合剂涂于软骨表面,把超声探头置于软骨表面上方约9.56 mm处,使超声波垂直入射软骨组织,设置系统增益以获得清晰的软骨超声图像,在之后的实验过程中,系统增益的设置始终保持一致。软骨组织产生的超声回波信号经模/数转换卡存入计算机,待信号处理和超声参数计算。软骨QUI系统见图1。

图1 软骨定量超声成像系统
1.3 感兴趣区(ROI)的确定 在超声图像上接近软骨面中央的位置手绘选定ROI,区域内包含20根超声扫描线,尽量避开软骨两侧的区域,以避免部分软骨面存在的弯曲度问题。
1.4 QUI图像信号处理和超声参数计算 使用QUI对3组软骨样本依次进行扫描后,得到软骨的超声射频信号(图2A)。为了界定软骨表面及软骨-骨界面的轮廓线,将超声回波信号进行希尔伯特(Hilbert)变换,获得其包络信号(图2B)。设置2个窗口来选定软骨表面及软骨-骨界面的回波,寻找窗内波幅最大的位置,以确定软骨表面及软骨-骨界面的位置,由20根扫描线的波幅最大的位置分别勾勒出软骨表面及软骨-骨界面的轮廓线。

图2 软骨超声射频信号和经希尔伯特变换后的包络信号。A. 超声射频信号;B.超声射频信号经希尔伯特变换后的包络信号
超声参数包括软骨的表面粗糙度系数(ultrasound roughness index, URI)、 软 骨 厚 度(thickness) 和 软骨表面的反射系数(ref l ection coeff i cient of cartilage surface, RC)。软骨厚度可由软骨表面及软骨-骨界面的轮廓线可确定软骨的厚度,计算方法:
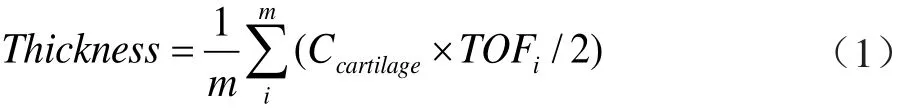
其中,TOFi为在软骨表面及软骨-骨界面之间的超声波传播时间,Ccartilage为超声在软骨组织的平均声速1675 m/s[6],m为扫描线数20。URI表示软骨表面的粗糙或平滑程度,可由软骨表面的轮廓线确定,计算方法[7]:

其中, di是沿第i条扫描线软骨表面到换能器的距离,di等于超声的传播时间除以2再乘以声速。超声在耦合剂中的传播速度为1540 m/s, 是 di(i=1,2,3…20)的平均值。因考虑到关节软骨表面的轮廓线曲度对URI计算的影响,本研究首先使用高通滤波器进行滤波,滤波后计算的URI可真实反映软骨表面的粗糙或平滑程度。RC可由软骨样本的超声回波的最大幅值与参考样本的超声回波的最大幅值的比值得到,计算方法[8]:

其中,Ai是软骨表面的超声回波的最大幅值,是 Ai(i=1,2,3…20)的平均值,是参考幅值,计算时使用不锈钢板面的超声回波反射幅值作为参考幅值,是(i=1,2,3…20)的平均值。信号的处理和超声参数的计算均采用自编的Matlab (V7.0) 程序完成。1.5 统计学方法 采用SPSS 16.0软件,运用非参数统计方法以排除因样本量小带来的“随机显著性”[9],使用Mann-Whitney U检验比较3组样本间各参数的差异,P<0.05表示差异有统计学意义。
2 结果
2.1 超声扫描结果 正常组软骨表面回波强、清晰光滑;而消化组(Trypsin组和Collagenase组)软骨表面回波减弱,表面轮廓变得不清晰光滑。见图3。2.2 超声参数结果 Trypsin组和Collagenase组RC均显著小于正常组(P<0.01),且两消化组间差异有统计学意义(P<0.05)。Trypsin组和Collagenase组URI均显著大于正常组(P<0.01),但两消化组间URI差异无统计学意义(P>0.05)。与正常组软骨厚度相比,虽然Trypsin组软骨组织无显著增厚(P>0.05),且Collagenase组亦无显著变薄(P>0.05),但两消化组软骨厚度差异有统计学意义(P<0.05)。见表1。
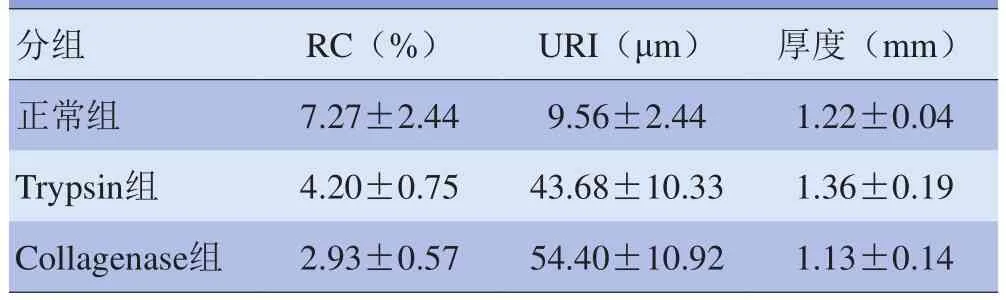
表1 3组软骨表面RC、URI及软骨厚度比较
2.3 超声参数与软骨成分的相关性 图4所示为软骨成分改变与软骨表面RC及URI改变之间的关系,结果发现,利用RC与URI可以很好地区分正常软骨与退化软骨, 并进一步区分退化软骨中的具体成分如蛋白多糖或胶原蛋白的缺失。正常组RC均高于两消化组,而URI则低于两消化组。随着Trypsin组内蛋白多糖的降解和Collagenase组内胶原蛋白的破坏,软骨表面RC逐渐减小,URI逐渐增大。

图4 3组软骨表面超声参数与软骨成分之间的关系
3 讨论
在表征退化的关节软骨组织的研究中,超声是一种有效的研究工具[3]。小动物(如兔、大鼠等)的软骨组织一般采用高频(50~55 MHz)超声成像系统得到清晰的软骨超声图像[10,11]。由于较大型动物(如猪)的软骨较厚(>1 mm),本研究采用中心频率为10 MHz的QUI系统也可以清晰地分辨软骨表面与软骨-骨界面。
本研究运用QUI测量软骨表面的超声参数发现,随着软骨中不同成分的分解,软骨表面的超声参数也随之发生改变。正常软骨和退化软骨之间存在明显差异,由于正常软骨组织表面平滑,随着蛋白多糖与胶原纤维网络的分解,软骨组织表面随之变得不平整。虽然两个消化组间URI差异无统计学意义,但与胰蛋白酶消化的软骨表面相比,胶原蛋白酶消化的软骨表面更不平整,这可能是由于胶原纤维在软骨表层占主导地位,表层的胶原纤维网络的分解是引起软骨表面URI增大的主要原因,而蛋白多糖成分在软骨表层含量较少,但胰蛋白酶除消化软骨蛋白多糖外,对部分胶原蛋白也有影响[7]。
关节软骨成分的改变不仅引起表面粗糙不平,而且引起软骨组织表面的RC显著减小,其主要原因可能有两个:一是由于软骨表面粗糙程度增大,造成超声信号的漫反射,导致界面回波幅度减小;二是由于软骨内成分和结构发生变化,尤其是胶原蛋白的分解,使得更多的超声能量被透射吸收,也会造成软骨表面RC减小。早期研究发现,随着关节炎等级的升高,软骨组织表面的RC逐渐减小[11],与本研究结果相似。因此,酶消化方法与前十字韧带切除术引入关节炎的方法对软骨表面有相似的影响。这两种方法均为目前普遍采用的骨性关节炎动物造模实验方法,并且这种酶消化模型特别适合软骨退变过程中软骨成分改变的研究。
软骨表面的超声参数(URI 和RC)是描述软骨退化的重要指标,本研究结果表明,运用QUI测量这两个参数可很好地区分正常软骨与退化软骨,可以评估退化软骨中的具体成分(蛋白多糖或胶原蛋白)的缺失情况。另外,本研究与其他研究结果均表明,QUI能有效发现早期关节炎软骨退化[3,5-12],并可为其提供较客观的定量超声诊断,为骨性关节炎的早期诊断提供参考。
就目前的医疗水平而言,当患者出现骨性关节炎的临床症状或影像学上表现异常时,病情已到中晚期,只能依靠手术正畸或缓解症状。既往研究表明,关节软骨的退化发生于早期骨性关节炎,并与软骨组织成分结构密切相关[1,3,7,11,12],因此,软骨退化的早期发现对于骨性关节炎的干预和治疗具有重要意义。作为一种廉价、易操作的检测方法和实验手段,许多学者应用QUI研究了退化过程中软骨成分的变化和力学性质的变化,探讨了超声声学参数变化与软骨成分变化的相关性,以及运用QUI观测软骨自由膨胀过程中内部组织的形变。这些研究大多为实验研究,但已开始尝试性地将QUI应用于临床研究,如新型小型按压式超声探头和关节腔镜式超声探头[5,8,13],可用于关节炎术中实时评价软骨的退化程度。但由于超声穿透能力和关节腔的特殊解剖结构,限制了QUI在临床研究中的非侵入性应用,目前QUI仅可用于关节开腔手术或微创侵入性关节腔手术。
[1] Mow VC, Gu WY, Chen FH. Structure and function of articular cartilage and meniscus// Mow VC, Huiskes R. Basic orthopaedic biomechanics and mechano-biology. 3rd ed.Philadelphia: Lippincott Williams & Wilkins, 2005: 181-258.
[2] Wang Q. Ultrasonic characterization of transient and inhomogeneous swelling behavior and progressive degeneration of articular cartilage. Hong Kong: Hong Kong Polytechnic University, 2007.
[3] Nieminen HJ, Zheng Y, Saarakkala S, et al. Quantitative assessment of articular cartilage using high-frequency ultrasound: research findings and diagnostic prospects. Crit Rev Biomed Eng, 2009, 37(6): 461-494.
[4] Aula AS, Töyräs J, Tiitu V, et al. Simultaneous ultrasound measurement of articular cartilage and subchondral bone.Osteoarthritis Cartilage, 2010, 18(12): 1570-1576.
[5] Laasanen MS, Töyräs J, Hirvonen J, et al. Novel mechanoacoustic technique and instrument for diagnosis of cartilage degeneration. Physiol Meas, 2002, 23(3): 491-503.
[6] Patil SG. Measurement of the sound speed in articular cartilage invitro. Hong Kong: Hong Kong Polytechnic University, 2005.
[7] Saarakkala S, Töyräs J, Hirvonen J, et al. Ultrasonic quantitation of superficial degradation of articular cartilage.Ultrasound Med Biol, 2004, 30(6): 783-792.
[8] Virén T, Saarakkala S, Tiitu V, et al. Ultrasound evaluation of mechanical injury of bovine knee articular cartilage under arthroscopic control. IEEE Trans Ultrason Ferroelectr Freq Control, 2011, 58(1): 148-155.
[9] Laasanen MS, Saarakkala S, Töyräs J, et al. Site-specific ultrasound ref l ection properties and superf i cial collagen content of bovine knee articular cartilage. Phys Med Biol, 2005,50(14): 3221-3233.
[10] Chérin E, Saïed A, Laugier P, et al. Evaluation of acoustical parameter sensitivity to age-related and osteoarthritic changes in articular cartilage using 50-MHz ultrasound. Ultrasound Med Biol, 1998, 24(3): 341-354.
[11] Niu HJ, Wang Q, Wang YX, et al. Ultrasonic reflection coefficient and surface roughness index of OA articular cartilage: relation to pathological assessment. BMC Musculoskelet Disord, 2012, 13: 34.
[12] Wang SZ, Huang YP, Saarakkala S, et al. Quantitative assessment of articular cartilage with morphologic, acoustic and mechanical properties obtained using high-frequency ultrasound. Ultrasound Med Biol, 2010, 36(3): 512-527.
[13] Hattori K, Takakura Y, Ishimura M, et al. Differential acoustic properties of early cartilage lesions in living human knee and ankle joints. Arthritis Rheum, 2005, 52(10): 3125-3131.
