濒危海草贝克喜盐草的种群动态及土壤种子库
——以广西珍珠湾为例
2013-12-09邱广龙范航清李宗善刘国华石雅君
邱广龙,范航清,李宗善,刘国华,*,石雅君,李 森
(1. 中国科学院生态环境研究中心 城市与区域生态国家重点实验室, 北京 100085;2. 广西科学院 广西红树林研究中心, 北海 536000; 3. 中国科学院烟台海岸带研究所, 烟台 264003)
濒危海草贝克喜盐草的种群动态及土壤种子库
——以广西珍珠湾为例
邱广龙1,2,范航清2,李宗善1,刘国华1,*,石雅君3,李 森2
(1. 中国科学院生态环境研究中心 城市与区域生态国家重点实验室, 北京 100085;2. 广西科学院 广西红树林研究中心, 北海 536000; 3. 中国科学院烟台海岸带研究所, 烟台 264003)
于2012年4月—2013年4月调查了广西珍珠湾地区贝克喜盐草(HalophilabeccariiAscherson)种群的基本属性及土壤种子库储量。结果表明,不同月份间该种群的面积、覆盖率、直立茎密度、生物量、繁殖器官密度等属性差异明显,均呈现先增大后减小再增大的趋势;各个属性出现峰值的日期有所不同,面积、覆盖度、地下生物量和总生物量的最高峰值出现在10月底,而直立茎密度和地上生物量峰值最高峰值出现在8月初。贝克喜盐草珍珠湾种群有明显雌蕊先熟现象,雌花发育高峰期(8月初,5404 朵/m2)早于雄花发育高峰期(8月底,2189 朵/m2)。而果实高峰期(4125 个/m2)为10月份。地上与地下生物量之比值(1.95—0.53)随种群的发育而逐渐减小,基于此比值可判断贝克喜盐草种群所处的发育阶段。在生长高峰期,贝克喜盐草种群有较大的分布面积(21.4 hm2)、较高的覆盖度(55%)、直立茎密度(21602 茎/m2)及生物量(70.583 g/m2干重)。贝克喜盐草果实含种子为1—4粒(平均为2.22粒);1月、3月和4月土壤种子库密度分别为5749、5652、2728 粒/m2,3—4月期间土壤种子库种子损失率高达104 粒 m-2d-1。尽管贝克喜盐草有较高的种子产量(10月份,9158 粒/m2)和较快的生长速度,但由于土壤种子库中种子损失严重且种子萌发率较低以及人为干扰对其生境的强烈干扰等因素,因此可能会对次年的种群更新产生较大的负面影响。
濒危海草; 物候; 贝克喜盐草; 土壤种子库; 种群发育
贝克喜盐草(HalophilabeccariiAscherson)是水鳖科喜盐草属的海草植物,为海草植物里最古老的两个世系之一,有“活恐龙”之称[1]。它生长于人为干扰压力日益增大的潮间带[2],通常为平均海面0.9—1.5 m深狭窄区域的泥质或泥沙质生境[1,3]。该植物个体纤细,是形态最小的海草之一,但生长迅速,具有1年生和多年生两种生活形[1]。据国际自然保护联盟(the International Union for Conservation of Nature,IUCN)的评估,全球贝克喜盐草分布面积不超过2000 km2,主要分布于马来西亚、泰国、新加坡、孟加拉、印度、中国、缅甸、菲律宾等亚州国家[1]。鉴于贝克喜盐草有限的分布面积以及全球日趋衰退的现状,IUCN将其列为全球范围内的易危(VL)种[1],是当前全球面临灭绝风险的10种海草之一[2]。在新加坡,贝克喜盐草也被列为“极度濒危(Critically Endangered)”等级的红色物种[4]。在我国,贝克喜盐草仅分布于西沙群岛、海南、广西、广东和台湾等地区[5],对现有资料[5- 7]进行汇总分析估算,全国贝克喜盐草分布面积已不足200 hm2,同样面临濒危风险。然而,由于缺乏相关报道,该海草的保护在我国并未引起足够的重视。
种群动态主要研究分布、密度、生物量和其他结构属性在时间和空间上的变动,是种群生态学最基础最核心的问题。土壤种子库是指土壤中和土壤表层具有活力的全部种子[8],是种群更新与拓展的重要基础,也是种群动态的重要组成部分[9]。它作为潜在的植被,预示着种群的自我恢复能力,在连接过去、现在和将来的植物种群结构与动态中起着重要的生态作用[10]。基于其重要生态学意义,土壤种子库研究正日益受到重视。但与陆生植物土壤种子库研究相比,关于海草土壤种子库的研究仍处于起步阶段[11]。迄今为止,现有海草种群动态与种子库大部分集中在欧美国家少量的海草种类[12- 16],全球海草关于贝克喜盐草的研究报道非常稀少,现有的几篇专门报道均来自热带地区[3,17- 20],主要报道了贝克喜盐草的繁殖物候观察。对于亚热带地区贝克喜盐草的种群动态研究未见报道。我国对海草土壤种子库研究目前还是空白,对贝克喜盐草的报道也仅限于物种分布信息[6,21- 23]。我国在贝克喜盐草方面大量基础信息的缺乏严重地影响了对这一物种的濒危机制的认识,严重阻碍了对这一濒危物种的保护与管理工作的开展。而研究贝克喜盐草的种群动态和土壤种子库,是揭示种群建立与发展过程的基础,对于其濒危机制的探讨和资源保育的研究,种群自我恢复潜在能力的评估,以及其保护对策的制定等都具有现实的理论意义。
1 研究地点与方法
1.1 研究地点
本项研究地点位于广西防城港市珍珠湾北部(图1b),广西北仑河口国家级自然保护区范围内。珍珠湾地处广西西部,东与防城港毗邻(图1a)。整个海湾呈漏斗状,面积94.2 km2。该海湾年平均气温22.5 ℃,最热为7月份;降水量多年平均为2220.5 mm,但主要集中在夏季(6、7、8月),为广西沿海降雨量较丰富的地区[24]。
贝克喜盐草种群位于该海湾北部的交东村外海的潮间带,近陆方向是以白骨壤(Avicenniamarina)、桐花树(Aegicerascorniculatum)、木榄(Bruguieragymnorrhiza)和秋茄(Kandeliacandel)为主的红树林群落,红树林内缘有大量的虾塘(图1c)。在海草床近海方向,贝克喜盐草与矮大叶藻(Zosterajaponica)海草混生,更深的潮区则只有矮大叶藻生长。海草床以西约1.5 km是江平河的出海口(图1b)。
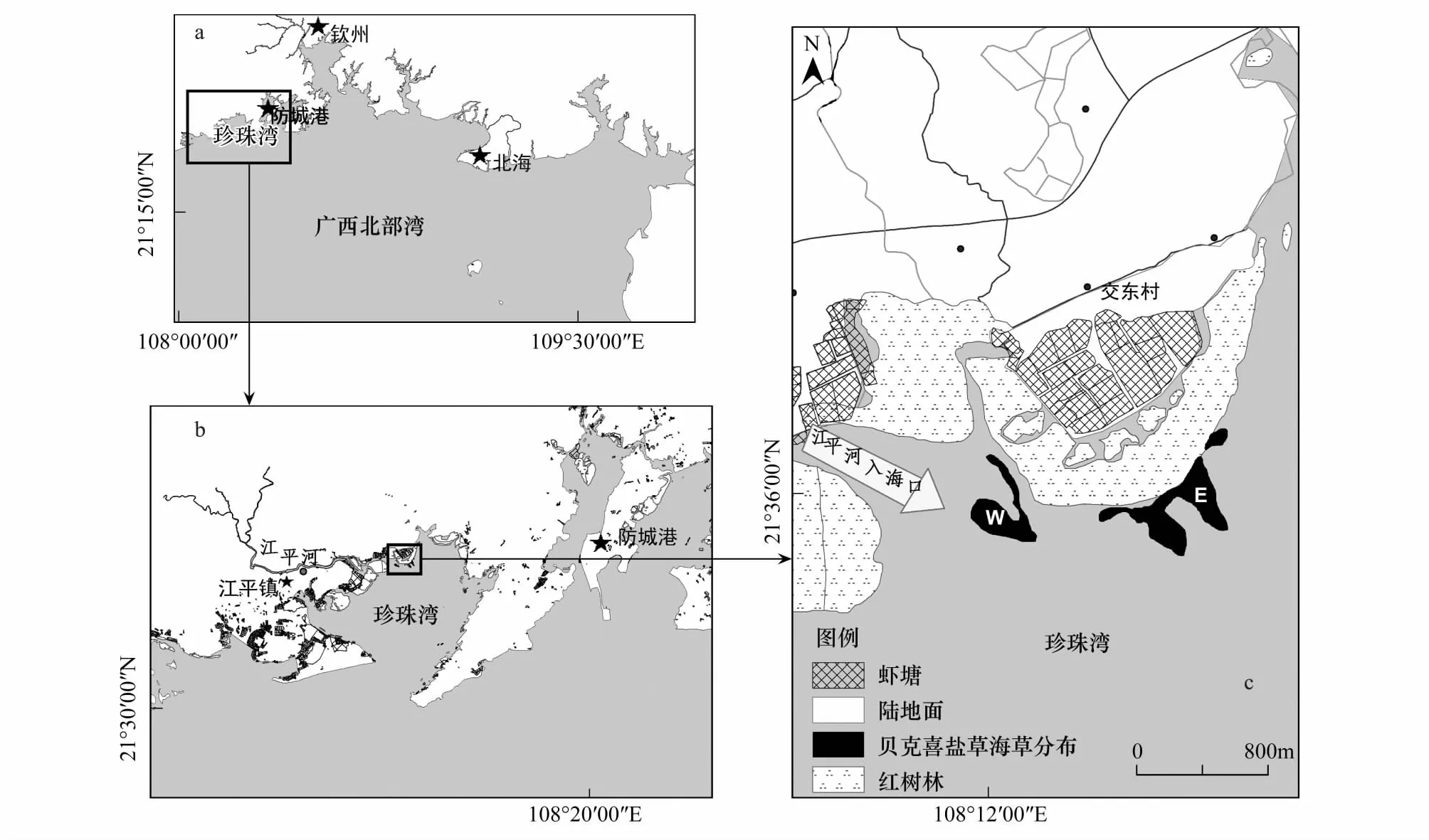
图1 广西珍珠湾贝克喜盐草种群分布图Fig.1 Distribution map for Halophila beccarii population in Pear Bay, Guangxia:珍珠湾贝克喜盐草种群在广西的位置;b:珍珠湾贝克喜盐草种群在防城港市的位置;c:珍珠湾贝克喜盐草海草分布图(2012年10月20日)
1.2 研究方法
1.2.1 调查日期与频率
于2012年4月—2013年4月期间进行了共计9次的现场调查与采样(表1)。沉积物种子库(即“土壤种子库”,由于“土壤种子库”为大家熟知并广泛接受的惯用专业词汇,下文统一称“土壤种子库”)分别在2013年1月12日、3月21日、4月18日各进行一次采样调查。

表1 不同调查时期海草床面积调查方法
1.2.2 海草床面积与覆盖度
2012年8月4日和2012年10月20日是采用手持GPS进行实地绕测(同时也进行目测估计,以算出目测海草床面积的精度),其他7次面积调查因受潮汐的制约是在蹅查采样时进行目测估算(表1)。
GPS绕测方法为:退潮时,采用手持GPS(佳明etrex20双星GPS,台湾国际航电股份有限公司,单点定位精度3—5m)围绕海草床的边界进行绕测,将绕测结果导入ArcMap 9.2后输出海草分布图,并基于该系统平台计算出海草床的面积。
海草覆盖率按SeagrassNet的方法进行估算确定[25]。
1.2.3 生物量、直立茎密度、繁殖器官数量特征以及种子库
在贝克喜盐草海草床以直径为7 cm的圆柱形采样器采集6—18个带沉积物的海草样品(采样点尽可能均匀分布于海草分布区,采样点数量依不同时期海草床面积而定,最低采集数量为6个)。以50目的标准筛筛洗后,将剩余土壤中的海草植物与海草种子挑出,统计单位面积内贝克喜盐草的直立茎数量、雄花数量、雌花数量、果实数量以及土壤种子库的种子数量。此外,将海草样品用纯净水冲洗干净后分为地上部分(叶片、叶柄以及花果等繁殖器官)和地下部分(根状茎与根),分别烘干至恒重,用千分之一电子天平称重。
贝克喜盐草种子的鉴别与分离:由于海草床沉积物中几乎无陆地植物的种子,因此仅需要对不同的海草种子进行鉴别。广西珍珠湾目前仅分布有矮大叶藻和贝克喜盐草两种海草[6],由于矮大叶藻种子种皮光滑而贝克喜盐草种子具明显的网状纹饰[5],因此在肉眼下很容易区分两种海草的种子。
贝克喜盐草雄花与雌花的区分:贝克喜盐草雄花花梗较长(gt;8mm),则雌花几无花梗或较短(lt;4mm);雄花具3个花被片,而雌花具有2—3个丝状的柱头[5,19]。
采集约200个贝克喜盐草的成熟果实,统计每一个果实内含成熟种子的数量。
2 结果与分析
2.1 面积与覆盖度动态变化
图1展示了2012年10月20日以手持GPS绕测广西珍珠湾贝克喜盐草海草床的分布状况。
绕测结果表明,研究区贝克喜盐草海草分布于江平镇交东村红树林外沿,主要由完全独立的两个海草斑块(图1中的W与E斑块)组成。海草床在2012年4月春季调查时分布面积仅0.8 hm2(图2a),且生长稀疏、覆盖度较低(仅1%);随后海草分布面积与覆盖度都呈现逐渐增大的趋势,至秋季时(2012年10月20日),面积与覆盖度都有最大值,分别是21.4 hm2和55%(图1,图2b);在生长高峰期过后,该种群出现衰退的趋势,面积与覆盖度都逐渐减小,至次年3月,该种群的海草面积和覆盖度分别仅有约3 hm2和6%(图2c、图3a、图3b,海草床分布见图1)。次年4月,由于土壤种子库中部分种子开始萌发,新的生长季重新开始,此时海草面积和覆盖度分别恢复至约7 hm2和8%。
对比2012年8月4日和2012年10月20日两次GPS实际绕测面积的结果与目测的结果,算出目测面积的精度为63—81%,可认为目测的海草床面积仍有一定的参考价值。

图2 不同阶段(开始生长-高峰-衰败)的贝克喜盐草海草床景观图Fig.2 Landscape view for H. beccarii population in Pear Bay, Guangxi at the different stagesa:刚开始生长的稀疏贝克喜盐草,摄于2012年4月26日;b:生长密集的贝克喜盐草海草床,摄于2012年8月4日;c:已经衰败的贝克喜盐草,摄于2013年3月21日
2.2 生物量、直立茎密度与繁殖器官数量特征
2.2.1 不同阶段的贝克喜盐草生物量
研究区的贝克喜盐草种群在发育初期(4月份)地上生物量(干重)较低,仅7.333 g/m2;随着种群的生长发育,地上生物量不断增大,至8月份达到最大值42.712 g/m2;随后地上生物量逐渐减小,至翌年3月份仅5.204 g/m2,为整个生长季中最低值;翌年4月,随着部分种子开始萌发,地上生物量恢复至14.032 g/m2(图3)。
地下生物量在调查期间也是呈现先增大,后减小的变化趋势,其最大峰值39.701 g/m2出现在10月底,比地上生物量最大峰值晚近3个月;随后地下生物量逐渐减小,至翌年3月有最低值11.021 g/m2;翌年4月由于部分种子开始萌发,地下生物量增至15.886 g/m2(图3)。
从总生物量来看,该种群在发展初期(4月)总生物量较低,仅11.092 g/m2;随着种群的生长发育, 10月底达到最大值70.583 g/m2;随后生物量逐渐减小,至翌年3月生物量仅16.225 g/m2;翌年4月海草总生物恢复至29.898 g/m2(图3)。
不论是地上、地下还是总生物量,将近一年的调查期内(2012年4月至2013年3月),均呈现了一个先增加后减小的“n”字形生长模式。新的生长季从翌年即2013年4月份重新开始。
纵观不同阶段的贝克喜盐草地上与地下生物量之比值,在种群发育初期有最大值1.95;随后逐渐减小,在生长季后期(翌年2月—3月)比值仅有0.53(图3),表明贝克喜盐草在种群发育初期叶片等地上组织先于根状茎等地下组织形成,随着种群的拓殖生长,地下形成了复杂而发达的根状茎网络,但在生长季后期,地上组织(叶片与叶柄)先于地下组织(根状茎与根)开始衰老腐败。翌年4月,由于部分种子萌发生长,地上与地下生物量之比值开始增大(图3)。
2.2.2 不同阶段的贝克喜盐草直立茎密度
类似于生物量的变化趋势,不同阶段的贝克喜盐草直立茎密度在其生长季内也是呈现先增大,后减小的“n”字形变化趋势。春季(4月份)该种群直立茎密度仅4876 茎/m2;夏季(8月份)达最高峰值21602 茎/m2;随后持续减小,至翌年3月,直立茎密度锐减至6199 茎/m2。翌年4月新的生长季开始时,直立茎密度增至12914 茎/m2(图3)。
2.2.3 不同阶段贝克喜盐草的繁殖器官数量特征
9次调查期间,仅在2012年8月—10月期间发现较多的花与果实(2013年1月和4月调查仅有极少量的花)。大量出现雄花与雌花的季节为夏季(8月份,雄花与雌花密度分别为2189 朵/m2和5404 朵/m2)。至冬季(翌年1月)调查时,仅发现极少量的雄花与雌花(密度均为111 朵/m2)(图3)。果实发育期为8—10月,但大量出现果实的季节为秋季(10月份,此时果实密度达4125个/m2)(图3)。对采集的186个成熟果实进行解剖统计得知,平均每个果实含种子数量为2.22 粒,含1个、2个、3个和4个种子的果实所占的比例为1.7 %、79.7 %、13.6 %和5.1 %,可见绝大部分贝克喜盐草的果实含2个种子(图4)。
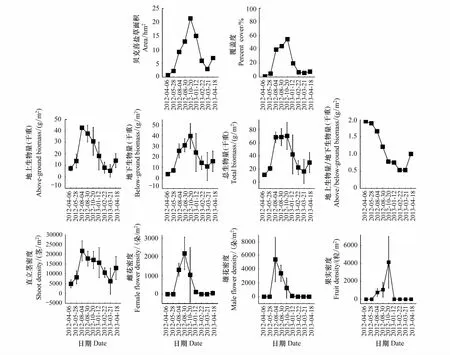
图3 广西珍珠湾贝克喜盐草种群时间动态(2012年4月—2013年4月)Fig.3 Temporal population dynamics of H. beccarii in Pearl Bay, Guangxi (April 2012— April 2013)
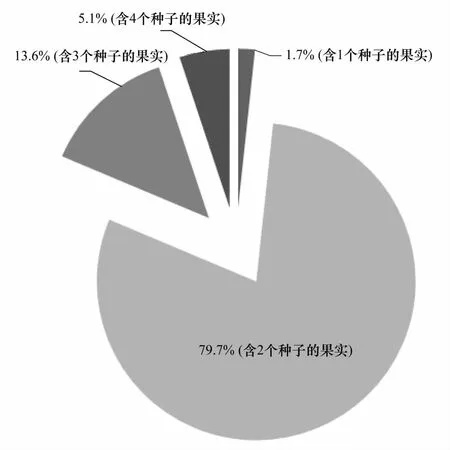
图4 含不同种子数量的果实所占之比例 Fig.4 Percentage of fruit counts for bearing different seed amounts (1—4) for H. beccarii
基于果实的产量与种子含量(2.22 粒/个),可推算贝克喜盐草10月份的种子产量约为9158 粒/m2。
2.3 贝克喜盐草的土壤种子库
从研究区分别于2013年1月12日、3月21日、4月18日采集的12个沉积物样品进行分析的结果表明,1月份该海草床土壤种子库的平均密度为5748粒/m2,但分布极不均匀,介于520 粒/m2与23126 粒/m2之间(表2)。基于1月份种子库和草场面积推算得研究区土壤种子库种子储量为1.23×109。3、4月份土壤种子库的平均密度分别为5652 粒/m2和2728 粒/m2,但种子库在整个海草床的分布也极不均匀。计算得知,从1月12日至3月21日,土壤种子库种子损失率仅为1.4 粒 m-2d-1;而从2013年3月21日—4月18日,种子损失率高达104.4 粒 m-2d-1。至4月份土壤中保留的种子仅为上一年10月份种子产量(9158 粒/m2)的29.8 %。

表2 不同采样点贝克喜盐草种子库密度(粒/m2)
3 讨论
3.1 贝克喜盐草种群的区域差异分析
与其它的贝克喜盐草种群相比,广西珍珠湾的贝克喜盐草海草床是迄今为止国内所报道面积最大,覆盖度、密度、生物量最高的种群(表3)。其生长高峰期时的密度(21602茎/m2)远高于珠海唐家湾(9523.81茎/m2)[23]以及广西钦州茅尾海的纸宝岭(9550茎/m2)[6];总生物量(70.583 g/m2)也高于广东珠海唐家湾(34.52 g/m2)[23]、广西钦州茅尾海纸宝岭(18.30 g/m2)[6]、泰国安达曼海近岸的Yaoyai岛(13.67 g/m2)[26]以及印度的多个种群(6.2—25.5 g/m2)[19];而面积(21.4 hm2)和覆盖度(55%)在报道的几地中(广东湛江东海岛和珠海唐家湾,广西钦州茅尾海的纸宝岭和北海山口丹兜那交河)也具有最高值(表3)。鉴于贝克喜盐草全球持续衰退的事实以及珍珠湾种群保护相对完好的现状,笔者认为广西珍珠湾的贝克喜盐草有较高的保护价值。
从繁殖物候来看,广西珍珠湾贝克喜盐草种群位于南亚热带,其果实发育高峰期为10月,晚于热带地区的马来半岛的吉兰丹(7月),果实密度(4125 个/m2)高于吉兰丹(3228.57个/m2)[3]。每个果实平均含种子数量为2.22 粒,高于马来西亚登嘉楼州的甘马挽种群(1.7粒)[20]。珍珠湾的贝克喜盐草种群在高峰期时雄花与雌花密度分别为2189 朵/m2和5404 朵/m2,雄花密度低于位于热带地区的马来半岛的吉兰丹(3114.29 朵/m2,1997年7月),而雌花密度则高于吉兰丹(4428.57 朵/m2,1997年6月)[3]。贝克喜盐草有全年开花[20]和只在雨季开花[3]两类种群,其开花受气温制约[20],而珍珠湾的贝克喜盐草种群大部分集中在雨季开花。2—3月份珍珠湾气温较低[24],未见有任何繁殖器官,并未像热带地区一些种群那样终年开花结果[20]。此外,珍珠湾的贝克喜盐草种群雌花发育高峰(8月4日)早于雄花发育高峰(8月30日),这一模式与马来半岛的吉兰丹[20]也很相似,很可能是贝克喜盐草为避免自交的而采取雌蕊先熟的一种机制[19]。
3.2 不同阶段贝克喜盐草种群的基本属性及其对管理上的意义
广西珍珠湾贝克喜盐草种群,在1年的调查期内,经历了一个先逐渐生长,后逐渐衰败的一个完整的生长周期,其不同阶段的海草面积、覆盖度、密度、生物量以及繁殖器官的数量差别迥异,总体上呈现了“n”字型的种群生长模式,其繁殖器官的发育大部分集中于雨季,可看出该种群采用的是1年生生长型。但种群不同的属性出现峰值的日期并不相同,例如面积、覆盖度、地下生物量和总生物量的最高峰值出现在10月底,密度和地上生物量峰值最高峰值则出现在8月初。从海草的研究与管理层面而言,当报道某一海草床的面积与覆盖度等时,应注明所调查的日期。但国内有些海草研究,在报道海草群落生态状况时并没有体现调查月份甚至缺乏具体的调查年份[27]。对于海草这种在不同月份亦有较大波动的植物而言(尤其像贝克喜草这种生长迅速的1年生生长型的海草),如能注明调查日期更有参考意义。
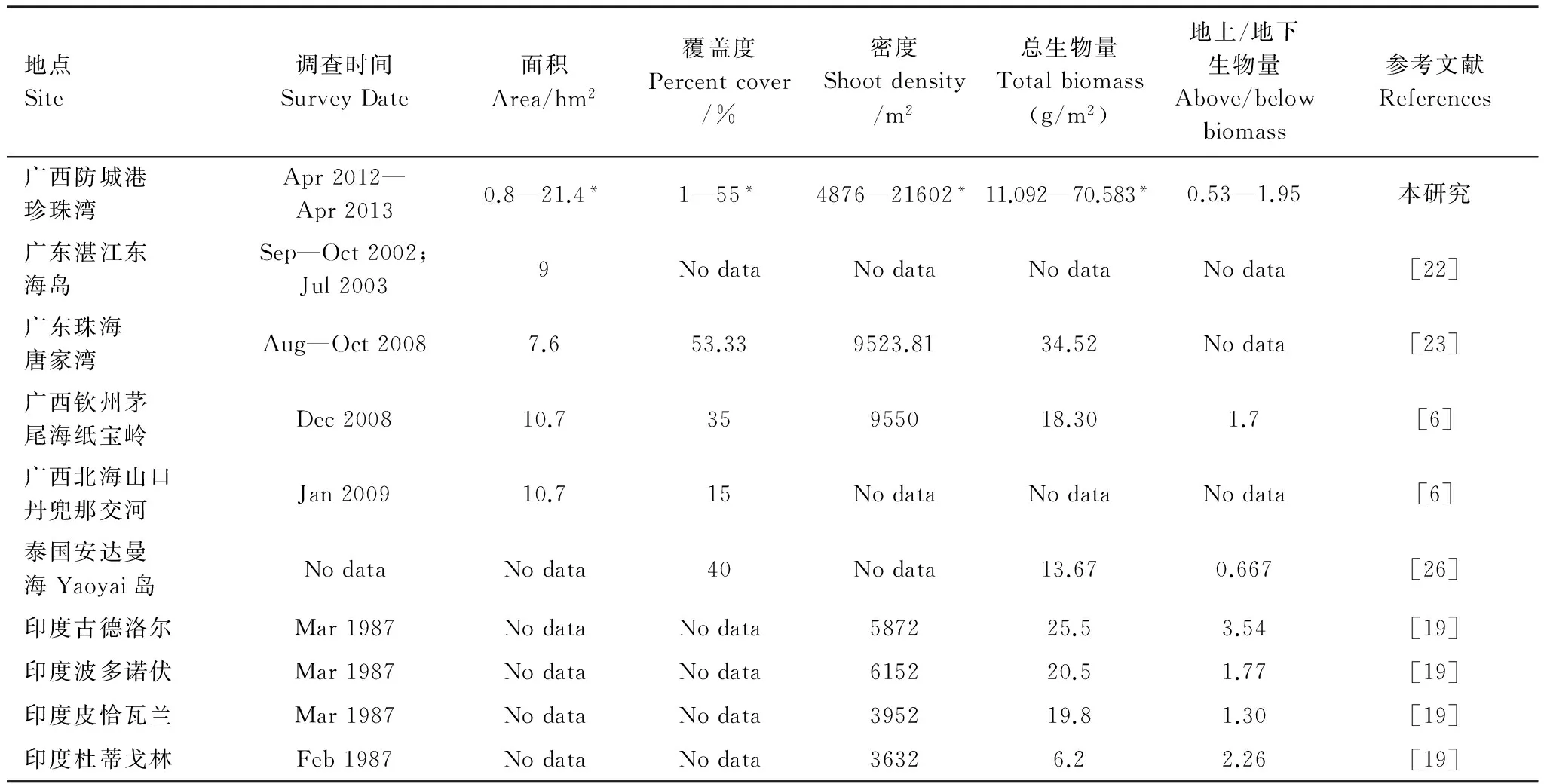
表3 广西珍珠湾贝克喜盐草种群基本特性与其它地区的比较
*由于本研究的调查值是1年中不同时期的调查值,此值为调查过程中各阶段的最小值与最大值
此外,即使在同一调查阶段,其某一种群属性(例如密度、生物量等)亦有较大的波动(图3),表明在整个海草床中,贝克喜盐草海草的种群分布并非均匀分布。种群分布格局可能与海草土壤种子库的分布格局有关,因为土壤中所储备的海草种子在空间上就极度不均匀[28],其分布格局高度聚集[29]。本研究的调查结果也表明了贝克喜盐草土壤种子库较高的空间异质性。
3.3 贝克喜盐草的土壤种子库与种群更新
本研究区于2008—2009年曾经有面积约10 hm2的贝克喜盐草覆盖[6],但于2010年已经消失(个人观察),如今又重新恢复生长,期间未见任何贝克喜盐草植被。由于喜盐草属等小型海草无性系植株周转期较短(常lt;1a)[30],叶片及匍匐根状茎很快凋萎,期间在野外对沉积物的观察亦未见任何根状茎,基于此,可推测该种群此次更新依赖于土壤的种子库,而其储存于土壤的种子可能存在休眠现象。Mcmillan曾报道喜盐草属另一种类英格曼喜盐草(Halophilaengelmannii)的种子有长达2a的寿命,而针叶藻属(Syringodium)和二药藻属(Halodule)海草的种子寿命更可分别长达4a和3a以上[31]。4月份珍珠湾贝克喜盐草种群土壤种子库种子密度为2728 粒/m2,远高于马来西亚登嘉楼州甘马挽的多年生贝克喜盐草种群(156 粒/m2)[20]以及位于德国瓦登海的诺氏大叶藻(Zosteranoltii)种群(367.3—487.5 粒/m2)[29];但远低于喜盐草另外两个1年生种类:多毛喜盐草(Halophiladecipiens)(176880粒/m2)[32]和三脉喜盐草(Halophilatricostata)(70000粒/m2)[33]。然而,由于潮间带海草床所在区域属于人为密集影响的滩涂,挖螺、耙贝、挖沙虫(裸体方格星虫,Sipunculusnudus)和挖泥丁(可口革囊星虫,Phascolosomaesculenta)等活动对海草床沉积物频繁搅动,同时,该地区夏季频发的台风暴潮春、夏季丰富的降雨量[24]、底栖动物对海草种子的采食(Fishman等曾报道了蓝蟹(Callinectessapidus)最高可捕食65%的大叶藻(Zosteramarina)种子[34])、部分种子萌发等因素,使这一位于江平河尾的贝克喜盐草海草床土壤种子库快速减少,4月份的土壤种子库种子密度仅为1月的47.5%。此外,初步室内培养的实验结果表明,该种类的种子萌发并非同步,且萌发率较低(1.5—2.2个月种子萌发率为7.4%;3.6—4.2个月种子萌发率为5.7%;超过5.5个月的种子萌发率仅为5.7%)[20]。尽管喜盐草属海草有较快的生长速率[35]、对盐度适应范围较广[17]以及较高的种子产量,这些特性有利于该属海草的快速拓展,但其较高的种子损失率、可能的种子休眠机制、种子萌发的非同步性、较低的种子萌发率等因素可能会造成贝克喜盐草较低的种群更新。加之贝克喜盐草所生长的潮间带,是人为影响最为强烈的区域之一,人为活动对经济动物的挖掘常造成海草全株被翻起,导致局部海草的死亡[6]。这些因素都是在讨论贝克喜盐草濒危机制所应该考虑到的。
3.4 贝克喜盐草地上/地下生物量比值的动态变化及其生态学意义
Duarte等[36]通过对全球30种海草的汇总分析,得出全球海草地上/地下生物量比值平均值为1.11±0.08,他认为该比值随纬度而增加,且个体大的海草将生物量分配给更多的地下组织(根状茎与根),但并未考虑到同种海草在不同发育阶段地上/地下生物量比值的巨大差别。本研究中的贝克喜盐草种群,其比值随着不同发育阶段(开始生长—高峰—衰败)从1.95减小至0.53,在开始生长阶段远高于全球海草平均值,而在衰败阶段,则远低于全球平均值。因此,我们认为,通过海草的地上/地下生物量比值可判别贝克喜盐草种群所处的发育阶段。而在比较不同种类海草的地上/地下生物量比值时,应统一使用同一发育阶段;或者应说明海草所处之发育阶段。Parthasarathy 等[19]于1987年2—3月调查印度热带地区几个靠近红树林生境的贝克喜盐草种群时,其地上生物量是地下生物量的1.30—3.54倍(表3),由此推测这些种群可能处于开始生长发育的阶段。而同样位于热带地区泰国安达曼海Yaoyai岛的贝克喜盐草种群,其地上与地下生物量之比仅为0.667(表3),在调查时可能已经处于衰老阶段。
3.5 本研究的限制以及展望
由于潮汐的影响以及人力物力的制约,部分月份的海草面积无法使用GPS进行绕测,而采用目测的形式来估计,为提高海草床面积调查的精度,今后应尽可能避免使用目测的面积估算方法。此外,由于同样原因的影响,本研究每次调查时采样的数量仅为6—18个,而且无法在每个月的固定日期进行采样调查,尽管在纵向上(时间序列上)总体变化趋势明显,但每一次采样的各个样品间数据变动较大(图3),除了本身海草床内的非均匀分布的因素影响外,样本数量偏小可能也是一个影响因素。作为今后的深入拓展研究,应设立永久固定监测样地,并增加采样数量,从而尽可能减小数据的波动性。
4 结论
本研究表明,研究区内的贝克喜盐草,即使在不同月份所表现的种群属性亦差异迥然,也体现在不同时期海草床景观格局上的截然不同。因此,在作海草床的调查或监测时,时间选择与说明上,不仅年份很重要,调查(监测)的季节甚至月份也很重要。从管理层面来看,对于1年生的海草而言,1年1次的生态监测频度是远远不够的,至少要做每季度1次的监测。
尽管贝克喜盐草有较高的种子产量,但种子在萌发前损失率较高(休眠阶段的流失、被取食、被掩埋等因素的影响)且萌发率低,这些都将影响到下一年的种群更新。从而也为进一步探讨贝克喜盐草的濒危机制提供了重要的参考信息。
致谢: 感谢中国科学院遥感与数字地球研究所刘宇博士在制图方面提供的帮助,广西红树林研究中心刑永泽、何显锦对野外调查和实内实验给予帮助,特此致谢。
[1] Short F T, Coles R, Waycott M, Bujang J S, Fortes M, Prathep A, Kamal A H M, Jagtap T G, Bandeira S, Freeman A, Erftemeijer P, La Nafie Y A, Vergara S, Calumpong H P, Makm I.Halophilabeccarii// IUCN 2012.IUCN red list of threatened species. Version 2012. 2. [2013- 06- 05]. http://www.iucnredlist.org/details/173342/0.
[2] Short F T, Polidoro B, Livingstone S R, Carpenter K E, Bandeira S, Bujang J S, Calumpong H P, Carruthers T J B, Coles R G, Dennison W C, Erftemeijer P L A, Fortes M D, Freeman A S, Jagtap T G, Kamal A H M, Kendrick G A, Kenworthy W J, La Nafie Y A, Nasution I M, Orth R J, Prathep A, Sanciangco J C, van Tussenbroek B, Vergara S G, Waycott M, Zieman J C. Extinction risk assessment of the world′s seagrass species. Biological Conservation, 2011, 144(7): 1961- 1971.
[3] Zakaria M H, Bujang J S, Arshad A. Flowering, fruiting and seedling of annualHalophilabeccariiAschers in Peninsular Malaysia. Bulletin of Marine Science, 2002, 71(3): 1199- 1205.
[4] Davison G W H, Ng P K L, Ho H C. The Singapore Red Data Book: Threatened Plants and Animals of Singapore. Singapore: Nature Society, 2008.
[5] Fan H Q, Shi Y J, Qiu G L. China Seagrass Plants. Beijing: Ocean Press, 2009.
[6] Fan H Q, Qiu G L, Shi Y J, Li S. Studies on Physiological Ecology of Seagrasses in Subtropical China. Beijing: Science Press, 2011.
[7] Zheng F Y, Qiu G L, Fan H Q, Zhang W. Diversity, distribution and conservation of seagrass species in China. Biodiversity, 2013, 21(5): XX- XX(in press).
[8] Roberts H A. Seed banks in soils // Coaker T H, ed. Advances in Applied Biology. Vol. 6. Cambridge: Academic Press, 1981: 1- 55.
[9] Milberg P, Hansson M L. Soil seed bank and species turnover in a limestone grassland. Journal of Vegetation Science, 1994, 5(1): 35- 42.
[10] Li Q Y, Zhao W Z. Advances in the soil seed bank of arid regions. Advances in Earth Science, 2005, 20(3): 350- 358.
[11] Han H W, Jiang X, Pan J H, Cong W, Sun J, Zhang Z Z, Song S F, Sheng B L, Wang Q Y, Li X J. Characteristics of seagrass seed and restoration of seagrass bed. Chinese Journal of Plant Ecology, 2012, 36(8): 909- 917.
[12] González-Correa J M, Fernández-Torquemada Y, Sánchez-Lizaso J L. Comparing shoot population dynamics methods onPosidoniaoceanicameadows. Journal of Experimental Marine Biology and Ecology, 2007, 353(1): 115- 125.
[13] Waycott M, Longstaff B J, Mellors J. Seagrass population dynamics and water quality in the Great Barrier Reef region: a review and future research directions. Marine Pollution Bulletin, 2005, 51(1/4): 343- 350.
[14] Fourqurean J W, Marbà N, Duarte C M. Elucidating seagrass population dynamics: theory, constraints, and practice. Limnology and Oceanography, 2003, 48(5): 2070- 2074.
[15] Marbà N, Duarte C M, Cebrian J, Gallegos M E, Olesen B, Sand-Jensen K. Growth and population dynamics ofPosidoniaoceanicaon the Spanish Mediterranean coast: Elucidating seagrass decline. Marine Ecology-Progress Series, 1996, 137(1/3): 203- 213.
[16] Duarte C M, Hemminga M A, Marbà N. Growth and population dynamics ofThalassodendronciliatumin a Kenyan back-reef lagoon. Aquatic Botany, 1996, 55(1): 1- 11.
[17] Jagtap T G, Untawale A G. Ecology of seagrass bed ofHalophilabeccarii(Aschers) in Mandovi estuary, Goa. Indian Journal of Marine Sciences, 1981, 10(4): 402- 404.
[18] Ghevade K S, Joshi G V, Chavan P D. Dark carbon assimilation studies in a seagrass,HalophilabeccariiAschers. Photosynthetica, 1985, 19(1): 109- 111.
[19] Parthasarathy N, Ravikumar K, Ramamurthy K. Floral biology and ecology ofHalophilabeccariiAschers (Hydrocharitaceae). Aquatic Botany, 1988, 31(1/2): 141- 151.
[20] Zakaria M H, Sidik B J, Hishamuddin O. Flowering, fruiting and seedling ofHalophilabeccariiAschers. (Hydrocharitaceae) from Malaysia. Aquatic Botany, 1999, 65(1/4): 199- 207.
[21] Den Hartog C, Yang Z D. A catalogue of the seagrasses of China. Chinese Journal of Oceanology and Limnology, 1990, 8(1): 74- 91.
[22] Huang X P, Huang L M, Li Y H, Xu Z Z, Fong C W, Huang D J, Han Q Y, Huang H, Tan Y H, Liu S. Main seagrass beds and threats to their habitats in the coastal sea of south China. Chinese Science Bulletin, 2006, 51(S2): 136- 142.
[23] Huang X P, Jiang Z J, Zhang J P, Shi Z, Wang F, Ye F, Li L. Newly discovered seagrass beds in the coastal seas of Guangdong Province. Journal of Tropical Oceanography, 2010, 29(1): 132- 135.
[24] Committee of Annals of Chinese Bays. Bays in Guangxi, vol. 12. Beijing: Ocean Press, 1993.
[25] Short F T, Mckenzie L J, Coles R G, Vidler K P, Gaeckle J L. SeagrassNet Manual for Scientific Monitoring of Seagrass Habitat (worldwide edition). New Hampshire: University of New Hampshire Publication, 2006.
[26] Poovachiranon S, Chansang H. Community structure and biomass of seagrass beds in the Andaman sea. I. Mangrove-associated seagrass beds. Phuket Marine Biological Center Research Bulletin, 1994, 59: 53- 64.
[27] Chen C H, Wu Z J, Zhang G X. Ecological status and sustainability of seagrass beds in Xincun Harbor, Hainan. Ocean Development and Management, 2011, 28(11): 74- 78.
[28] Inglis G J. Disturbance-related heterogeneity in the seed banks of a marine angiosperm. Journal of Ecology, 2000, 88(1): 88- 99.
[29] Zipperle A M, Coyer J A, Reise K, Stam W T, Olsen J L. Evidence for persistent seed banks in dwarf eelgrassZosteranoltiiin the German Wadden Sea. Marine Ecology-Progress Series, 2009, 380: 73- 80.
[30] Duarte C M. Allometric scaling of seagrass form and productivity. Marine Ecology-Progress Series, 1991, 77: 289- 300.
[31] Mcmillan C. The longevity of seagrass seeds. Aquatic Botany, 1991, 40(2): 195- 198.
[32] Kuo J, Kirkman H.HalophiladecipiensOstenfeld in estuaries of southwestern Australia. Aquatic Botany, 1995, 51(3/4): 335- 340.
[33] Kuo J, Long W J L, Coles R G. Occurrence and fruit and seed biology ofHalophilatricostataGreenway (Hydrocharitaceae). Australian Journal of Marine and Freshwater Research, 1993, 44(1): 43- 57.
[34] Fishman J R, Orth R J. Effects of predation onZosteramarinaL. seed abundance. Journal of Experimental Marine Biology and Ecology, 1996, 198(1): 11- 26.
[35] Marbà N, Duarte C M. Rhizome elongation and seagrass clonal growth. Marine Ecology-Progress Series, 1998, 174: 269- 280.
[36] Duarte C M, Chiscano C L. Seagrass biomass and production: a reassessment. Aquatic Botany, 1999, 65(1/4): 159- 174.
参考文献:
[5] 范航清, 石雅君, 邱广龙. 中国海草植物. 北京: 海洋出版社, 2009.
[6] 范航清, 邱广龙, 石雅君, 李森. 中国亚热带海草生理生态学研究. 北京: 科学出版社, 2011.
[7] 郑凤英, 邱广龙, 范航清, 张伟. 中国海草的多样性、分布及保护. 生物多样性, 2013, 21(5): (待排版).
[10] 李秋艳, 赵文智. 干旱区土壤种子库的研究进展. 地球科学进展, 2005, 20(3): 350- 358.
[11] 韩厚伟, 江鑫, 潘金华, 丛炜, 孙娟, 张壮志, 宋少峰, 盛宝利, 王青岩, 李晓捷. 海草种子特性与海草床修复. 植物生态学报, 2012, 36(8): 909- 917.
[23] 黄小平, 江志坚, 张景平, 施震, 汪飞, 叶丰, 李磊. 广东沿海新发现的海草床. 热带海洋学报, 2010, 29(1): 132- 135.
[24] 《中国海湾志》编纂委员会. 中国海湾志: 第十二分册(广西海湾). 北京: 海洋出版社, 1993.
[27] 陈春华, 吴钟解, 张光星. 新村港海草床的生态状况及可持续利用探讨. 海洋开发与管理, 2011, 28(11): 74- 78.
PopulationdynamicsandseedbanksofthethreatenedseagrassHalophilabeccariiinPearlBay,Guangxi
QIU Guanglong1,2, FAN Hangqing2, LI Zongshan1, LIU Guohua1,*, SHI Yajun3, LI Sen
1StateKeyLaboratoryofUrbanandRegionalEcology,ResearchCenterforEco-environmentalSciences,ChineseAcademyofSciences,Beijing100085,China2GuangxiMangroveResearchCenter,GuangxiAcademyofSciences,Beihai536000,China3YantaiInstituteofCoastalZoneResearch,ChineseAcademyofSciences,YantaiShandong264003,China
HalophilabeccariiAscherson is one of two species in the oldest lineage of seagrasses, and belongs to the family Hydrocharitaceae. It is a small submerged creeper, found in the upper intertidal zone, and grows on mud or muddy sand substrates in estuarine and coastal areas. This species has been recorded to be at the coastlines of East Asia, Southeast Asia, Central Asia, Kenya and Tanzania. Global population trends indicate this species is declining, although it is fast growing and may recover quickly from disturbance. However, it also has a narrow, restricted depth range that coincides with the intertidal zone, an area subject to much anthropogenic disturbance. This species was listed as ‘Vulnerable’ by the International Union for Conservation of Nature under criterion B2.H.beccariioccupies a very limited area in China and it is threatened by many forms of disturbance. Very little ecological information has been reported from China or subtropical regions globally for this species, and existing ecological studies are restricted to tropical regions in Southeast Asia or South Asia. The lack of basic ecological information onH.beccariiin China affects our understanding of the mechanisms underlying its decline, and thus hinders efforts to conserve and manage this threatened seagrass species.
To examine temporal variation in the area, percent cover, above-ground/below-ground biomass, shoot density, reproductive organ density and the sediment seed banks ofH.beccariiin Pearl Bay, Guangxi, samples were taken and surveys were carried out from April 2012 to April 2013 at roughly one-month intervals. Our results indicate that the area, percent cover, shoot density, biomass and reproductive organs density ofH.beccariiin Pearl Bay vary greatly at different stages of population development over an annual cycle. Generally, all population parameters initially increased from April 2012, until they reached a peak value and then decreased. It seems the growth dynamics of the population followed “n” patterns with the peak values for shoot density (21602 /m2), female flower density (5404/m2) and above-ground biomass (42.712 g/m2(DW)) occurring in early August; male flower density (2189/m2) in late August; and area (21.4 hm2), percent cover (55%), below-ground biomass (39.701 g/m2(DW)) and total biomass (70.583 g/m2(DW)) in late October. We conclude that the flowers ofH.beccariiin Pearl Bay are strongly protogynous. The ratio for above-ground to below-ground biomass decreases continuously from 1.95 to 0.53 during population development. Mean fruit density (as calculated from October 2012) was 4125 /m2. Analysis of 186H.beccariifruits from Pearl Bay (1.7% of fruits had one seed, 79.7% had two seeds, 13.6% had three seeds and 5.1% had four seeds), revealed that seed counts varied from 1—4 with a mean of 2.22 mature seeds per fruit. Seed reserves in the soil varied with sampling location within the meadow, with an average of 5749 /m2in January, 5652 /m2in March and 2728 /m2in April. Based on our results for the area of seagrass and soil seed bank information, we estimate that the soil seed reserve ofH.beccariiin Pearl Bay in January is about 1.23 × 109. We conclude that theH.beccariipopulation in Pearl Bay, Guangxi has the highest area, coverage, shoot density and biomass of all the sites where this species has been recorded in China. We suggest that the continuous decrease of the ratio of above-ground to below-ground biomass with population development means that the value of this ratio can be used as indicator for distinguishing between different developmental stages ofH.beccariipopulations. Despite being characterized by high seed production and fast growth, this species is threatened by high levels of human induced habitat disturbance, high rates of seed loss in sediments and low seed germination rates, which are all negatively affecting the regeneration ofH.beccariipopulations.
threatened seagrass; phenological phenomenonn;Halophilabeccarii; seed bank; population development
广西“红树林和海草系统保育与生态监测”特聘专家岗位基金资助项目;广西自然科学基金资助项目(0832030);广西科学院基本科研业务费资助项目(13YJ22HS12);广西青年科学基金资助项目(2012GXNSFBA053141);国家青年科学基金项目(31000210)
2013- 06- 09;
2013- 07- 29
*通讯作者Corresponding author.E-mail: ghliu@rcees.ac.cn
10.5846/stxb201306091489
邱广龙,范航清,李宗善,刘国华,石雅君,李森.濒危海草贝克喜盐草的种群动态及土壤种子库——以广西珍珠湾为例.生态学报,2013,33(19):6163- 6172.
Qiu G L, Fan H Q, Li Z S, Liu G H, Shi Y J, Li S.Population dynamics and seed banks of the threatened seagrassHalophilabeccariiin Pearl Bay, Guangxi.Acta Ecologica Sinica,2013,33(19):6163- 6172.
