预处理方式对香蒲和芦苇种子萌发的影响
2013-12-09王雪宏佟守正吕宪国张文广霍莉莉曹笑笑孟宪坤
孟 焕,王雪宏,佟守正,*,吕宪国,张文广,霍莉莉,曹笑笑,孟宪坤
(1. 中国科学院湿地生态与环境重点实验室,中国科学院东北地理与农业生态研究所,长春 130012;2. 中国科学院研究生院,北京 100049;3. 富锦沿江湿地自然保护区管理局,富锦 156100)
预处理方式对香蒲和芦苇种子萌发的影响
孟 焕1,2,王雪宏1,佟守正1,*,吕宪国1,张文广1,霍莉莉1,2,曹笑笑1,2,孟宪坤3
(1. 中国科学院湿地生态与环境重点实验室,中国科学院东北地理与农业生态研究所,长春 130012;2. 中国科学院研究生院,北京 100049;3. 富锦沿江湿地自然保护区管理局,富锦 156100)
有性繁殖是植物种群形成与维持的主要方式。为探索退化湿地的快速恢复方法,为松花江下游退化湿地恢复提供科学依据,本研究开展了香蒲和芦苇种子快速发芽的有性繁殖实验。研究采用滤纸为发芽基质,通过变温培养试验,以未浸种处理为参照,分析了蒸馏水、双氧水(H2O2)、硝酸钾(KNO3)和高锰酸钾(KMnO4)溶液浸种的预处理方式对香蒲、芦苇种子发芽率和发芽速率的影响。结果表明:不同预处理方式对香蒲、芦苇种子的发芽率和发芽速率均具有显著影响。KMnO4溶液浸种再清洗处理条件下,香蒲种子发芽率和发芽速率均显著高于其他处理,平均发芽率可达未浸种处理条件下的3.1倍,发芽速率为16.17±0.80。芦苇种子的发芽率和发芽速率在经KNO3溶液浸泡再清洗处理后效果最佳,种子发芽率达96%—99%,发芽速率达28.43±0.71。因此,分别对香蒲、芦苇种子采用KMnO4和KNO3溶液浸泡再清洗的预处理方式可以缩短出苗时间,提高发芽率,从而加速湿地植被恢复进程。
种子萌发;预处理方式;香蒲;芦苇
香蒲(Typhadomingensis)和芦苇(Phragmitesaustralis)是典型的湿地植物物种,它们在消除水体富营养化、恢复水域养分平衡、吸收重金属、高效水质净化等方面[1- 6]具有重要作用。作为松花江下游(佳木斯至同江)沿江湿地植被的重要组成部分,香蒲和芦苇群落不仅对松花江水体起到了巨大的净化作用,同时也为其他湿地生物提供了适宜的生境。近年来,随着农业开垦、河道采沙等人类活动影响的逐渐加剧,松花江下游沿江湿地植被遭到了一定程度的破坏,湿地功能退化显著[7- 8]。保护与恢复沿江湿地生态系统的完整性与稳定性,特别是开展香蒲、芦苇等典型湿地植物的保护与恢复,对改善松花江下游水质、保障三江平原区域的生态安全、提高湿地生物多样性,促进区域生态文明建设具有重要意义。有性繁殖是植物种群形成与维持的主要方式,对于维持湿地地表植被的生物多样性起着重要的作用[9],是湿地恢复和重建的一种重要方法。种子萌发是植物有性繁殖的重要表现,适宜的种子预处理方式可以加速种子萌发,提高种子萌芽率,进而可以加速退化湿地的恢复进程。
目前,有关植物种子萌发和幼苗生长对光照、温度、湿度、盐分等环境因子响应方面的研究较多[10- 15],关于外源物质预处理方式促进植物种子萌发的研究也有一些报道,通过对种子采用不同化学物质、溶剂及浓度的外源激素预处理发现,氢氧化钠、高锰酸钾、硫酸铜、萘乙酸、6-苄氨基嘌呤、赤霉素、双氧水和硝酸钾等均能在一定程度上提高种子的发芽率,促进种子的萌发[16- 20]。以往研究多集中在农作物或是超富集植物种子萌发对预处理方式的响应方面,而关于香蒲和芦苇等典型湿地植物的种子对预处理方式的响应研究相对较少。因此,本研究通过室内模拟实验分析了不同预处理方式对松花江下游沿江湿地香蒲和芦苇种子萌发的影响,旨在通过对典型湿地植物有性繁殖方式的人工干预,探索植物种子的快速萌发方法,并以此为依据为松花江下游沿江湿地恢复提供技术支持。
1 材料与方法
1.1 试验材料
于2012年10月上旬自松花江下游富锦市东郊夏吉利村江边(47°16′39.4″ N, 132°02′44.2″ E)采集香蒲和芦苇种子,各自风干后在4 ℃条件下贮存备用。实验室条件下制备或配置一定浓度的、可以促进种子萌发[19,21]的浸种液,即蒸馏水和浓度均为0.1%的双氧水(H2O2)、硝酸钾(KNO3)、高锰酸钾(KMnO4)溶液,并以未浸种为参照预处理方式。
1.2 研究方法
1.2.1 浸种后不清洗处理
室温下浮水法选取成熟饱满种子,分别用蒸馏水、0.1%的H2O2、0.1%的KNO3、0.1%的KMnO4溶液浸泡12 h,然后将种子直接均匀排列于垫有单层滤纸的直径为9 cm的培养皿中进行萌发试验。萌发实验每皿100粒种子,4个重复。
1.2.2 浸种后清洗处理
浸种药品选取与浓度同1.2.1,浸种12 h,种子经蒸馏水反复清洗干净后放入垫有单层滤纸的直径为9 cm的培养皿中进行萌发试验,每皿100粒种子,4个重复。同时以未浸种作为对照处理。浸种时间选为12 h是从生产角度考虑,当天晚上浸种,第2天进行播种,同时防止浸种时间过长对种子产生破坏。
将上述培养皿放在培养箱(LRH-250-GS II, 中国)中,培养箱设置的光温条件为光照12 h/25 ℃和黑暗12 h/15 ℃。每天18:00定时观测,统计萌发种子数,以胚芽长出1 mm为发芽,以连续3 d没有种子萌发为实验结束标志。试验期间向培养皿中适时添加蒸馏水以保持培养基湿润。
1.3 数据分析方法
计算种子的发芽率和发芽速率,公式[15]如下:

(1)
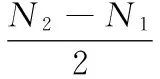
(2)
式中,Nt为时间t日内获得的种子发芽率。
数据统计、分析、作图分别采用Excel 2003、SPSS 16.0和Origin 8.1进行处理,数据用均值±标准误(Mean±Se)表示。对不同预处理方式下的种子发芽率、发芽速率进行单因素方差分析,并在0.05显著度水平上进行多重比较(Tukey)。
2 结果与分析
2.1 预处理方式对香蒲种子发芽率的影响
香蒲种子从第3天开始发芽,至第10天发芽试验结束。由表1可以看出,与未浸种处理相比,除经H2O2浸种处理外,香蒲种子发芽率均有显著提高(Plt; 0.05),平均发芽率最高可达对照的3.1倍,说明浸种的预处理方式是提高香蒲种子发芽率的必要措施。
针对香蒲种子发芽率(介于24%—74%之间)特点,本试验以40%作为香蒲种子发芽率的评价标准。从表2可以看出,经KMnO4浸种后清洗与KNO3浸种处理(清洗和未清洗)的种子在第5天发芽率均超过40%;经蒸馏水和KMnO4浸种后不清洗与H2O2浸种后清洗处理的香蒲种子,第6天和第7天的发芽率虽然也在40%以上,但所需的时间略长于KNO3浸种处理;而经H2O2浸种后不清洗处理的种子发芽率明显劣于其他处理,至萌发试验结束时,其发芽率仅有20%—28%,与对照组中未浸种处理无显著差异。另外,对照组与H2O2浸种处理的幼苗细小、微黄、长势弱,而其他经过浸种处理的幼苗比较健壮。试验中KMnO4浸种后清洗处理效果最佳,发芽率达68%—84%,发芽率超过40%的时间为5 d,因此,采用KMnO4浸种并清洗的处理方式进行的有性繁殖更利于湿地香蒲种群的恢复。

表1 不同预处理方式下的香蒲种子发芽率(均值±标准误,%)
同列数据后不同字母表示处理间差异显著
2.2 预处理方式对芦苇种子发芽率的影响
芦苇种子从第3天开始发芽,至第10天发芽试验结束。由表2可以看出,经H2O2浸种后未清洗处理下芦苇种子发芽率最低,其他处理与对照未浸种处理相比,芦苇种子发芽率均显著提高(Plt; 0.05),且蒸馏水浸种处理下的芦苇种子最终发芽率,与其他药剂浸种处理(除经H2O2浸种后未清洗)条件下的无显著差异(Pgt; 0.05)。
针对芦苇种子发芽率(介于52%—97%之间)特点,本试验以80%作为芦苇种子发芽率的评价标准。从表2可以看出,经KNO3浸种、KMnO4和H2O2浸种后清洗处理的芦苇种子在第5天发芽率均超过80%;经KMnO4浸种后未清洗和蒸馏水浸种处理的芦苇种子,第6天和第7天的发芽率虽然也在80%以上,但所需的时间略长于KNO3浸种与KMnO4和H2O2浸种后清洗处理;而经H2O2浸种后不清洗处理的种子至萌发试验结束时,其发芽率仅有48%—56%,明显低于其他处理。另外,试验中KNO3浸种后清洗处理效果最佳,芦苇种子发芽率达96%—99%,发芽率超过80%的时间为5 d,其所用时间也比试验结束时间缩短了50%。因此,采用KNO3浸种,并清洗的处理方式进行芦苇的有性繁殖更利于湿地植被恢复的进行。

表2 不同预处理方式下的芦苇种子发芽率(均值±标准误,%)
2.3 预处理方式对种子发芽速率的影响
对香蒲、芦苇的种子发芽速率进行单因素方差分析,结果显示:预处理方式对香蒲和芦苇种子的发芽速率均有显著影响(Plt;0.05,图1)。均值多重比较结果表明,未浸种处理与H2O2浸种后不清洗处理条件下的香蒲种子发芽速率均无显著性差异(Pgt; 0.05),且均显著低于其他药剂处理(Plt; 0.05);蒸馏水,KNO3、KMnO4浸种后未清洗以及KMnO4浸种后清洗处理条件下的香蒲种子发芽速率无显著差异(Pgt; 0.05);KMnO4浸种后清洗处理条件下香蒲种子发芽速率最大为16.17±0.80(图1)。对于芦苇种子而言,未浸种与H2O2浸种后不清洗处理条件下的芦苇种子发芽速率无显著性差异(Pgt; 0.05),且均显著低于其他预处理方式(Plt; 0.05,图1);虽然KNO3浸种后清洗处理条件下芦苇种子发芽速率最大为28.43±0.71,但是除未浸种与H2O2浸种后不清洗两种处理外,其他预处理条件下的芦苇种子发芽速率无显著差异(Pgt; 0.05)。

图1 预处理方式对种子发芽速率的影响Fig.1 Effects of pretreatments on germination speed A—F分别表示未浸种,蒸馏水,H2O2、KNO3、KMnO4浸种后未清洗以及H2O2、KNO3、KMnO4浸种后清洗8种处理; 不同字母间表示差异显著
3 讨论
KMnO4是强氧化剂,具有杀菌消毒的作用,在种子浸泡过程中能够促进种子包膜的氧化,使种子中淀粉和蛋白质等有机物质充分吸收水分,短时间内达到种子萌发所需的必要条件,进而提高种子发芽率和发芽速率[17,19]。本试验中KMnO4对芦苇种子萌发的促进效果之所以弱于香蒲,可能在于两种植物种子大小、种皮透性不同。经KMnO4浸种后芦苇种子颜色变深程度高于香蒲,使其种子萌发期间接受光照的强度减弱,从而影响了种子萌发。KNO3常用来促进休眠种子的萌发[22],原因在于KNO3中的K+作为多种酶(如NAD激酶、ATP酶等)的激活剂,可以在一定程度上提高多种酶的活性,使细胞膜得到部分修复,也可以参与诱导植物体内生长促进型激素的生物合成,从而促进种子萌发[17,23]。本研究中经KNO3溶液浸种后清洗与未清洗处理对芦苇种子的发芽率和发芽速率无显著影响,可能是由于试验期间为保证种子萌发所需水分条件,添加蒸馏水稀释其浓度所致。H2O2是强氧化剂,能促进氧气的进入和内部有毒物质的降解及排出,利于细胞内部正常的氧化还原反应[23],但试验中H2O2浸种对香蒲种子发芽率、发芽速率以及芦苇发芽速率却无显著影响,而对茄子、辣椒、慈姑、龙葵、棉花等种子萌发具有促进作用[16- 19,23],表明对于不同植物种子来说,不同物质及其浓度对植物种子萌发的影响不同。同时本研究这也说明了针对不同植物种子采取不同的预处理方式对于提高植物种子萌发,加速植被恢复具有重要意义。
4 结论
(1)浸种的预处理方式对香蒲种子发芽率、发芽速率均具有显著影响。采用KMnO4浸种再清洗的处理方式能够显著提高香蒲种子发芽率和发芽速率,进而加速湿地植被恢复进程。
(2)药品浸种与蒸馏水浸种处理对芦苇种子发芽率、发芽速率的影响无显著差异,但从发芽率超过80%所需的时间来看,采用KNO3浸种再清洗的处理方式对芦苇种子萌发的影响效果最佳,缩短了芦苇出苗时间。
(3)不同植物种子萌发对浸种预处理方式的响应不同,适用的药品处理方法也不同,因此,探寻不同种子预处理方式对湿地植物种子萌发的影响是加速湿地植被恢复进程的关键技术之一。
[1] Li R H, Guan Y T, He M, Hu H Y, Jiang Z P. Pilot-Scale study on riparianPhragmitescommunis,ZizanialatifoliaandTyphaangustifoliaL. zones treating polluted river water. Environmental Science, 2006, 27(3): 493- 497.
[2] Wen Z L, Wen Y M, Wu X F. The application of Cattail plant in sewage disposal. Environment and Exploitation, 1999, 14(4): 28- 30.
[3] Lian J J, Xu S G, Han C W. Absorption characteristics of Molybdenum by reed and cattail. Environmental Science, 2011, 32(11): 3335- 3340.
[4] Fu C P, Tang Y P, Chen X J, Li J H. Purification by Typha in wetland with high salt of landscape river in Tianjin economic development area (TEDA). Journal of Agro-Environment Science, 2006, 25(Z1): 186- 190.
[5] Li K D, Hu Z J. Mechanisms of sewage purification by reed bed system. China Environmental Science, 1995, 15(2): 140- 144.
[6] Xu H S, Fu R B, Chu Y Y. Phosphorus removal from rural domestic wastewater and removal pathways analysis using reed wetlands. Ecology and Environment, 2007, 16(5): 1372- 1375.
[7] Li Y L, Jiao J Y, Li R, Chen Y. Response characteristics of sediment to human activities in the Songhua River basin. Journal of Sediment Research, 2009, (3): 62- 70.
[8] Wang Z D, Liu M X, Zhang Z M. Importance of grassland and wetland restoration from cropland in Songhua River on Eryijiu Farm. Modernizing Agriculture, 2007, (7): 20- 21.
[9] Hou Z Y, Xie Y H, Yu X Y, Ren B, Yang G. Research method, content, and prospect on seed bank of freshwater wetland. Chinese Journal of Ecology, 2008, 27(8): 1400- 1405.
[10] Sharma K P, Gopal B. Seed germination and occurrence of seedlings ofTyphaspecies in nature. Aquatic Botany, 1978, 4: 353- 358.
[11] Dyer W E. Exploiting weed seed dormancy and germination requirements through agronomic practices. Weed Science, 1995, 43(3): 498- 503.
[12] Lombardi T, Fochetti T, Bertacchi A, Onnis A. Germination requirements in a population ofTyphalatifolia. Aquatic Botany, 1997, 56(1): 1- 10.
[13] Ekstam B, Johannesson R, Milberg P. The effect of light and number of diurnal temperature fluctuations on germination ofPhragmitesaustralis. Seed Science Research, 1999, 9(2): 165- 170.
[14] Zia S, Khan M A. Effect of light, salinity, and temperature on seed germination ofLimoniumstocksii. Canadian Journal of Botany, 2004, 82(2): 151- 157.
[15] Yu J B, Wang X H, Ning K, Li Y Z, Wu H F, Fu Y Q, Zhou D, Guan B, Lin Q X. Effects of salinity and water depth on germination ofPhragmitesaustralisin Coastal Wetland of the Yellow River Delta. Clean-Soil, Air, Water, 2012, 40(10): 1154- 1158.
[16] Yu Z Z, Zhang E R, Zhang B K. Research on optimum pretrearing methods of eggplant seeds with exotic hormones. Journal of Shanghai Jiaotong University: Agricultural Science, 1993, 11(4): 291- 296.
[17] Song Z R. Effect of different reagents on capsicum germination. Chinese Seed Industry, 2003, (6): 26- 27.
[18] Yuan L C, Lü L F, Chen B S, Chen C, He X D, Yang L Y. Studies on the effect of soaking with several chemicals on the germination of seed ofIphigeniaindica. Seed, 2003, (2): 41- 42.
[19] Yang C J, Wei S H, Zhou Q X, Hu Y H, Niu R C. Effects of illumination and seed-soaking reagent on seed germination ofSolanumnigrum. Chinese Journal of Applied Ecology, 2009, 20(5): 1248- 1252.
[20] Qaderi M M, Cavers P B. Interpopulation variation in germination responses of Scotch thistle,OnopordumacanthiumL., to various concentrations of GA3, KNO3and NaHCO3. Canadian Journal of Botany, 2000, 78(9): 1156- 1163.
[21] Yücel E, Yilmaz G. Effects of different alkaline metal salts (NaCl, KNO3), acid concentrations (H2SO4) and growth regulator (GA3) on the germination ofSalviacyanescensBoiss. amp; Bal. Seeds. G. U. Journal of Science, 2009, 22(3): 123- 127.
[22] Mayer A M, Poljakoff-Mayber A. The Germination of Seeds. 4th ed. Oxford: Pergamon Press, 1989.
[23] Tang J X, Zhao X L, Xu X J. Effects of H2O2and KNO3on the germination of aged cotton seed. Journal of Henan Agricultural Sciences, 2003, (6): 13- 15.
参考文献:
[1] 李睿华, 管运涛, 何苗, 胡洪营, 蒋展鹏. 河岸芦苇、茭白和香蒲植物带处理受污染河水中试研究. 环境科学, 2006, 27(3): 493- 497.
[2] 温志良, 温琰茂, 吴小峰. 香蒲植物在污水治理中的应用. 环境与开发, 1999, 14(4): 28- 30.
[3] 练建军, 许士国, 韩成伟. 芦苇和香蒲对重金属钼的吸收特性研究. 环境科学, 2011, 32(11): 3335- 3340.
[4] 付春平, 唐运平, 陈锡剑, 李江华. 香蒲湿地对泰达高盐再生水景观河道水质净化效果的研究. 农业环境科学学报, 2006, 25(Z1): 186- 190.
[5] 李科德, 胡正嘉. 芦苇床系统净化污水的机理. 中国环境科学, 1995, 15(2): 140- 144.
[6] 徐和胜, 付融冰, 褚衍洋. 芦苇人工湿地对农村生活污水磷素的去除及途径. 生态环境, 2007, 16(5): 1372- 1375.
[7] 李林育, 焦菊英, 李锐, 陈杨. 松花江流域河流泥沙及其对人类活动的响应特征. 泥沙研究2009, (3): 62- 70.
[8] 王振东, 刘茂祥, 张子民. 二九一农场松花江河道滩地退耕还草还湿的重要性. 现代化农业, 2007, (7): 20- 21.
[9] 侯志勇, 谢永宏, 于晓英, 任勃, 杨刚. 淡水湿地种子库的研究方法、内容与展望. 生态学杂志, 2008, 27(8): 1400- 1405.
[16] 于志章, 张恩让, 张秉奎. 茄子种子外源激素预处理最优方法的研究. 上海农学院学报: 农业科学版, 1993, 11(4): 291- 296.
[17] 宋志荣. 几种药剂对辣椒种子发芽的影响研究. 中国种业, 2003, (6): 26- 27.
[18] 袁理春, 吕丽芬, 陈保生, 陈翠, 和向东, 杨丽云. 不同化学试剂对丽江山慈菇种子发芽力影响. 种子, 2003, (2): 41- 42.
[19] 杨传杰, 魏树和, 周启星, 胡亚虎, 牛荣成. 光照和不同药剂浸种对龙葵种子发芽率的影响. 应用生态学报, 2009, 20(5): 1248- 1252.
[23] 汤菊香, 赵新亮, 徐新娟. H2O2和KNO3对棉花老化种子发芽的影响. 河南农业科学, 2003, (6): 13- 15.
EffectsofpretreatmentongerminationofTyphadomingensisandPhragmitesaustralis
MENG Huan1,2, WANG Xuehong1, TONG Shouzheng1,*, LÜ Xianguo1, ZHANG Wenguang1, HUO Lili1,2, CAO Xiaoxiao1,2, MENG Xiankun3
1ResearchCenterforWetlandEcologyandEnvironment,NortheastInstituteofGeographyandAgroecology,ChineseAcademyofSciences,Changchun130012,China2GraduateUniversityofChineseAcademyofSciences,Beijing100049,China3NatureReserveAdministrationofWetlandalongtheSonghuaRiverinFujin,Fujin156100,China
Global changes and human activities have negative effects on the wetland habitats, which decrease the area of wetland, reduce species diversity, and hinder the ecological functions. Wetland restoration, especially dominant plants restoration is critical and urgent to improve wetland conditions and areas worldwide. As the largest tributary of the Heilong River, Songhua River drains nearly 70% of the Northeast China′s land area. The riparian wetland along the downstream of Songhua River is suffering from ecological degradation of native vegetation.Typhadomingensis(T.domingensis) andPhragmitesaustralis(P.australis) are two dominant species in this basin, and play an important role in sustaining regional environmental functions. Seeds are produced annually, which would allow ample opportunities for colonization by sexual propagation. Seed propagation is considered to be an effective and feasible technique for vegetation restoration. In order to explore the optimal seed-soaking reagents to accelerate seed germination ofT.domingensisandP.australis, the pure live seeds of both species were collected from a riparian wetland along the downstream of Songhua River (47°16′39.4.″ N, 132°02′44.2″ E), and the seeds germination experiment was conducted in incubator (LRH- 250-GS II, China) with an alternating diurnal regime of 12 h of daylight at 25 ℃ and 12 h of darkness at 15 ℃ in laboratory. Effects of 8 different pretreatments (untreated, soaking with distilled water, soaking with 0.1% H2O2, soaking with 0.1% H2O2and then rinsing with distilled water, soaking with 0.1% KNO3, soaking with 0.1% KNO3and then rinsing with distilled water, soaking with 0.1% KMnO4, soaking with 0.1% KMnO4and then rinsing with distilled water, respectively) on germination percentage (GP) and germination speed (GS) ofT.domingensisandP.australisseeds are observed for 10 days. For each treatment, 100 seeds (four replicates) were placed on a layer of Whatman grade No.1 filter paper (pH 7) in 90 mm Petri dishes with distilled water to keep moist during the whole experiment. Results showed as follows: (1) Differences between untreated seeds and pretreated ones with reagent soaking on GP and GS ofT.domingensisandP.australiswere significant; (2) GP and GS ofT.domingensisunder the pretreatment of soaking with 0.1% KMnO4and then rinsing with distilled water were significantly greater than that of the rest pretreatments, and the average GP ofT.domingensiswas about 3.1 times greater than the untreated and the GS was up to 16.17±0.80; (3) Seed germination ofP.australisperformed best under the treatment of soaking with 0.1% concentration KNO3and rinsing with distilled water, and its GP and GS were up to 96%—99% and 28.43±0.71, respectively. The results indicate that seed pretreatment (seed-soaking reagent) is one of the most indispensable and efficient methods of accelerating the seed germination and seedling growth ofT.domingensisandP.australis. Rapid and effective restoration of the two dominant plants in the riverine wetlands along the downstream of Songhua River, therefore, could be expected through collecting their pure live seeds and pretreating the seeds with 0.1% KMnO4and 0.1% KNO3and then rinsing with distilled water respectively before dispersal.
seed germination; reagent pretreatment;Typhadomingensis;Phragmitesaustralis
国家自然科学基金资助项目(40971053);水体污染控制与治理科技重大专项资助项目(2012ZX07201004)
2013- 06- 08;
2013- 07- 22
*通讯作者Corresponding author.E-mail: tongshouzheng@neigae.ac.cn
10.5846/stxb201306081451
孟焕,王雪宏,佟守正,吕宪国,张文广,霍莉莉,曹笑笑.预处理方式对香蒲和芦苇种子萌发的影响.生态学报,2013,33(19):6142- 6146.
Meng H, Wang X H, Tong S Z, Lü X G, Zhang W G, Huo L L, Cao X X, Meng X K.Effects of pretreatment on germination ofTyphadomingensisandPhragmitesaustralis.Acta Ecologica Sinica,2013,33(19):6142- 6146.
