马兜铃水提液对斑马鱼胚胎的致畸作用和心脏毒性的研究
2013-12-09朱淑珍李银保陈缵光GeorgeLi姚美村
朱淑珍,李银保,陈缵光,George Q Li,姚美村*
马兜铃是传统中药之一,中国药典(2010年版)中记载马兜铃为马兜铃科植物北马兜铃(Aristolochia contorta Bge.)及南马兜铃(A.debilis Seib.et Zucc.)的果实。马兜铃的化学成分主要为马兜铃酸类(马兜铃酸Ⅰ,马兜铃酸Ⅱ等)和马兜铃内酰胺(马兜铃内酰胺Ⅰ等)[1]等。自从报导马兜铃酸类化合物是导致马兜铃酸肾病的主要成分[2]后,含马兜铃酸的中药在国际市场上被禁用,但中国药典(2010年版)仍保留了马兜铃、天仙藤和细辛这三味中药。研究发现,除马兜铃酸肾病外,马兜铃属植物还有致癌性[3-4],致突变性[3]和生殖毒性[3]等更为广泛的毒性。为安全用药考虑,有必要对马兜铃的毒性进行更多研究。
近年来,模式生物斑马鱼在药物毒性研究方面发挥了越来越重要的作用。由于斑马鱼的早期发育与人类极为相似,逐渐成为研究相关发育疾病基因的最佳模式生物。而斑马鱼胚胎的发育是全透明的,借助显微镜,可以全程观察和研究其心脏发育、血液流动状况及对胚胎的发育影响。此研究首次以发育6~8 hpf的斑马鱼胚胎为模型,在对比研究马兜铃酸A(AA)的毒性基础上,进行了马兜铃水提液对胚胎的致畸和心脏毒性影响,为进一步完善含马兜铃酸类中药的安全用药提供科学依据。
1 材料与方法
1.1 动物
实验用斑马鱼(Danio rerio)为野生(wild type,WT)AB系,由中山大学生命科学学院斑马鱼养殖系统提供。斑马鱼的养殖和繁殖参照Zebrafish Book[5]。按照 Kimmel 文献[6]描述对发育阶段分期。整个实验的操作遵循OECD标准[7]。
1.2 试剂及仪器
马兜铃(安徽省亳州市安国药业,产地东北),经中山大学王军老师鉴定,确定为北马兜铃Aristolochia contorta Bge.的干燥果实。色谱纯乙腈(Honeywell Burdick&Jackson公司,美国),二级纯水,马兜铃酸A(批号:0746-9002,中国药品生物制品检定所)。其他试剂均为国产分析纯。
显微摄像系统(倒置光学显微镜,40×,100×,BDS200,Optec,重庆,中国;CCD,DM200,Optec,重庆,中国),岛津高效液相色谱仪(LC-20AD二元泵,SIL-20A自动进样器,CTO-20A柱温箱,SPD-M20A PDA检测器)
1.3 马兜铃水提液的制备
[8],将药材粉碎,过60目筛。称取粉末20 g,加22倍水,煎煮2次,每次1 h,4 000 r/min离心8 min,合并上清液,旋转蒸干,加1 mL DMSO及斑马鱼胚胎培养液(4%CaCl2,10%NaCl,0.3%KCl,1.63%MgSO4)100 mL,4 000 r/min 离 心8 min,取上清即得水提液贮备液。水提液经过0.45 μm的微孔滤膜过滤,取20μL上清液注入高效液相色谱仪进行分析。
1.4 样品溶液的配置
AA贮备液的配制:精密称取AA适量,加1 mL DMSO,用胚胎培养液稀释至100 mL,即得AA贮备液。
AA样品溶液的配置:用胚胎培养液将贮备液稀释至 1,2,5,10,20,40,80 μg/mL。
马兜铃水提液的样品溶液的配置:将贮备液用培养液稀释,使其中的 AA 的浓度为0.5,1,2,5,10,20,40,80 μg/mL。
1.5 样品溶液的毒性分析
AA的毒性分析:在显微镜下选取正常发育的受精后6~8 h(6~8 hpf)的胚胎,按每组30枚胚胎分组,置于不同浓度的AA溶液中,每隔6 h更换新药1次。以斑马鱼胚胎培养液中发育的胚胎为正常对照组,以1%DMSO中发育的胚胎为系统对照组,使胚胎在28.5℃下发育,通过倒置光学显微镜和CCD对胚胎几个发育终点进行观察并详细记录,统计胚胎发育全过程的死亡以及畸形数、拍照记录状态,录像以计数心率,并计算LC50。
马兜铃水提液的毒性分析:在与AA同样条件下进行马兜铃水提液的毒性分析。其中,马兜铃水提液组的胚胎发育至48 hpf时将测试液换为培养液,并继续发育至第5天。
1.6 数据分析
应用SPSS19.0统计分析软件进行数据处理,多组数据均值)的方差分析采用Dunnett-t方法,以p<0.05为差异有统计学意义。
2 结果
2.1 马兜铃水提液的液相分析和AA含量计算
马兜铃水提液经HPLC分析(图1)采用外标法计算得马兜铃水提液中AA浓度为84.37μg/mL,即20 g药粉中含有的AA的含量为8.437 mg(0.042%)。

图1 马兜铃水提液的HPLC-UV色谱图
2.2 马兜铃水提液对斑马鱼胚胎发育的致畸和致死作用
用AA含量相等的马兜铃水提液和AA在同样条件下处理斑马鱼胚胎,结果表明,水提液组的胚胎畸形率和死亡率同AA一样呈浓度(图2)和时间依赖性。当水提液中AA的浓度为1μg/mL时胚胎的致畸率为16.7%,而相同浓度的AA组的致畸率为12.0%;当AA浓度达到2μg/mL时,胚胎的畸形及死亡率均加重,水提液组的死亡率为86.7%,而对照品组的死亡率仅为10%;水提液高浓度组(40,80 μg/mL)的胚胎在24 h时全部死亡,而AA同样浓度组直到80 h才死亡。在56 h时,水提液的5,10,20 μg/mL组的斑马鱼胚胎也相继全部死亡。

图2 AA对照品及马兜铃水提液对斑马鱼胚胎的致畸和致死作用(120 hpf)
采用SPSS软件中Prohibit方法进行分析,计算得到马兜铃水提液的 LC50为1.43μg/mL,AA的LC50为 6.06 μg/mL。
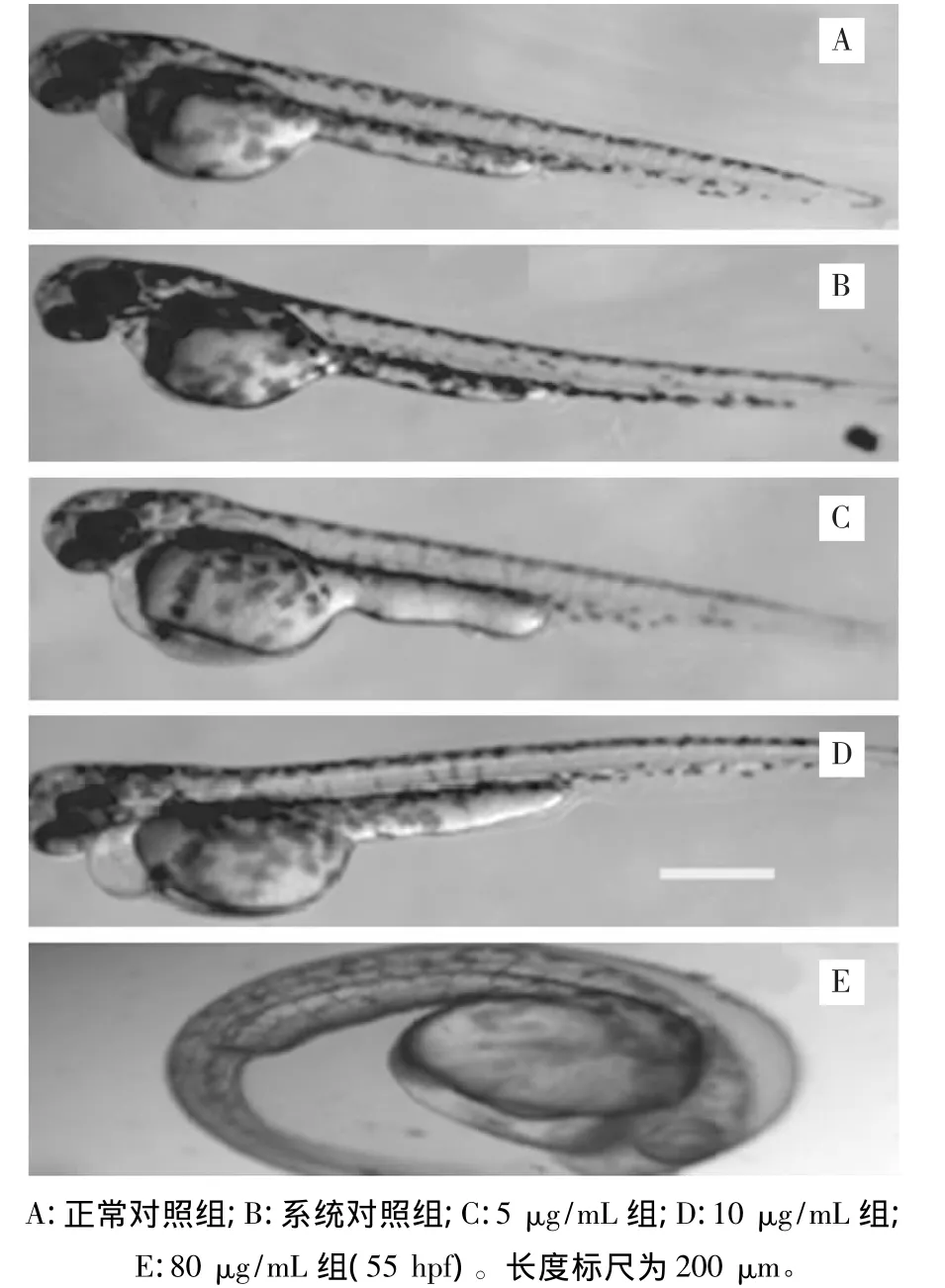
图3 AA处理后胚胎在72 hpf时的畸形表现。
马兜铃水提液和AA对斑马鱼胚胎的致畸毒性表现如下:
(1)胚胎时期:尾部弯曲,卵黄囊(腹部)膨大,腹部出血(图3E)
(2)幼鱼时期:躯干弯曲,围心囊(图3D)和卵黄囊膨大(图3C),心脏变形、缩小(图3D)血循环逐渐衰竭,最后导致死亡。
2.3 马兜铃水提液对斑马鱼胚胎心率的影响
分别在50,56,60,84 hpf录像以计数心率。由图4可以看出在不同的时期,当水提液中AA的浓度达到0.5μg/mL及以上时,胚胎的心率较对照组有明显差异。

图4 不同浓度马兜铃水提液处理后的胚胎在50,56,60,84 hpf时的心率比较
2.4 马兜铃水提液对斑马鱼胚胎的发育抑制作用
马兜铃水提液除了具有致畸,致死和心脏毒性之外,还具有明显的抑制胚胎发育作用。培养液组的胚胎在60 hpf时就全部孵化,而暴露于含0.5 μg/mL和1μg/mL AA的水提液的胚胎在96 hpf才全部孵化,2μg/mL组存活的胚胎到108 hpf才完全孵化,且在84 hpf才开始出现心脏跳动(图4)。
3 讨论
3.1 马兜铃水提液对斑马鱼胚胎的毒性
由马兜铃水提液与AA的结果可以看出,马兜铃水提液的毒性要明显比AA的毒性要强。由于马兜铃酸类不是马兜铃的唯一有毒成分[9],在本研究中水提液明显表现出比AA更强的毒性,那么在许多研究中仅以AA为标志成分来判断含马兜铃酸类中药炮制或配伍后毒性的研究是不完善的。
此外,马兜铃还具有明显的抑制胚胎发育作用。在实验中发现设置同样浓度的马兜铃水提液组的胚胎在实验过程中(6~120 hpf)未出现孵化,无法观察到是否有畸形表型。因此在本研究中马兜铃水提液组的胚胎在接触药液42 h(即48 hpf)后就换为胚胎培养液,培养到120 hpf以观察心脏及致畸表型。
在实验中发现马兜铃水提液在斑马鱼胚胎培养条件下并不稳定,经过HPLC分析后发现,若马兜铃水提液放置时间超过6 h,那么其中主要成分含量变化较大,超过OECD标准中规定允许的±20%[7]的范围,因此在实验中每隔6 h换一次样品液,以保证样品溶液中成分的稳定。
3.2 含马兜铃酸类药物对哺乳类胚胎潜在的致畸作用及心脏毒性
以上结果表明,马兜铃水提液以及AA对斑马鱼胚胎的心脏和发育都产生了明显毒性。由于斑马鱼的神经中枢系统,内脏器官,血液及视觉系统等,在基因水平上87%与人类同源。由于胚胎对外界因素和药物高度敏感,因此,马兜铃有可能也会对哺乳动物的胚胎产生明显毒性。外推到人类,孕妇误服或不正确使用含马兜铃酸的药物,将会导致对胚胎有很大的危险,建议国内同样禁用任何含马兜铃酸的中药,包括马兜铃等仍被中国药典收录的药物。
致谢:感谢中山大学生命科学学院提供野生型斑马鱼(Danio rerio)胚胎,感谢中山大学药学院王军副教授在马兜铃药材鉴定方面提供的帮助。
参考文献:
[1] 许玉琼,尚明英,葛跃伟,等.马兜铃化学成分研究[J].中国中药杂志,2010,35(21):2862 -2864.
[2] Arlt V M,Stiborova M,Schmeiser H H.Aristolochic acid as a probable human cancer hazard in herbal remedies:a review[J].Mutagenesis.2002,17(4):265 -277.
[3] 郭晓昕,程鲁榕.马兜铃酸毒理学性研究与启示[J].中国新药志,2005,14(3):363 -366.
[4] Cui M,Liu Z H,Qiu Q,et al.Tumour induction in rats following exposure to short- term high dose aristolochic acid I[J].Mutagenesis.2005,20(1):45 -49.
[5] Monte W.The zebrafish book a guide for the laboratory use of zebrafish(Dario rerio)[M].Edition 4.Printed by the University of Oregon Press,2000:253.
[6] Charles B K,William W B,Seth R K,et al.Stages of Embryonic Development of the Zebrafish [J].Developmental Dynamics,1995,203(3):253 -310.
[7] OECD.OECD Guideline for the Testing of Chemicals.Draft Proposal for a New Guideline Fish Embryo Toxicity(FET)Test.OECD,Paris.Draft Guideline,2006.
[8] 刘美凤,刘璟,吕浩然,等.马兜铃提取条件的优化以及炮制减毒的研究[J].广州化工,2011,39(9):83 -85.
[9] 李彪,李晓玫,张翠英,等.马兜铃内酰胺I对肾小管上皮细胞的损伤作用[J].中国中药杂志,2004,29(1):78-83.
