不同类型土壤中分枝杆菌噬菌体分离率的比较
2013-12-08徐凤宇苏胜兵马红霞高云航么乃全康元环刘洪岩陆承平刘永杰
徐凤宇,苏胜兵,马红霞,高云航,么乃全,康元环,刘洪岩,周 鹏,陆承平,刘永杰,*
(1. 吉林农业大学动物科技学院,长春 130118;2.吉林农业大学动物生产及产品质量安全教育部重点实验室,长春 130118;3. 南京农业大学动物医学院,南京 210095)
不同类型土壤中分枝杆菌噬菌体分离率的比较
徐凤宇1,2,3,苏胜兵1,2,马红霞1,2,高云航1,2,么乃全1,2,康元环1,2,刘洪岩1,周 鹏1,陆承平3,刘永杰3,*
(1. 吉林农业大学动物科技学院,长春 130118;2.吉林农业大学动物生产及产品质量安全教育部重点实验室,长春 130118;3. 南京农业大学动物医学院,南京 210095)
为了解分枝杆菌噬菌体在自然界的生存环境,深入研究噬菌体在微生态环境中的作用奠定基础。以含柠檬酸和磷酸氢二钠的溶液为提取剂,从50份不同性质土壤中分离、纯化分枝杆菌噬菌体,电镜观察初步确定其分类;统计分析土壤类型、酸碱度、含水量、阳离子交换量、有机碳含量对噬菌体分离率的影响。共分离纯化到13株尾病毒目肌尾病毒科的分枝杆菌噬菌体。3种类型土壤的分枝杆菌噬菌体分离率分别为暗棕壤(41.2%)>黄棕壤(25.0%)>褐土(16.7%);土壤pH值、含水量、阳离子交换量对分离率影响呈规律性:pH值和含水量分别在7.45—7.95和13.7%—21.7%时分离率最高;当阳离子交换量为20.8—28.6 cmol/kg时,分离率随之升高而升高;未见有机碳含量对分离率的影响有明显规律。
分枝杆菌噬菌体;土壤;分离率
噬菌体(bacteriophage)是寄生于细菌、支原体、螺旋体、放线菌等微生物中的一类病毒,亦称细菌病毒,在自然界分布极广,凡有上述微生物的地方,都有相应噬菌体存在。土壤中含耻垢分枝杆菌,推测土壤中也有耻垢分枝杆菌噬菌体。
耻垢分枝杆菌与结核分枝杆菌相比,生长速度快,只需48 h即进入稳定期[1],而且二者细胞壁结构相似,用耻垢分枝杆菌为模式菌代替结核分枝杆菌等致病性分枝杆菌用于科学研究,既安全又方便,但至今国内分离分枝杆菌噬菌体的报道也很罕见。
病毒于土壤中通常以吸附态和游离态两种形式存在,它们可相互转化,并在转化过程中可引起病毒衰减,故迁移和解吸附两种行为是影响土壤中病毒数量的主要因素。鉴于土壤类型、pH值、含水量、有机碳、阳离子交换量(CEC)是影响上述两种行为的主要因素,为研究各因素对土壤中噬菌体存在的影响规律,本研究从不同类型土壤中分离耻垢分枝杆菌噬菌体,并以噬菌体分离率为指标进行了具体分析,为研究分枝杆菌噬菌体在土壤中的生存环境及从中分离其他微生物提供参考,也希望能为土壤微生物学和土壤生态学的研究提供有价值的资料。
1 材料与方法
1.1 供试土壤
50份不同类型供试土壤,分别采自吉林农业大学园艺花卉实习基地植物根部(1—20号)、山西省晋中市榆次区田间或野外植物根部(37—50号)、江苏省南京市南京农业大学及下马坊公园植物根部(21—36号)。所有土样均采自距表层10—15 cm处。
1.2 试验试剂
7H9液体培养基 按BD医疗器械有限公司提供的Middlebrook 7H9肉汤培养基制作方法配制;灭菌前向其中加入1.5%琼脂粉为7H9固体培养基;向其中加入0.7%琼脂粉为7H9半固体培养基。
噬菌体提取剂 称C6H8O7(柠檬酸)和Na2HPO4溶于36 mL蒸馏水,使终浓度分别为5 mmol/L和0.05 mmol/L,高压灭菌后室温保存。
噬菌体保存液(SM液体) ①2%明胶:2 g明胶加蒸馏水100 mL,121 ℃灭菌20 min后室温保存;②1 mol/L Tris-Cl(pH值7.5):Tris 12.11 g加H2O 80 mL,用浓盐酸调节pH值至7.5,再加蒸馏水定容至100 mL;③SM液:NaCl 2.9 g+MgSO4·7H2O 1.0 g+1 mol/L Tris-Cl(pH值7.5)25 mL+2%明胶2.5 mL,加H2O定容至500 mL,121 ℃灭菌20 min后室温保存备用。
1.3 耻垢分枝杆菌培养
将实验室保存的耻垢分枝杆菌(M.smegmatismc2155)划线分离培养48 h,挑取单个菌落于7H9液体培养基中培养,48 h后取菌液接入7H9培养基中培养72 h,置4 ℃备用。
1.4 土壤理化性质测定方法
土壤pH值用pH计(PHS-3C计)测定;土壤含水量和阳离子交换量依次采用采用烘干法和乙酸铵法测定[2];土壤有机碳含量采用重铬酸钾容量法(外加热法)进行测定[3]。
1.5 噬菌体的分离
参照文献[4]从土壤中分离噬菌体的方法进行。
取2 g土壤放入锥形瓶,加2 mL蒸馏水;恒温4 ℃冰箱中孵育1 d,加入噬菌体提取剂36 mL(pH值为9.4),室温、250 r/min振荡30 min,使提取剂与噬菌体充分接触;9 000 r/min离心30 min;0.22 μm微孔滤膜过滤上清液并调节pH值至6.6;将9 mL滤液与10 mL 2倍浓缩7H9液体培养基及1 mL菌液混合,37 ℃ 150 r/min振荡培养48 h;静置10 min,调节pH值至9.4,4 ℃ 10 000 r/min离心30 min,调节上清液pH值至7.3后微孔滤膜过滤,点滴法和双层平板法分别检测滤液中的噬菌体。
1.6 噬菌体的纯化
制备双层平板:取耻垢分枝杆菌72 h培养液0.5 mL与适当稀释的噬菌体原液0.1 mL混匀,室温放置15 min后加入冷却至50 ℃的半固体培养基,混匀后立即倒入制备好的固体7H9培养基上,待琼脂凝固后,37 ℃倒置培养36 h,观察噬菌斑。
纯化:用灭菌牙签挑取形态大小一致、单个独立的典型噬菌斑,置于盛有1 mL SM液的EP管中,室温放置1 h后4 ℃过夜,次日经旋涡振荡器振荡数秒后取0.1 mL经适当稀释,重复以上操作制备双层平板纯化。重复此步骤3—5次,当每次观察到的噬菌斑大小和形态均匀一致时,即得到纯化的噬菌体。
1.7 噬菌体的电镜观察
取适当稀释的噬菌体,经双层平板培养形成噬菌斑网络后,加入SM液,4 ℃振荡过夜,洗下噬菌体,11 000 r/min离心30 min,取上清液过滤,用2%磷钨酸染色1.5 min,透射电镜观察噬菌体形态、大小。
1.8 计算分离率
分离率=噬菌体分离阳性的土壤样本数/样本容量×100%
2 结果与分析
2.1 土壤理化性质测定
经测定,所采集的50份土壤样本的类型、部分理化性质结果如表1。
2.2 噬菌体分离
采用点滴法和双层平板法(图1)分别检测噬菌体,检测结果显示:用点滴法检测时,有时会出现直径稍小的透明圈的假阳性现象,但用双层平板检测为阴性。说明双层平板法的检测效果好于点滴法。因此本研究以双层平板法检测结果为准,显示暗棕壤组有7个样本分离呈阳性,分别是2、4、6、7、12、15、17号样本;黄棕壤组有4个样本为分离阳性,分别是22、24、26、31号样本;褐土组有2个样本为分离阳性,分别是48、50号样本,棕壤和黑垆土两组中无阳性样本。
2.3 噬菌体纯化
采用双层平板法反复纯化5次得到13株噬菌体,并将它们分别命名为:CJAUS 6—18。
2.4 噬菌体的电镜观察
在透射电镜下观察噬菌体的形态,所有分离株均为肌尾噬菌体,但大小略有差异(表2)。CJAUS12的形态、大小见图2。

表1 供试土壤的类型及理化性质
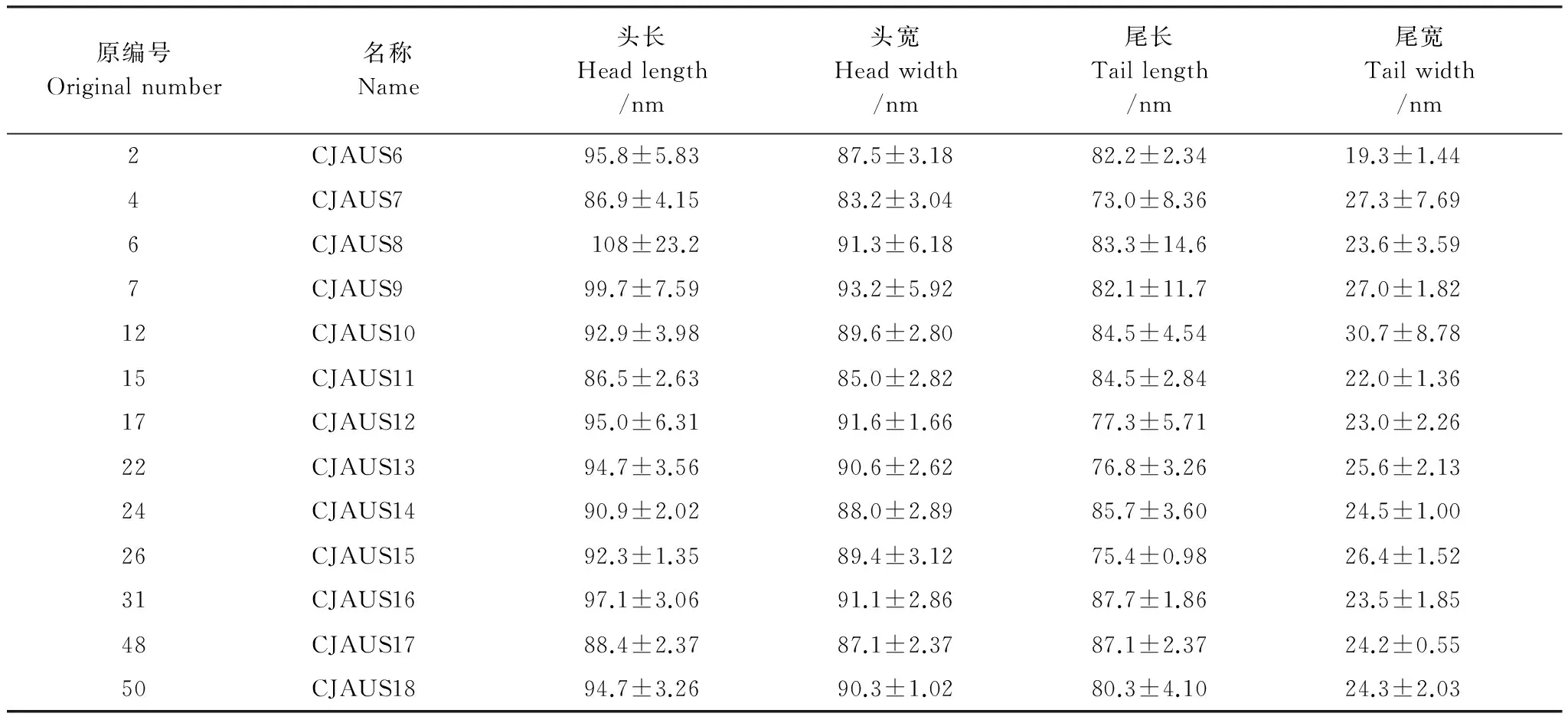
表2 电镜下噬菌体的大小

图1 双层平板法检测CJAUS10的结果Fig.1 Plaque of CJAUTES10 detected by using double-floor method

图2 电镜下的CJAUS12噬菌体Fig.2 Morphology of phage CJAUS12
2.5 分离率的计算及比较
2.5.1 不同类型土壤分离率
暗棕壤组的分离率=7/17×100%=41.2%
黄棕壤组的分离率=4/16×100%=25.0%
褐土组的分离率=2/12×100%=16.7%
由本试验结果可知,暗棕壤组的分离率最高,褐土组的分离率最低,推测分枝杆菌噬菌体在暗棕壤中存活率最高。
2.5.2 分离率与土壤理化性质的关系分析
由表1中可知50份土壤样本的pH值,最低为3.45,最高为10.2。分离阳性样本主要集中在5.95—8.95之间,由于5.95—6.45组中只有一个样本,其分离率偶然性较高,故只对其他5组的分离率与土壤pH值的关系进行分析。结果如图3,pH 7.45—7.95组的分离率最高(60%),低于此区间时,分离率随pH值的升高而升高,相反,高于此区间时随pH值的升高而降低。

图3 分离率与土壤pH值、含水量的关系Fig.3 The relationship between pH/moisture content of soil and isolating rate
测定所有土壤样本的含水量,最低为10.7%,最高为21.6%;阳性样本主要集中于13.7%—21.7%间;对分离率分析结果显示:18.7%—19.7%组的分离率最高(66.7%),并以此为峰值,峰前随含水量的升高而升高,峰后随含水量的升高而降低(图3)。
所有供试土壤样本的有机碳含量最低为11.3 g/kg,最高为104.8 g/kg(图4)所示;分离阳性样本主要集中在21.3 g/kg—61.3 g/kg之间,噬菌体分离率随有机碳的变化规律不明显;如果排除偶然的因素(即去掉样本总数较少的组:51.3 g/kg—56.3 g/kg和56.3 g/kg—61.3 g/kg,则分离率随有机碳含量的升高有依次递增的趋势。
所测样本的最低CEC为18.2 cmol/kg,最高为31.8 cmol/kg;分离阳性样本主要集中在20.8—28.6 cmol/kg之间,在此区间内,分离率随CEC的升高而呈逐渐上升的趋势(图4)。

图4 分离率与有机碳、土壤CEC的关系Fig.4 The relationship between organic matter/CEC of soil and isolating rate
3 讨论
不考虑分离方法对分离率的影响[4],土壤中含分枝杆菌活噬菌体是成功分离的前提条件,且其中活噬菌体数量决定着分离率高低。本研究从中国境内3个省份随机取50个土壤样本,经土壤类型鉴定和噬菌体分离试验发现暗棕壤组的分离率较黄棕壤组和褐土组高,这可能与以下3方面因素有关:①与黄棕壤和褐土相比,暗棕壤的有机碳含量相对较高,从而减少了微生物之间的代谢竞争[5],有利于噬菌体的增殖;②由于气候不同,淋溶和风化作用对褐土和黄棕壤表层微生物的生存环境影响较大,进而影响表层活噬菌体的数量,从而影响噬菌体的分离率,而暗棕壤则较少受到这种影响;③本研究的暗棕壤来源于花卉实习基地,环境小气候也在一定程度上影响了分离率。
对分离率随土壤pH值的变化规律分析后可知:pH值在6.45—8.95时,随pH值的增大,噬菌体分离率先升高后降低,并于7.45—7.95之间最大,可能是该类噬菌体的pI值位于7.45—7.95之间的缘故,当环境pH值 微生物密度和活性往往在高度充满降水和水流的地表和地下环境中较高,而且分化后的地表矿石组分和有机质的丰富程度可以通过微生物的更高和更一致的数量和行为分布得到反映[5]。因此土壤含水量和有机碳含量对土壤中噬菌体的生存也有影响。图3显示:含水量为18.7%—19.7%时分离率最高(66.7%),这可能是因为长时间含水量超过19.7%时,宿主菌所需营养成分逐渐向地下迁移或流失,限制了宿主菌活动,而含水量低的土壤又因不能满足微生物代谢活动时对水分的需要,影响噬菌体的分离。虽有资料显示,含水量在40%以内,细菌总量随含水量的降低而降低[8],但笔者认为土壤含水量对细菌的影响因细菌的种类而异。另外,一定范围内,含水量高的土壤还可降低病毒进入气-水界面的机会,从而降低病毒的死亡率[9- 10],进而保护噬菌体的活力和数量,有利于病毒的分离,笔者认为这可能是含水量<18.7%时分离率随含水量升高而提高的原因所在。理论上土壤有机碳为宿主菌提供了所需碳源,可增加分枝杆菌噬菌体的数量,且高有机碳含量会增强病毒与土壤颗粒的解吸[11],因此,选用有机碳含量高的土壤可提高噬菌体的分离率。虽然本研究对分离率水平和有机碳含量的关系分析表明分离率随有机碳增加(减少)并无明显变化规律(图4),有悖于前述规律,但有资料表明有机碳含量对病毒吸附的影响并不一致[12- 14],需综合考虑土壤类型、病毒类型、有机质特性[15],故此结果可能是土壤类型及其理化性质等综合因素造成的。 CEC主要通过改变土壤溶液的浓度和阴、阳离子组成两个途径影响土壤对噬菌体的吸附[16]。二者与土壤对病毒的吸附都成正比例关系,也可以说从CEC含量高的土壤中分离到分枝杆菌噬菌体的概率相对较高,但这只局限于某一范围内。如图4所示:本研究中阳性样本只出现在20.8—28.6cmol/kg之间,在此范围内,分离率随CEC的升高而升高。 [1] Shang Z L. Study on the Function ofRv1246c-Rv1247cGene ofM.tuberculosisinM.smegmatisand the Interaction between the Coding Proteins [D]. Chengdu: Sichuan University, 2007. [2] Lu R K. The Analysis Method of Soil Agricultural Chemistry. Beijing: China Agricultural Press, 2000: 22- 25, 289- 290. [3] Lao J C. Analysis Handbook of Soil Agricultural Chemistry. Beijing: Agricultural Press, 1988: 234- 237. [4] Zhang H, Zhao B Z, Zhang J B. Soil virus recovery efficiency of various methods. Acta Pedologica Sinica, 2008, 45(3): 452- 458. [5] Maier R M, Pepper I L, Gerba C P. Environmental Microbiology//Zhang J Y, Song B Y, Zheng L S, Translation. Beijing: Science Technology Press: 97- 99. [6] Dowd S E, Pillai S D, Wang S, Corapcioglu M Y. Delineating the specific influence of virus isoelectric point and size on virus adsorption and transport through sandy soils. Applied Environmental Microbiology, 1998, 64(2): 405- 410. [7] Goyal S M, Gerba C P. Comparative adsorption of human enteroviruses, simian rotavirus, and selected bacteriophages to soils. Applied and Environmental Microbiology, 1979, 38(2): 241- 247. [8] Fu H L, Wang S R, Han S J, Zhang J H, Zhang H H, Dai G H. Influence of wet/dry cycle on soil microbial activity and community flora in broadleaved Korean pine forest in Changbai mountains. Journal of Northeast Forestry University, 2009,39(7): 80- 81, 86- 86. [9] Jin Y, Chu Y J, Li Y S. Virus removal and transport in saturated and unsaturated sand columns. Journal of Contaminant Hydrology, 2000, 43(2): 111- 128. [10] Chu Y J, Jin Y, Flury M, Yates M V. Mechanisms of virus removal during transport in unsaturated porous media. Water Resources Research, 2001, 37(2): 253- 263. [11] Burge W D, Enkiri N K. Adsorption kinetics of bacteriophageφX-174 on soil. Journal of Environmental Quality, 1978, 7: 536- 542. [12] Mooer R S, Taylor D H, Struman L S, Reddy M M, Fuhs G W. Poliovirus adsorption by 34 minerals and soils. Applied and Environmental Microbiology, 1981, 42(6): 963- 975. [13] Shimizu Y, Sogabe H, Terashima Y. The effects of colloidal humic substances on the movement of non-ionic hydrophobic organic contaminants in groundwater. Water Science and Technology, 1998, 38(7): 159- 167. [14] Bales R C, Li S M, Maguire K M, Yahya M T, Gerba C P. MS- 2 and poliovirus transport in porous media: hydrophobic effects and chemical perturbations. Water Resources Research, 1993, 29(4): 957- 963. [15] Schijven J F, Hassanizadeh S M. Removal of viruses by soil passage: overview of modeling, processes, and parameters. Critical Reviews in Environmental Science and Technology, 2000, 30(1): 49- 127. [16] Wang Q Y. Adsorptive Behavior of Viruses to Soils and Its Significance in the Environment [D]. Nanjing: Nanjing Agricultural University, 2006. 参考文献: [1] 商正玲. 结核Rv1246c_Rv1247c基因重组耻垢分枝杆菌及其编码蛋白功能的初步研究 [D]. 成都: 四川大学, 2007. [2] 鲁如坤. 土壤农业化学分析方法. 北京: 中国农业科技出版社, 2000: 22- 26, 289- 290. [3] 劳家柽. 土壤农化分析手册. 北京: 农业出版社, 1988: 234- 237. [4] 张辉, 赵炳梓, 张佳宝. 不同提取方法对土壤中病毒回收率的比较. 土壤学报, 2008, 45(3): 452- 458. [5] 梅尔, 佩珀, 格巴. 环境微生物学//张甲耀, 宋碧玉, 郑连爽, 译. 北京: 科技出版社, 97- 99. [8] 富宏霖, 王生荣, 韩士杰, 张军辉, 张宏浩, 戴冠华. 土壤干湿交替对长白山阔叶红松林土壤微生物活性与区系的影响. 东北农业大学学报, 2009, 39(7): 80- 81, 86- 86. [16] 王秋英. 土壤中病毒的吸附行为及其环境效应 [D]. 南京: 南京农业大学, 2006. Comparisonofisolationrateofmycobacteriophageinthedifferenttypesoils XU Fengyu1,2,3,SU Shengbing1,2, MA Hongxia1,2, GAO Yunhang1,2, YAO Naiquan1,2, KANG Yuanhuan1,2, LIU Hongyan1, ZHOU Peng1, LU Chengping3, LIU Yongjie3,* 1CollegeofAnimalScienceandTechnology,JilinAgriculturalUniversity,Changchun130118,China2KeyLaboratoryofAnimalProduction,ProductQualityandSecurity,MinistryofEducationofthePeople′sRepublicofChina,JilinAgriculturalUniversity,Changchun130118,China3CollegeofVeterinaryMedicine,NanjingAgriculturalUniversity,Nanjing210095,China Phages are abundant and ubiquitous in nature, and are therefore important components of microbial communities. The investigation on the survival environment of bacteriophage in the nature might lay a foundation for the further study on regulating function of phage in the microecological environment. To understand the ecology of mycobacteriophage, we collected different types of soil samples from three areas in China to determine the isolation rates of phages and analyzed the relationship between isolation rates and four affecting factors in this study. The mycobacteriophages were isolated from 50 soil samples with mixed lyosol of citric acid and disodium hydrogen phosphate dodecahydrate as extractant. The isolation result was detected by the double agar method and dipping method. At the same time, pH value, moisture, organic carbon level and cation exchange capacity of samples were measured. Thirteen strains of mycobacteriophages were isolated and named from CJAUS6 to CJAUS18. The morphological observation under the transmission electron microscope showed that, all the isolates have a regular icosohedron head [(86.5±5.83—108±23.2)nm ×(83.2±3.04—93.2±5.92)nm ] and a contract tail [(73.0±8.36—87.7±1.86)nm ×(19.3±1.44—30.7±8.78)nm]. So they can be classified as a member of the orderCaudoviralesand the familyMyoviridae. The isolation results from five types of soils indicated that the isolation rate (41.2%) from dark brown earth was highest, followed by yellow brown earth (25.0%) and drab soil (16.7%), while no phages were isolated from the heilu soil and brown earth samples. The reason might relate to three factors as follows: firstly, the organic carbon level is the most in the dark brown earth; secondly, the influence of weathering and eluviatin on dark brown soil is weaker than that on yellow brown earth and drab soil; thirdly, the dark brown earth in this paper was affected by microclimate. In order to know the relationship between the isolation rate and affecting factors, the two-dimentional coordinates graphs were drawn by means of Microsoft Office Excel Software. The result showed that the isolation rate was the highest when the pH value was between 7.45 and 7.95, and moisture was between 13.7% and 21.7%, and the curve of their relationship was expressed as a same inverted "V" form. When the cation exchange capacity was between 20.8cmol/kg and 28.6cmol/kg, the isolation rate had a positive proportion with cation exchange capacity. It is supposed that the way in which cation exchange capacity affects isolation rate might attribute to the change of concentration and composition of anions and cations in the soil solution. And we found the concentration and composition of anions and cations is proportional to the adsorption quantity of phages. There was no obvious correlation between the isolating rate and organic carbon capacity. The results indicated that the soils types and physical and chemical properties of soils might contribute to the isolation rates of mycobacteriophage. Further work will be performed on the relationships between bacteriophage pI and soil pH values, and between water content in soil and the titres of host bacteria. mycobacteriophage; soil; isolation rate 2012- 04- 28; 2012- 09- 11 *通讯作者Corresponding author.E-mail: 10.5846/stxb201204280612 徐凤宇,苏胜兵,马红霞,高云航,么乃全,康元环,刘洪岩,周鹏,陆承平,刘永杰.不同类型土壤中分枝杆菌噬菌体分离率的比较.生态学报,2013,33(15):4616- 4622. Xu F Y,Su S B, Ma H X, Gao Y H, Yao N Q, Kang Y H, Liu H Y, Zhou P, Lu C P, Liu Y J.Comparison of isolation rate of mycobacteriophage in the different type soils.Acta Ecologica Sinica,2013,33(15):4616- 4622.
