大鲵胃蛋白酶分离纯化及其性质的研究
2013-12-08佟长青
成 芳,闫 欣,李 伟,2,*,曲 敏,佟长青,金 桥
(1.辽宁省水产品加工及综合利用重点开放实验室,大连海洋大学食品工程学院,辽宁大连116023;2.张家界(中国)金驰大鲵生物科技有限公司,湖南张家界427400)
中国大鲵(Andrias davidianusBlanchard),它的叫声像幼儿哭声,因此人们又叫它“娃娃鱼”。属两栖纲、有尾目、隐鳃鲵科,是我国特有的大型珍稀两栖动物[1]。主要分布于长江中上游、珠江中上游及汉水上游的溪流中[2]。大鲵的消化功能十分强大,有很强的耐饥本领,甚至二、三年不吃也不会饿死;它同时也能暴食,饱餐一顿可增加体重的五分之一。随着人工养殖技术的发展,大鲵的开发利用受到越来越多的关注[3]。由于大鲵肉味鲜美,营养价值高[4],所以逐渐成为餐桌上的美味佳肴,而内脏则被丢弃。本实验通过对大鲵胃蛋白酶的相关研究为大鲵内脏的合理回收利用提供理论基础。
1 材料与方法
1.1 材料与仪器
大鲵胃 2011年10月由张家界(中国)金驰大鲵生物科技有限公司提供;Cellulose DE-52、Sephadex G-100 Sigma公司;牛血清蛋白 北京奥博星生物技术有限责任公司。
核酸蛋白检测仪 上海康华生化仪器制造有限公司;XWT-S系列小型台式记录仪 上海自动化仪表股份有限公司;FD-1冷冻干燥机 上海博通经贸有限公司;高效液相色谱仪 大连伊利特分析仪器有限公司;UV-754型紫外可见分光光度计 上海第三分析仪器厂;GL-21M高速冷冻离心机 长沙湘仪离心机仪器有限公司。
1.2 实验方法
1.2.1 粗酶液的制备 将大鲵内脏用蒸馏水洗净,滤纸吸去水分称重,先用剪刀剪碎再用组织捣碎机捣碎,按 1∶5的比例加入磷酸缓冲液(pH7.4,0.01mol/L),浸泡 4h。离心(9000r/min,4℃)30min取上清液,去沉淀,量筒量体积。用80%硫酸铵沉淀,置于冰箱过夜(4℃)。离心(9000r/min,4℃)30min去上清,收集沉淀,2~3mL磷酸缓冲液溶解沉淀,透析,得到粗酶液。
1.2.2 DEAE-52阴离子交换层析 DEAE-52阴离子交换层析柱按产品说明书要求进行处理,装柱(2.5cm×13cm)后,用4倍柱床体积(200mL)的蒸馏水平衡,上样量为4mL。用1mol/L NaCl溶液进行线性梯度洗脱,流速为2mL/min,3mL/管,紫外检测波长为280nm。测定各管的紫外吸收值和酶活力。收集酶活性较高的各管酶液,透析、冷冻干燥,进行下一步纯化。
1.2.3 Sephadex G-100凝胶过滤层析 Sephadex G-100凝胶过滤层析柱按产品说明书要求进行处理,装柱(2.5cm×100cm)后,用KCl-HCl缓冲液(pH2,0.01mol/L)平衡柱床,上样量为10mL。用上述缓冲液进行洗脱,流速为3mL/min,3mL/管,紫外检测波长为280nm。测定各管的紫外吸收值和酶活力。收集酶活性较高的各管酶液,透析、冷冻干燥,进行下一步纯化。
1.2.4 HPLC色谱层析 将Sephadex G-100凝胶过滤层析收集得到的活性组分溶于柠檬酸酸缓冲液(Na2HPO4-柠檬酸,0.2mol/L,pH4.0)中,用 0.45μm的微孔滤膜过滤。取20μL上样进行纯化。色谱柱:TSK凝胶色谱柱G4000PWXL(4.6mm×300mm),柱温为室温,流动相为Na2HPO4-柠檬酸缓冲液(0.2mol/L,pH4.0);280nm下紫外检测。按酶活力测定方法测定,透析,冷冻干燥,得到蛋白酶纯品。
1.2.5 胃蛋白酶活力的测定 采用分光光度法,对其稍作修改:取1%酪蛋白1mL加3.9mL KCl-HCl缓冲液(p H2.0,0.01mol/L)于40℃恒温水浴预热5min,加入胃蛋白酶液0.1mL反应30min,加入0.5mL 10%TCA(三氯乙酸)终止反应。离心(9000r/min,10min),取上清测OD280。对照样是1mL,1%酪蛋白加4mL同样的缓冲液,40℃恒温水浴预热5min,不加酶液,反应30min,加入0.5mL 10%TCA(三氯乙酸)终止反应。离心(9000r/min,10min)。
蛋白酶活力单位为:1mL酶液,在此条件下,每分钟增加0.001个OD值为一个酶活力单位,以U/mL表示[5]。
1.2.6 蛋白质含量测定 按Lowry法[6]进行测定,以牛血清白蛋白为标准样品。
1.2.7 胃蛋白酶相对分子量的测定 用SDS-PAGE测定其分子量[7]。
1.2.8 温度和p H对酶活力及其稳定性的影响 取0.1mL酶液分别在5~60℃反应,按酶活力测定方法测其OD280。确定其最适温度。
0.1mL酶液分别在 5~60℃保温 30min后,在40℃反应30min,加入TCA终止反应。测OD280,以观察温度对酶活力稳定性的影响。
取0.1mL酶液分别在pH1~6的缓冲液中反应,按酶活力测定方法测其OD280,p H1~2是KCl-HCl缓冲液,pH3是 Na2HPO4-柠檬酸缓冲液,pH4~5是HAc-NaAc缓冲液,pH6是Na2HPO4-NaH2PO4缓冲液。确定其最适pH。
0.1mL酶液分别在 pH1~6的缓冲液中保温30min后,在40℃反应30min,加入 TCA终止反应。测OD280,以观察p H对酶活力稳定性的影响。
1.2.9 胃蛋白酶的动力学测定 分别配制不同质量浓度1.0 ×104、5.0 × 103、2.5 × 103、1.66 × 103、1.25 ×103、1.0 ×103、8.3 ×102、7.14 ×102mg/L 的酪蛋白为底物,在40℃,pH2的条件下按酶活力测定方法测其OD280。用双倒数作图法作图[8]。
1.2.10 金属离子、EDTA和化学试剂对蛋白酶活力影响测定 在缓冲液中分别加入5、10mmol/L的Ca2+、Zn2+、Cu2+、Mg2+、Ba2+、Li+、Mn2+、EDTA,以及0~100μmol/L的 BrAc和 0~10μmol/L NBS 抑制剂。按测酶活力的方法测其OD280,观察金属离子,EDTA和化学试剂对蛋白酶活力的影响。
2 结果与分析
2.1 胃蛋白酶的分离纯化
粗酶液经DEAE-52离子交换层析,NaCl梯度洗脱,得到层析液,测OD280,结果如图1所示,有两个蛋白峰。对其进行酶活力检测,第二个蛋白峰有酶活力,收集样品并透析,冻干。之后经过Sephadex G-100凝胶过滤层析,对每一个层析管测定OD280,结果如图2所示,有两个蛋白峰。对其进行酶活力检测,都有蛋白酶活力,且第二个蛋白峰的活力大于第一个蛋白峰。收集第二个蛋白峰,透析,冷冻干燥。

图1 大鲵胃蛋白酶DEAE-52阴离子交换层析柱层析Fig.1 Ion exchange chromatography of crude pepsin from Andrias davidianus on DEAE-52
将得到的样品用高效液相TSK凝胶色谱住(G4000PWXL)进行纯化。结果如图3所示,所得到的蛋白峰为单一对称层析峰,这表明所提取的蛋白较纯。采用酶活力检测方法检测到该蛋白峰有活力,收集此峰,透析并冻干。经SDS-PAGE电泳,显示为一条蛋白带,说明该蛋白酶样品已经达到电泳纯,整个酶的分离纯化结果如表1。
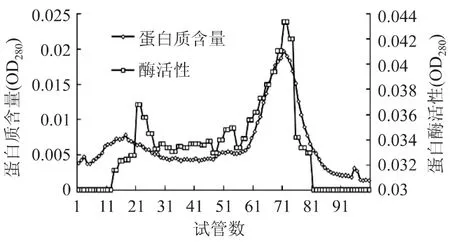
图2 大鲵胃蛋白酶Sephadex G-100分子筛凝胶层析Fig.2 Gel filtration chromatography of pepsin from Andrias davidianus on Sephadex G-100
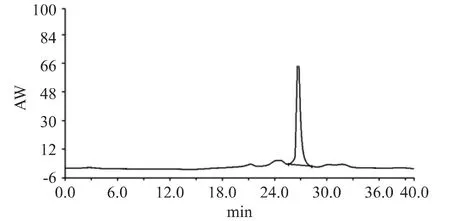
图3 高效液相色谱Fig.3 Spectrum of HPLC

表1 大鲵胃蛋白酶的分离结果Table 1 Purification results of pepsin from Andrias davidianus
2.2 胃蛋白酶相对分子量
通过SDS-PAGE对经HPLC后收集的胃蛋白酶分子量进行测定。所得结果如图4所示,加入β-巯基乙醇和不加入β-巯基乙醇的情况下均表现为一相对分子量为31ku(数据未在图上显示)。β-巯基乙醇可以打开-S-S-连接的蛋白质亚基,所以大鲵胃蛋白酶不含有-S-S-连接的亚基。

图4 胃蛋白酶SDS-PAGE电泳Fig.4 SDS-PAGE of pepsin
2.3 温度和pH对酶活力及其稳定性的影响
测定在5~60℃范围内温度对酶活力及其稳定性的影响,以反应条件为 pH2,40℃下测得的活性为100%。结果如图5所示,温度在20~40℃活性较高,最适温度是40℃;在5~40℃酶活力相对稳定,高于40℃酶活力开始下降,60℃时相对酶活性少于20%。

图5 温度对胃蛋白酶活力和稳定性的影响Fig.5 Effect of temperature on the enzyme activity and stability of pepsin
在p H1~6时测定p H对酶活力及其稳定性的影响,以反应条件为pH2,40℃下测得的活性为100%。结果如图6所示,pH在2时活性最高,是最适p H。在p H2~6时酶活力相对稳定,pH1,酶活力下降为60%。
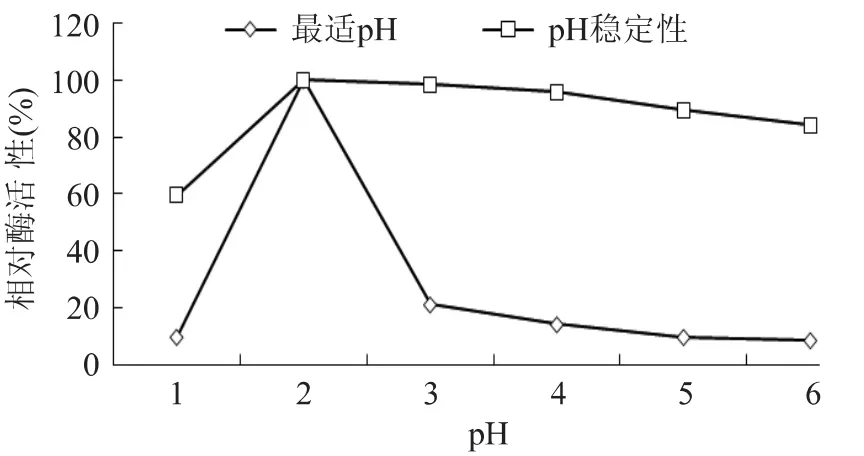
图6 pH对胃蛋白酶活力和稳定性的影响Fig.6 Effect of pH on the enzyme activity and stability of pepsin
2.4 胃蛋白酶的动力学
通过测定不同底物浓度下的反应速度,可以确定酶催化反应的最大速度Vmax和米氏常数Km。采用双倒数作图法(Lineweaver-Burk法),以1/V为纵坐标,1/[S]为横坐标作图。如图7所示,分别得出最大反应速度Vmax和米氏常数Km。Vmax=2.674μg/min,Km=7.3×103mg/L。

图7 Lineweaver-Burk图Fig.7 Lineweaver-Burk
2.5 金属离子、EDTA和化学试剂对蛋白酶活力影响测定
分别研究不同浓度的 Ca2+、Zn2+、Cu2+、Mg2+、Ba2+、Li+、Mn2+、EDTA 以及化学试剂对蛋白酶活力的影响。
测定不同浓度金属离子对酶活力的影响,结果如表2所示,Li+对酶有轻微的抑制作用,Mn2+、Ca2+、Zn2+、Mg2+、Ba2+、Cu2+对酶活力无影响。EDTA 对酶活力有很强的抑制作用。
如图8~图9所示,BrAc的浓度范围为0~80μmol/L时,酶活力缓慢下降,当浓度达到100μmol/L时,酶活性仅剩 9.6%;NBS浓度大于8μmol/L时,酶活性急剧下降。

表2 金属离子和EDTA对胃蛋白酶活力的影响Table 2 Effect of mental ion and EDTA on activities of pepsin

图8 BrAc对胃蛋白酶的抑制作用Fig.8 Inhibition of BrAc on pepsin activity
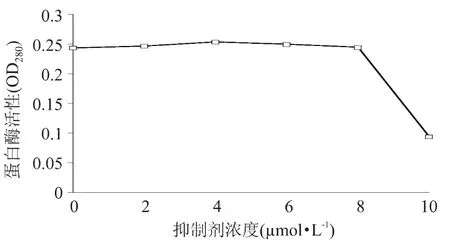
图9 NBS对胃蛋白酶的抑制作用Fig.9 Inhibition of NBSon pepsin activity
3 讨论与结论
3.1 从大鲵胃中提取的胃蛋白酶经四个步骤完成分离纯化。粗酶液经盐析法(饱和度80%的(NH4)2SO4沉淀)获得粗蛋白,将粗蛋白经过DEAE-52离子交换层析及Sephadex G-100凝胶过滤层析得到胃蛋白酶,总活力为79.06U,比活力为247.07U/mg,回收率为4.4%,纯化倍数为239.87。将胃蛋白酶经HPLC进一步纯化,收集到的样品经SDS-PAGE凝胶电泳测定胃蛋白酶分子量约为31ku。在童耕雷[9]所说的胃蛋白酶相对分子量31~36ku的范围内。
3.2 胃蛋白酶是一种酸性蛋白酶,在酸性环境中,它的稳定性较好,它的最适p H是2,与王璋主[10]著作中所讲的相一致。本实验中大鲵胃蛋白酶的最适温度是40℃,与吴燕燕等[11]的罗非鱼肠蛋白酶和李大志等[12]的虾夷马粪海胆蛋白酶的最适温度相似。
3.3 在 pH2,40℃,大 鲵 胃 蛋 白 酶 的 Km为7.3 ×103mg/L,Vmax为 2.674μg/min,Km偏大,与底物的亲和力不强。可能大鲵的主要食物来源中酪蛋白含量较少。EDTA对大鲵胃蛋白酶有很强的抑制作用,表明大鲵胃蛋白酶有可能是金属蛋白酶。Sitthipong等[13]研究的金枪鱼中,EDTA 对金枪鱼的胃蛋白酶影响不大。
3.4 NBS能较专一的修饰蛋白质的色氨酸残基(Trp)[14]。用不同浓度的NBS对酶进行化学修饰,得知在NBS的浓度为2~8μmol/L时,酶活力不受影响,当浓度为10μmol/L时,酶活性急剧下降。可见,大鲵胃蛋白酶酶活性中心基团含有色氨酸。BrAc能较专一的修饰蛋白质的组氨酸残基。当BrAc的浓度范围为20~80μmol/L时,酶活力缓慢下降,当浓度为100μmol/L时,酶活性剩余9.6%,几乎失活。说明组氨酸是酶活性必需基团之一。通过上述这些研究,得到了一些大鲵胃蛋白酶的性质,但还不足以解释大鲵具有耐饥本领的原因,还需要日后深入研究。
[1]叶昌媛,费梁,胡淑琴.中国珍稀及经济两栖动物[M].成都:四川科学技术出版社,1993:64-69.
[2]李伟,于新莹,佟长青,等.大鲵粘液酶解产物的制备及其抗疲劳作用研究[J].食品工业科技,2011,32(6):146-148.
[3]马小燕,陈易彬,李彦军.酶法水解大鲵蛋白的工艺研究[J].中国酿造,2009,11:92-95.
[4]艾为明,陈少波,曾国权,等.人工模拟生态养殖子二代大鲵肌肉营养成分分析[J].水生态学杂志,2008,1(2):120-123.
[5]B.施特尔马赫.酶的测定手册[M].北京:中国轻工业出版社,1992:253-254.
[6]Lowry D H.Protein measurement with the Folin Phenol reagent[J].JBiol Chem,1951,193:267.
[7]杨安钢.生物化学与分子生物学实验技术[M].北京:高等教育出版社,2001:248-252.
[8]罗九甫.酶与酶工程[M].上海:上海交通大学出版社,1996:262-280.
[9]童耕雷.使用生物化学与分子生物学词典[M].科学出版社,2003:588-589.
[10]王璋主 .食品酶学[M].中国轻工业出版社,1997:188-191.
[11]吴燕燕,李来好,郝志明,等.罗非鱼肠蛋白酶的分离纯化及其性质[J].水产学报,2010,34(3):357-365.
[12]李大志,李大成,童圣英,等.虾夷马粪海胆蛋白酶性质研究[J].辽宁师范大学学报,2002,25(3):301-304.
[13]Sitthipong N,Soottawat B,Hideki K.Biochemical properties of pepsinogen and pepsin from the stomach of albacore tuna(Thunnua alalunga)[J].Food Chemistry,2010,121(1):49-55.
[14]樊少华,吴珍红,缪晓青.中华蜜蜂工蜂碱性磷酸酶功能基团的研究[J].中国蜂业,2006,57(7):7-9.
