不同品种蜂花粉总黄酮含量与抗氧化活性相关性的研究
2013-12-08陈南迪方妙玉吴锡鸿段倩倩
陈南迪,方妙玉,吴锡鸿,段倩倩,林 励
(广州中医药大学中药学院,广东广州510006)
蜂花粉为蜜蜂采集的有花植物的雄性生殖细胞[1],主要成分为蛋白质、糖、氨基酸、维生素、多种常量和微量元素、黄酮类物质等[2-3],因富含黄酮类化合物,常具有抗疲劳、增强体力、增强记忆力等作用[4]。目前蜂花粉总黄酮提取工艺及抗氧化活性研究的报道较多,冉林武[5]等通过响应面实验优化超声波法提取枸杞蜂花粉黄酮化合物;张红城[6]等对6种蜂花粉进行了多酚和黄酮类物质含量测定及抗氧化活性研究,报道蜂花粉具有较强的DPPH自由基清除能力以及还原能力。蜂花粉的品种不同,其所含成分、抗氧化能力有一定的差异,黄酮类成分已被认为是蜂花粉抗氧化作用的重要物质基础[7]。目前常用抗氧化活性实验方法有高锰酸钾氧化法、磷钼酸法、DPPH自由基清除测定法、羟基自由基清除率测定法等,其机制均不相同,阐明总黄酮含量与不同机制抗氧化活性实验结果的相关性,就可能逐步揭示蜂花粉抗氧化作用的机制。为此,本研究以18种蜂花粉为材料,测定其总黄酮含量,并对总黄酮与不同机制抗氧化活性实验结果进行相关性分析,以期为蜂花粉抗氧化作用机制的阐明提供实验依据。
1 材料与方法
1.1 材料与仪器
蜂花粉 食品级,经广州中医药大学中药鉴定教研室黄海波副教授鉴定为蜂花粉,65℃恒温烘干磨成细粉,过80目筛,置于干燥器中备用,采集样品见表1;芦丁对照品 国家药检所08-9715;2,2-联苯基-1-苦基肼基(DPPH,纯度96%)Sigma公司;高锰酸钾、磷钼酸、硫酸、草酸钠、无水乙醇、氢氧化钠、亚硝酸钠、硝酸铝均为分析纯。
BP211D型电子分析天平德国Sartorius公司,感量0.01mg;8453E型紫外可见分光光度计美国Agilent;KQ-500型超声仪(40kHz,500W)昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 蜂花粉总黄酮含量的测定

表1 样品编号Table 1 Sample list
1.2.1.1 对照品溶液制备 精密称取芦丁对照品5mg,置于25mL量瓶,以74%乙醇定容至刻度,制成浓度为0.200mg/mL的对照品溶液。
1.2.1.2 供试品溶液制备 精密称取备用蜂花粉粉末约1.000g,置具塞锥形瓶中,加74%乙醇39mL,超声提取(500W,25℃)45min,抽滤,以74%乙醇定容至50mL作为待测液。
1.2.1.3 标准曲线制备 精密移取芦丁对照品溶液0、1、2、3、4、5、6mL 于 25mL 量瓶,加入 5% 的 NaNO21mL,摇匀,6min后加入10%的Al(NO3)31mL,摇匀,6min后再加入4%的NaOH 10mL,以74%乙醇定容至刻度,摇匀。5min后,在510nm测定吸光度A,计算得芦丁浓度Y(mg/mL)与吸光度A的回归方程,根据回归方程可计算蜂花粉总黄酮含量。
1.2.1.4 方法学考察 对其重复性、稳定性、精密度、回收率进行方法学考察。
精密度考察:精密移取芦丁标准溶液3mL,置于25mL容量瓶中,采用AlCl3显色法测定。先加入5%的NaNO21mL,摇匀,放置6min后加入10%的Al(NO3)31mL,摇匀,放置6min后再加入4%的NaOH 10mL摇匀,用74%乙醇稀释至刻度,在510nm测定吸光度。连续测定5次,记录结果。
稳定性考察:精密移取芦丁标准溶液3mL,按照“精密度考察”项下方法测定,30min内每隔5min进行一次测定,记录结果。
重复性考察:精密移取芦丁标准溶液5份,按照“精密度考察”项下方法测定,然后分别记录其吸光度。
回收率实验:精密移取6份供试品溶液3mL于25mL量瓶,分别加入芦丁标准品6mg,加入5%的NaNO21mL,摇匀,6min后加入 10%的Al(NO3)31mL,摇匀,6min后再加入 4% 的 NaOH 10mL,以74%乙醇定容至刻度,摇匀。5min后,在510nm测定吸光度A。
1.2.1.5 总黄酮含量测定 精密移取供试品溶液3mL于25mL量瓶,加入 5%的 NaNO21mL,摇匀,6min后加入10%的Al(NO3)31mL,摇匀,6min后再加入4%的NaOH 10mL,以74%乙醇定容至刻度,摇匀。5min后,在510nm测定吸光度A,根据标准曲线按公式计算提取液中总黄酮的浓度。蜂花粉总黄酮含量公式见式1。
蜂花粉总黄酮含量(mg/g)=(提取液浓度×体积×稀释倍数)/样品质量 式(1)
1.2.2 不同品种蜂花粉抗氧化性评价 蜂花粉总黄酮含量测定提取液同时作为抗氧化样品试液,分别采用高锰酸钾氧化时间测定法[8]、磷钼酸法[9]、DPPH自由基清除法[10]、羟基自由基清除法[11]评价各个品种蜂花粉的抗氧化活性。实验内容均平行进行3次。对实验数据进行了归一化,并根据抗氧化实验的反应条件及稳定性,确定四种抗氧化活性评价指标权重分别:高锰酸钾氧化时间测定结果(X1)为130%,磷钼酸结合强度(X2)为110%,羟基自由基清除率(X3)为90%,DPPH自由基清除率(X4)为70%。依公式2得到蜂花粉抗氧化活性总指标(Y),排序得18种蜂花粉的抗氧化活性强弱顺序。
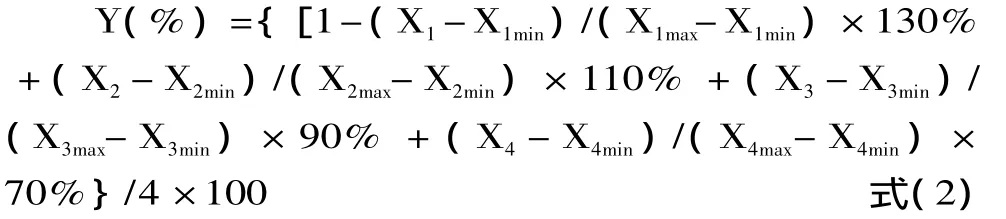
1.2.2.1 高锰酸钾氧化法 依中国药典高锰酸钾氧化法进行,精密量取样品液1mL及蒸馏水9mL,置于锥形瓶中,精密加入20%硫酸溶液2mL,振摇1min,精密加入0.02mol/L高锰酸钾溶液0.05mL,记录溶液红色完全消失时间,即为样品液的氧化时间。根据氧化时间的长短评价其抗氧化活性。
1.2.2.2 磷钼酸法 精密量取样品液1mL、硫酸溶液1mL、磷钼酸溶液1mL置于5mL量瓶中,蒸馏水定容至刻度。95℃恒温水浴30min,取出放至室温后,测其在619nm波长处的吸光度。根据抗氧化活性物质与磷钼酸的结合强度评价其抗氧化活性强弱。磷钼酸结合强度计算公式见式3。

1.2.2.3 DPPH自由基清除测定法 精密称取0.015g DPPH置于250mL量瓶中,以95%乙醇定容至刻度。精密量取1mL样品液置10mL量瓶中,蒸馏水定容。精密移取样品液1mL、DPPH溶液5mL于试管中,避光保存待测,1h后测定其在515nm波长处的吸光度,计算清除率。

1.2.2.4 羟基自由基清除率测定法 精确移取0.5mL 18mmol/L邻二氮菲溶液置于10mL量瓶中,再加入2.0mL pH7.4的 PBS溶液,混匀后加入 1.0mL 7.5mmol/L的 FeSO4溶液,充分混匀后加入1.0mL 0.2%H2O2溶液,蒸馏水定容,37℃下反应30min,测其在510nm波长处吸光度A1。同上法,加样品液后再加H2O21.0mL,测得A2;同上法,不加H2O2和样品液测得A3。

1.2.3 蜂花粉总黄酮含量与抗氧化性的相关系数采用EXCEL分别计算不同品种蜂花粉总黄酮含量与四种抗氧化活性实验结果的相关系数。
2 结果与分析
2.1 蜂花粉总黄酮含量测定
2.1.1 标准曲线 在510nm处测得各吸光度值,以芦丁浓度(mg/mL)为横坐标、吸光度为纵坐标绘制标准曲线,对标准曲线用最小二乘法进行线性回归,得到芦丁浓度与吸光度Y关系曲线的回归方程:
Y=12.07X+0.002,R=0.9990。
2.1.2 方法学考察 精密度考察实验RSD值为0.47%;重复性考察实验RSD为0.81%;显色结果1h内稳定;样品加样回收实验结果见表2,平均加样回收率结果为99.80%,RSD值为0.80%。实验结果显示,所用方法简便、准确,适用于蜂花粉总黄酮的含量测定。

表2 样品加样回收实验结果(n=6)Table 2 Recovery results of samples(n=6)
表3 不同品种蜂花粉总黄酮含量及抗氧化实验结果(,n=3)Table 3 The result of total flavonoids and antioxidant activity(,n=3)

表3 不同品种蜂花粉总黄酮含量及抗氧化实验结果(,n=3)Table 3 The result of total flavonoids and antioxidant activity(,n=3)
样品编号 总黄酮含量(mg/g)高锰酸钾褪色时间(s)磷钼酸结合强度(%)DPPH自由基清除率(%)羟基自由基清除率(%) 总指标(%)40 68.58±0.25 62.39 2 14.306±0.026 4.77±0.22 57.25±6.31 73.40±3.48 71.15±5.46 65.81 3 9.302±0.240 4.89±0.18 48.06±8.59 74.42±0.61 54.68±2.45 61.69 4 3.470±0.042 11.40±0.29 55.45±4.11 34.00±5.64 66.47±0.46 46.96 5 6.711±0.021 25.03±1.24 34.11±8.50 21.76±2.65 54.39±4.05 10.03 6 5.273±0.009 7.42±0.51 74.36±6.39 31.40±2.95 77.86±5.46 63.18 7 6.294±0.074 7.80±0.43 36.69±5.06 22.33±6.74 72.64±3.98 48.19 8 10.860±0.018 6.12±0.42 103.22±21.65 51.71±9.67 72.33±9.73 74.94 9 7.261±0.016 22.67±0.63 57.56±10.84 25.67±10.89 43.32±6.69 13.46 10 4.974±0.021 14.64±1.07 38.15±6.65 29.70±2.61 51.58±5.60 27.82 11 12.546±0.031 6.50±0.33 53.89±8.15 61.36±1.60 68.62±6.21 64.52 12 4.289±0.022 4.60±0.46 144.03±23.35 30.21±3.54 76.94±2.87 81.84 13 6.496±0.018 3.86±0.16 72.26±8.14 40.29±3.05 73.35±5.09 68.44 14 5.445±0.024 7.14±0.33 18.64±5.51 31.69±6.68 77.28±10.04 51.14 15 8.462±0.025 7.48±0.42 88.51±9.37 30.86±7.67 69.14±15.25 60.78 16 12.166±0.017 5.06±0.47 49.23±7.26 54.47±2.31 54.20±0.52 54.76 17 4.049±0.055 21.37±0.85 23.08±1.33 32.76±3.10 80.82±7.37 32.75 18 10.892±0.031 4.92±0.30 73.39±9.71 73.71±1 7.495±0.010 7.76±0.67 75.86±1.00 46.34±5.3.70 52.46±1.12 65.63
2.1.3 不同品种蜂花粉总黄酮含量 由表3可得,不同品种蜂花粉总黄酮含量为3.470~14.306mg/g。其中油菜蜂花粉总黄酮含量最高,其余依次为枣花、沙枣、五倍子、益母草蜂花粉等,一枝黄花蜂花粉总黄酮含量最低。
2.2 不同品种蜂花粉抗氧化活性评价结果与分析
抗氧化实验结果中,高锰酸钾氧化时间法以数值低者为抗氧化活性较强者,其他三种方法均为数值高者抗氧化活性较强者。高锰酸钾氧化法为药典收录方法,重复性高稳定性强,作为判定第一因素;磷钼酸法操作简便,影响因素较少较稳定,作为判定第二因素;羟基自由基清除率测定法存在一定不稳定因素,作为判定第三因素;DPPH自由基清除法易受光因素的影响,作为判定的第四因素。
表3显示,不同品种蜂花粉具有较强的抗氧化活性以及较强的自由基清除能力,但是不同品种之间存在较明显的差异。根据四种不同判定因素以及归一化的抗氧化实验数据,对18个不同品种蜂花粉的抗氧化活性强弱进行排序,其强弱顺序:玫瑰>益母草>虞美人>油菜>五倍子>枣花>猕猴桃>桃花>五味子>苹果>沙枣>玉米>茶花>一枝黄花>荞麦>菊花>葵花>荷花。
2.3 蜂花粉总黄酮含量与抗氧化活性的相关系数
由表4可见,蜂花粉中总黄酮含量与高锰酸钾褪色时间及羟基自由基清除率呈负相关,与磷钼酸结合强度及DPPH自由基清除率为正相关;但高锰酸钾褪色时间与其他三种抗氧化活性均呈负相关。蜂花粉总黄酮含量与DPPH自由基清除率相关系数最大为0.7780。张红城[6]等通过对6种蜂花粉进行DPPH自由基清除能力以及还原力的实验研究,也发现黄酮类物质对自由基引起的连锁起始反应阶段的抑制作用较好;程妮[12]等通过对不同产地油菜蜂花粉抗氧化活性的研究,同样证实在油菜蜂花粉提取物中,黄酮类物质为主要的自由基清除剂。此外,蜂花粉中成分复杂多样,孙丽萍[13-14]、Campos[15]等报道蜂花粉中黄酮类、多酚类、脂类(类胡萝卜素)、维生素C、维生素E均具有一定的抗氧化活性。这些成分之间可能存在协同作用,影响抗氧化效果。蜂花粉总黄酮含量与羟基自由基清除率为负相关,可能受多酚、脂类等物质影响所致;有待进一步的研究证实。

表4 总黄酮含量与抗氧化活性的相关系数Table 4 The correlation coefficient of total flavonoids and antioxidant activity
3 结论
蜂花粉具有优良的抗氧化能力,为天然的抗氧化剂。实验结果表明:18种蜂花粉总黄酮含量为3.470~14.306mg/g,且均具有一定的抗氧化活性。不同品种蜂花粉具抗氧化活性能力有显著差异,其抗氧化活性强弱顺序:玫瑰>益母草>虞美人>油菜>五倍子>枣花>猕猴桃>桃花>五味子>苹果>沙枣>玉米>茶花>一枝黄花>荞麦>菊花>葵花>荷花。
蜂花粉总黄酮含量与不同机制的抗氧化活性实验结果的相关性不同,蜂花粉总黄酮含量与DPPH自由基清除率相关性最强,表明总黄酮可能是蜂花粉清除DPPH自由基的主要活性成分之一。
[1]李雅晶,胡福良,冯磊.蜂花粉抗氧化的机理与应用[J].蜜蜂杂志,2005(3):9-11.
[2]张雨,李艳芳,周才琼.花粉主要营养成分与保健功能[J].中国蜂业,2006,57(7):26-27.
[3]苏寿祁.蜂花粉的化学组成[J].中国养蜂,2005,56(9):42-43.
[4]Ting Lu,Edward PC Lai,Jorn CC Yu,et al.Analysis for flavonoids in bee pollens by capillary electrophoresis[J].Food Science,2006,325:582-587.
[5]冉林武,闫亚美,曹有龙,等.响应面实验优化超声波法提取枸杞蜂花粉黄酮类化合物工艺[J].食品科学,2012(12):37-40.
[6]张红城,董捷,李慧,等.六种蜂花粉多酚和黄酮类物质含量测定及抗氧化性的研究[J].食品科学,2007(9):500-504.
[7]刘光南,赖由运,刘振水,等.蜂花粉抗氧化作用的研究进展[J].蜜蜂杂志,2011(11):34-36.
[8]中华人民共和国卫生部药典委员会.中国药典(一部)[S].北京化学工业出版社,2010:336.
[9]李军.钼蓝比色法测定还原型维生素 C[J].食品科学,2000(8):42-45.
[10]彭长连,陈少薇,林植芳,等.用清除有机自由基DPPH法评价植物抗氧化能力[J].生物化学与生物物理进展,2010,35(1):209-212.
[11]Li LL,Cao GQ,Zeng LL,et al.Free radical scavenging effects from Sanguisorba Officinalis[J].Nat Prod Res Dev,2008,20:511-513.
[12]程妮,王毕妮,邓建军,等.不同产地油菜蜂花粉抗氧化活性比较研究[J].食品科学,2011,32(21):34-36.
[13]孙丽萍,杨佳林,徐响,等.油菜蜂花粉酚类化合物的初步分离和抗氧化活性研究[J].食品科学,2009,30(23):52-56.
[14]徐响,何伟,孙丽萍,等.蜂花粉油脂抗氧化活性与类胡萝卜素含量的相关性[J].食品科学,2010,31(21):155-158.
[15]Campos MG,Bogdanows,Almeida-Muradianl B,et al.Pollen composition and standardisation of analytical methods[J].Journal of Apicultural Research and Bee World,2008,47(2):156-163.
