超声波对无花果多糖抗氧化活性的影响
2013-12-08王振斌孙亚钊
王振斌,孙亚钊,郭 强
(1.江苏大学食品与生物工程学院,江苏镇江212013;2.句容虎耳山无花果合作社,江苏镇江212013)
无花果(Ficus caricaL.)属于桑科落叶乔木,其花较小,并藏于花托内,故名无花果[1]。无花果不仅果味鲜美,而且具有抗病毒、抗菌、降血糖、降血脂、抗肿瘤、降血压、治疗白癜风等药理作用[2]。无花果多糖是无花果的重要功能因子。戴伟娟等[3]发现无花果多糖对正常小鼠的免疫功能有增强作用。杨小明等[4]发现无花果多糖具有较强的抗氧化性。超声波指的是频率在20k Hz及以上的声波,可以通过由超声空化作用引起的机械效应、热效应和水分子裂解产生的自由基效应对多糖的结构产生影响,从而改善对象的生理活性[5]。目前针对无花果多糖分子修饰的研究尚未见报道。本文以超声波处理无花果粗多糖对其进行改性,以研究其对抗氧化性的影响,为超声波在无花果多糖抗氧化保健品中的开发利用提供理论依据。
1 材料与方法
1.1 材料与仪器
无花果果干 江苏句容市虎耳山无花果合作社,无花果切分后冷冻干燥而成;石油醚、氯仿、正丁醇、无水乙醇、磷酸二氢钠、磷酸氢二钠、铁氰化钾、三氯乙酸、三氯化铁、硫酸亚铁、双氧水、水杨酸 分析纯,国药集团化学试剂有限公司。
RE-2000型旋转蒸发仪 上海亚荣生化仪器厂;UV-1601型紫外可见分光光度计 北京瑞利分析仪器公司;FD-8型冷冻干燥机 北京博医康实验仪器有限公司;JY92-ⅡDN型超声波细胞粉碎仪宁波新芝生物科技股份有限公司。
1.2 实验方法
1.2.1 无花果粗多糖的提取 无花果干经过粉碎后过40目筛,将处理后粉末加入索氏提取器中,以石油醚为溶剂,在60℃下回流12h以除去脂类物质,之后将粉末烘干。将粉末与水按照料液比1∶15的比例,在80℃浸泡20min,过滤取上清液,浓缩至一定体积,然后加入4倍体积的无水乙醇,在4℃下静止12h,离心,除去上清液,用水溶解沉淀,采用离心除去不溶部分。将上清液按照1/4体积量加入Sevag(氯仿和正丁醇按照体积比4∶1试剂),剧烈振荡30min后在4500r/min下离心10min,收集上清液,将以上除蛋白过程重复3~6次,直到没有乳白色变性蛋白质析出为止[6]。将上清液冷冻干燥之后即得粗多糖。
1.2.2 超声总时间对无花果多糖抗氧化性的影响 取0.2%的粗多糖溶液50mL置于100mL小烧杯中,在超声功率为800W,间歇比(工作时间/间歇时间)为4s/2s条件下分别超声 0、30、60、90、120min 然后测定其总还原力和羟自由基清除率。
1.2.3 超声功率对无花果多糖抗氧化性的影响 取0.2%的粗多糖溶液50mL置于100mL小烧杯中,分别在功率 0、200、400、600、800、1000W,间歇比 4s/2s条件下作用90min之后分别测定其羟自由基清除率和还原力。
1.2.4 超声间歇比对无花果多糖抗氧化性的影响 取0.2%的粗多糖溶液50mL于100mL小烧杯中,在功率为600W的条件下,超声间歇比分别0∶2,1∶2,2 ∶2,4∶2,5 ∶2,3∶1,3 ∶2,3∶3,3 ∶4,3 ∶5(s∶s),超声90min之后分别测定其羟自由基清除率和还原力。
1.2.5 正交实验 在单因素实验的基础上,以超声总时间、超声功率、超声间歇比为因素,采用L9(33)正交表分别以羟自由基清除率、总还原力和基于以上两个指标的归一化处理为指标进行优化设计,具体因素的选择如表1所示。
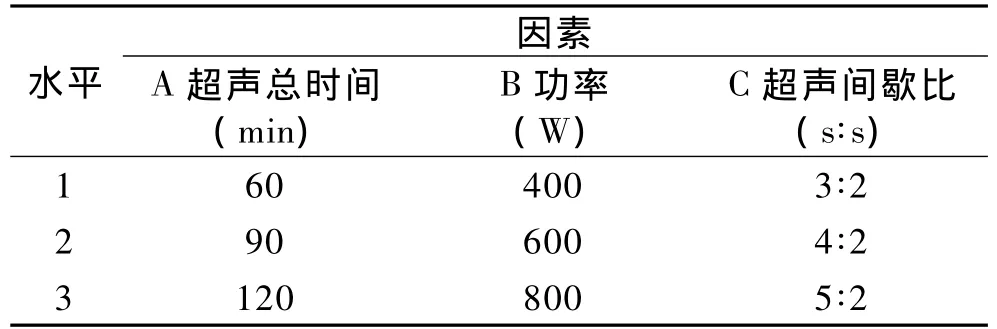
表1 因素水平设计Table 1 The factors and levels in design
1.2.6 抗氧化性的测定
1.2.6.1 还原力的测定 取待测液1mL,加p H6.6的0.2mol/L的磷酸缓冲液2.5mL,再加入1%铁氰化钾溶液2.5mL,50℃下保温20min,急剧冷却,之后加入10%三氯乙酸2.5mL,在3000r/min条件下离心10min。取上清液2.5mL,加入去离子水2.5mL,再加入0.1%三氯化铁0.5mL,使用分光光度计在700nm处测定吸光度[7-8]。
1.2.6.2 羟自由基清除率的测定方法 取待测液2mL,依次加6mmol/L的FeSO4和6mmol/L的H2O2各2mL,混匀后静置10min,再加入6mmol/L水杨酸2mL,混匀后静置30min,在510nm处测其吸光值并记为A1,当用双蒸水代替水杨酸时的吸光值记为A2。空白对照组以双蒸水代替待测液,吸光值记为A3。按照式1计算羟自由基的清除率y(%)[9]:

2 结果与分析
2.1 超声总时间对无花果多糖抗氧化性的影响
超声总时间对无花果多糖抗氧化性影响结果如图1所示。由图1可以看出,随着超声时间的延长,无花果多糖羟自由基清除率和还原力都逐渐升高,在90min时达到最大值,分别从未处理的24.47%和0.555升高到29.03%和0.685,继续延长超声时间到120min时,无花果多糖的羟自由基清除率和还原力均无进一步的显著变化。
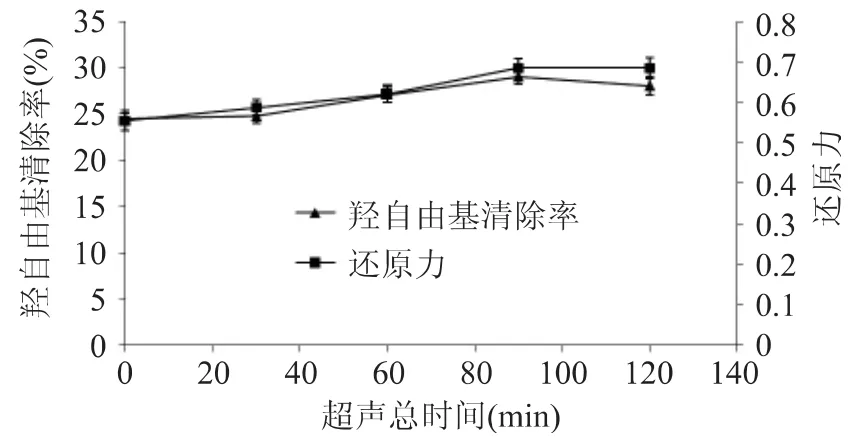
图1 超声总时间对无花果多糖抗氧化性的影响Fig.1 Effect of total ultrasonic pretreatment time on antioxidant activity of fig polysaccharides
2.2 超声功率对无花果多糖抗氧化性的影响
超声功率对无花果多糖抗氧化活性的影响如图2所示。对图2的分析可以看出,超声功率在400W时,多糖的羟自由基清除率最高,功率超过600W后,羟自由基清除率有略微的下降。随着超声功率的增大,总还原力有比较明显地升高,超声功率再增加,到800W以上时,还原力有明显底下降。综合以上两个因素,实验取600W为最佳。分析其原因可能是适当功率的超声波有利于无花果多糖的降解和溶解度的提高,但功率过大可能引起多糖分子交联,使抗氧化作用有下降的趋势。

图2 超声功率对无花果多糖抗氧化性的影响Fig.2 Effect of ultrasonic power on antioxidant activity of fig polysaccharides
2.3 超声间歇比对无花果多糖抗氧化性的影响
超声间歇比对无花果多糖抗氧化性的影响如图3、图4所示。
由图3、图4可以看出,在间歇时间相等的情况下,随着超声工作时间的延长,多糖的还原力和羟自由基清除率总体呈现增强的趋势,当超声工作时间为3s时达到最大值,之后随着超声工作时间的延长,无明显的变化;当工作时间固定在3s时,间歇时间对于羟自由基和总还原力都没有显著的影响。超声间歇对抗氧化性没有明显的影响说明超声波引起的多糖结构变化,在较短的时间内不容易恢复到原来的状态。

表2 正交实验设计与结果Table 2 The orthogonal experimental design and results
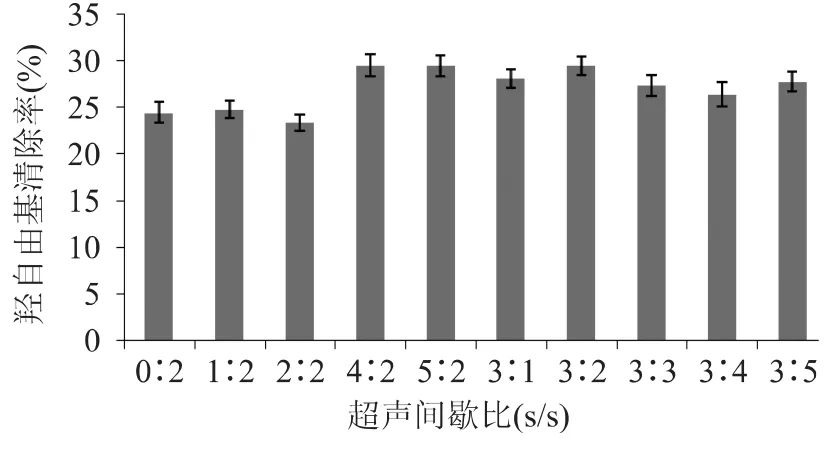
图3 超声间歇比对无花果多糖羟自由基清除率的影响Fig.3 Effect of the on/off time ratio on ultrasonic pretreatment on hydroxyl radical scavenging capacity of fig polysaccharides
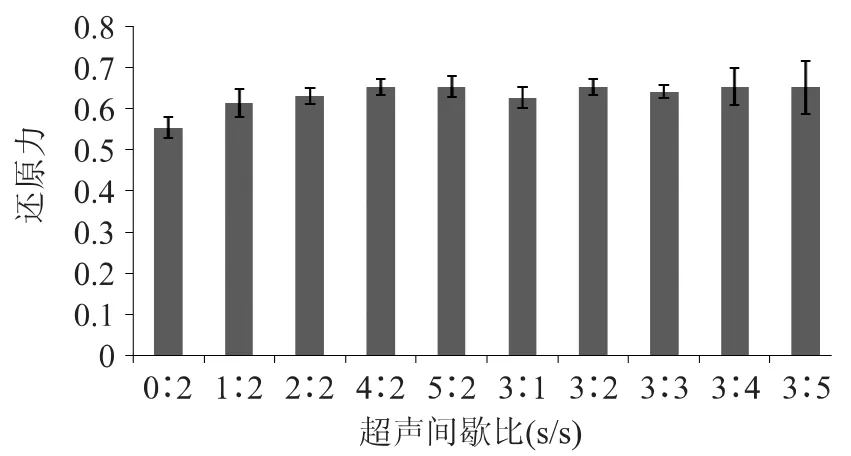
图4 超声间歇比对无花果多糖总还原力的影响Fig.4 Effect of the on/off time ratio on ultrasonic pretreatment on reduction power of fig polysaccharides
2.4 正交实验
由表2可知,3个因素对羟自由基清除率的影响从大到小依次为超声总时间,超声功率,超声间歇比,最优组合为A2B2C3。影响还原力的因素大小依次为超声总时间,超声功率,超声间歇比,最优组合为A2B3C3。采用了归一化处理,综合评价两个指标,对抗氧化影响因素从大到小依次为超声总时间,超声间歇比,超声功率,最优条件为A2B2C3。
2.5 验证实验
以最优条件A2B2C3,即超声总时间为90min,超声功率600W,超声间歇比5∶2(s∶s)条件下处理50mL的0.2%无花果粗多糖溶液,分别测定其总还原力和羟自由基清除率。结果如表3所示。
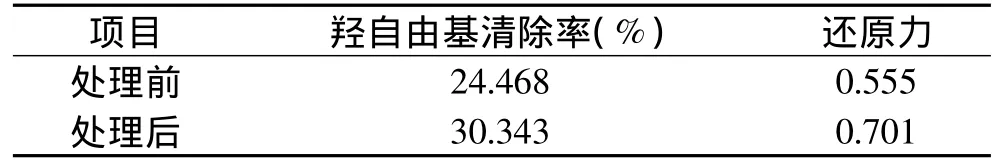
表3 超声处理对无花果多糖羟自由基清除率和总还原力的影响Table 3 Effect of ultrasonic pretreatment on hydroxyl radical scavenging capacity and reduction power of fig polysaccharides
由表3可知,经超声处理之后的无花果粗多糖羟自由基清除率和总还原力分别达到了30.343%和0.701,均高于正交实验中的各组实验。
3 结论
超声波对无花果粗多糖的抗氧化性有显著地提高作用。通过对超声总时间、超声功率、超声间歇比进行单因素实验,然后再进行正交优化得出最佳的处理条件为超声总时间为90min、超声功率为600W、间歇比为5∶2(s∶s)。在这个条件下无花果多糖的还原力和羟自由基清除率比未经超声处理的分别提高了24.010%和26.306%。
[1]《全国中草药汇编》编写组.全国中草药汇编[M].北京:人民卫生出版社,1975.
[2]杨润亚,明永飞,王慧.无花果叶中总黄酮的提取及其抗氧化活性测定[J].食品科学,2010,30(16):78-82.
[3]戴伟娟,司端运,王绍红,等.无花果多糖对免疫抑制小鼠的免疫调节作用[J].中国中医药信息杂志,2002(3):16-18.
[4]Yang X M,Yu W,Ou Z P,et al.Antioxida nt and immunity activity of water extract and crude polysaccharide fromFicus caricaL.fruit[J].Plant Foods Hum Nutr,2009(64):167-173.
[5]洪胜,潘利华,罗建平.生物多糖超声波辅助提取研究进展[J].食品工业科技,2011,32(8):481-484.
[6]吴冬青,安红钢,徐新建,等.甘肃临泽小枣多糖提取及抗氧化性[J].光谱实验室,2001(5):1066-1069.
[7]Tanaka M,Kuei C W,Nagashima Y.Application of antioxidative Maillard reaction products from histidine and glucose to sardine products[J].Nippon Suisan Gakkaish,1988,54(8):1409-1414
[8]Kadriye I B,G TorBirsen,Demirata R A.Total antioxidant capacity assay using optimized Ferricyanide Prussian blue method[J].Food Anal Method,2010(3):154-168
[9]贾俊强,马海乐,曲文娟,等.超声预处理大米蛋白制备抗氧化肽[J].农业工程学报,2008,24(8):288-293.
