恒河猴精原干细胞的筛选、培养与鉴定
2013-12-08王庆忠刘慧莲王汉海
王庆忠 刘慧莲 王汉海
潍坊学院生物与农业工程学院,山东省高校“生物化学与分子生物学”重点实验室(261061)
自Brinster等[1]于1994年创立了精原干细胞(SSCs)的移植技术体系以来,各种动物的SSCs的分离、纯化、培养、移植、分化和转基因操作等研究迅速发展[2,3],人们也清楚的认识到 SSCs研究在阐明精子发生机理、制作转基因动物、男性不育治疗、濒危动物物种保存等领域的重要性与潜在价值[4,5]。由于睾丸中的SSCs数量少[6]、支持细胞等体细胞以及血清诱导培养的 SSCs分化[7,8],使 SSCs的筛选、纯化与无血清培养成为了体外实验研究的关键,但至今未找到SSCs的特异性标志分子。用于磁激活细胞分选法(MACS)和流式细胞分选法(FACS)进行纯化[9],使差异贴壁筛选法成为富集SSCs的广泛使用的简便方法[10~13]。有研究表明,低浓度血清(0.3% ~2%)是体外培养时SSCs克隆形成所必需的[10],因而在SSCs筛选时多使用含血清的培养基,成功建立了多种动物的体外长期培养体系[8~13]。然而,由于研究材料来源的限制,与人类亲缘关系密切的非人灵长类动物的 SSCs的研究较少[14~16],恒河猴SSCs体外培养的研究未见报道。本研究利用成年恒河猴的睾丸,对恒河猴的SSCs进行了富集、纯化和体外培养等研究。
1 材料与方法
1.1 样本来源
成年恒河猴睾丸由北京生物制品研究所惠赠。处死恒河猴后,立即摘取睾丸(46只),浸入冰浴的生理盐水中,6h内带回实验室处理。
1.2 主要试剂和仪器
DMEM/F12、丝裂霉素C、丙酮酸、胰岛素、D-(+)-葡萄糖、DL-乳酸、β-巯基乙醇、维生素C、胶原酶IV、d-生物素、胰蛋白酶、明胶、DNAse等购于Sigma-Aldrich;L-谷氨酰胺、青霉素、链霉素、MEM维生素溶液、MEM非必需氨基酸溶液、胎牛血清(FBS)等购于Invitrogen;重组人碱性成纤维细胞生长因子(bFGF)和重组大鼠胶质细胞源性神经营养因子(GDNF)为R&D产品;透明质酸酶购于Calbiochem;兔抗Oct4多克隆抗体、小鼠抗人c-Ret多克隆抗体和兔抗人胶质纤维酸性蛋白(GFRα1)多克隆抗体为 Chemicon产品;异硫氰酸荧光素(FITC)偶联的山羊抗兔IgG和FITC偶联的羊抗小鼠IgG为Santa cruz biotechnology产品。主要仪器有:CO2培养箱、激光共聚焦扫描显微镜(Leica,德国)、培养瓶/皿和6孔培养板(9.4cm2/孔)等。
1.3 培养基和培养条件
SSCs培养基是在DMEM/F12中添加了MEM维生素溶液、MEM非必需氨基酸溶液、2×10-3mol/L L-谷氨酰胺、25μg/ml胰岛素、6mg/ml D -(+)-葡萄糖、30μg/ml丙酮酸、5×10-5mol/L β -巯基乙醇、1μl/ml DL-乳酸、1×10-4mol/L维生素 C、10μg/ml d-生物素、10ng/ml重组人 bFGF、20ng/ml重组大鼠 GDNF、200ng/ml重组大鼠 GDNFsRα1(GFRα1/Fc)、100U/ml青霉素和 100μg/ml链霉素。普通DMEM/F12培养基是在DMEM/F12中添加了2mM L-谷氨酰胺、10%FBS、100U/ml青霉素和100μg/ml链霉素,用于贴壁筛选SSCs和胚胎成纤维细胞(MEF)的细胞培养。培养瓶/皿/板0.2%明胶包被。所有细胞均在37°C、5%CO2和饱合湿度条件下培养。
1.4 小鼠MEF饲养层制备
从脱臼处死的孕12~14d的小鼠子宫中取出胎鼠,常规方法分离、培养和冻存小鼠MEF。制备饲养层时,以含10μg/ml丝裂霉素C的DMEM/F12培养基处理2~2.5h,PBS洗涤、常规消化、离心和重悬细胞后,以5×104细胞/cm2接种和培养备用。
1.5 恒河猴睾丸细胞悬液的制备
所用消化液Ⅰ是在不含钙和镁的PBS中添加了2mg/ml胶原酶IV、200μg/ml DNAse;所用消化液II是在无血清DMEM/F12中添加2 mg/ml胶原酶IV、200μg/ml DNAse、2mg/ml透明质酸酶的基础上[10,11],再添加 1mg/ml胰蛋白酶。
睾丸细胞悬液制备:①取出睾丸,每2只为1组,用含100U/ml青霉素和100μg/ml链霉素的生理盐水洗涤3min×3次;②在超净台上除去睾丸白膜,转移睾丸组织到15ml离心管中;③加入5倍体积的PBS洗涤2min×3次;④加入5倍体积的消化液I,并用吸管轻轻吸打,在室温下作用3~5min至曲细精管分散,170r/min离心2min,弃上清;⑤加入5倍体积的消化液II,吸管轻轻吸打,室温下消化5~10min;⑥加入含10%FBS的 DMEM/F12培养基,250r/min离心5min,弃上清;⑦加10ml PBS重悬细胞,用60M孔径的筛网过滤,滤出液于200r/min离心5min,弃上清收集细胞;⑧加入含10%FBS的DMEM/F12培养基重悬细胞,以2×105细胞/cm2接种到培养瓶或6孔板或培养皿中,置培养箱中培养。
1.6 恒河猴SSCs的筛选与纯化
采用差异贴壁分选法,略有修改。主要步骤如下:①接种培养的睾丸细胞在培养12~24h后,取出培养瓶,通过吸管轻轻吹打悬起贴壁松散的生精细胞和部分Sertoli's细胞,并转移到新的培养瓶/皿中继续培养;②培养20~24h后,用同样的方法再次转移悬浮起的细胞到新的培养瓶/皿中培养:③再培养18~24h,直到睾丸体细胞完全贴壁铺展生长后,再用上述方法悬起生精细胞,250r/min离心5min,弃上清,以无血清DMEM/F12培养基即SSCs培养基重悬细胞并接种到丝裂霉素C处理的小鼠MEF饲养层上培养并观察。
1.7 SSCs标志基因表达的免疫细胞化学分析
对在6孔板或培养皿中培养的SSCs进行免疫细胞化学染色,主要步骤为:①弃去培养液,PBS洗涤2次,5min/次;②4%多聚甲醛固定液室温作用20min;③PBS 洗 3 次,10min/次;④加 0.5ml封闭液室温作用45min;⑤弃掉封闭液,加200μl 1:500稀释的第一抗体,4℃孵育过夜;⑥PBS室温洗涤3次,5min/次;⑦加入稀释的第二抗体,室温避光孵育1h;⑧PBS洗涤 3 次,5min/次,然后加入 0.5ml PBS覆盖细胞,于激光共聚焦显微镜下观察并照相。
1.8 标志基因表达的RT-PCR分析
按说明书方法用Trizol试剂提取培养细胞或恒河猴睾丸组织的总RNA。用SuperscriptTM III逆转录酶合成cDNA第一链,用Tag DNA聚合酶(大连宝生物有限公司)进行PCR扩增反应。所检测基因的引物序列(5'→3')和产物大小如下(s代表 sence primer,a代表 anti- sence primer):Mvh(s):GCTCA AAC AGG GTC TGG GAA G,Mvh(A):GGT TGA TCA GTT CTC GAG(130bp):Piwil2(s):5'- CCG TCA TGA AGG AGA GCT CG - 3',Piwil2(a):5'-GGA ACG ACT CTG TGC TGG AT - 3'(347bp);GFRα1(s):ACT CCT GGA TTT GCT GAT GTC GG,GFRα1(a):CGC TGC GGC ACT CAT CCT T(191bp);以G3PDH作为阳性对照,G3PDH(s):ACC ACA GTC CAT GCC CAT CAC,G3PDH(a):TCC ACC ACC CTG TTG CTG TA(450bp)。
2 结果
细胞克隆(图1-D),这些细胞克隆逐渐增大,说明其中的SSCs增殖。在高倍显微镜下观察到这些细胞克隆形态不规则,细胞间有明显的细胞质桥相连接。除了细胞克隆外,还观察到成对或成串的由细胞质桥相连的细胞群。培养7~10d,SSCs表现出明显的克隆生长行为。
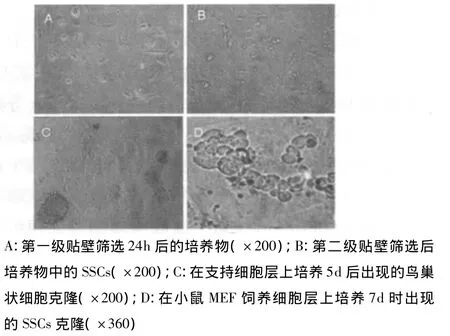
图1 恒河猴SSCs的形态特征与生长行为
2.1 恒河猴SSCs的形态特征与生长行为
第一级贴壁筛选24h,观察到在培养瓶/皿中,支持细胞已经贴壁铺展,而生精细胞只是贴附在支持细胞层上,多呈圆形,细胞核明显(图1-A)。这些附着的生精细胞很容易通过吸管吹打悬浮起来,说明其贴壁能力远小于支持细胞。当第二级贴壁筛选2d后,仍有部分支持细胞贴壁铺展,部分较大的生精细胞松散的贴附在支持细胞层上或悬浮着,轻轻晃动培养瓶悬浮起这类细胞,通过更换培养液除去后,可观察到在支持细胞层上贴附的圆形、梭形或形态不规则的SSCs,少数SSCs相互粘附成大小不一的克隆(图1-B)。将培养物继续培养5~7d,可观察到支持细胞的增殖和鸟巢状细胞克隆(图1-C)。在高倍显微镜下,鸟巢状细胞克隆内的细胞多为梭形或纤维状,少数为圆形,说明它们是由支持细胞和SSCs共同构成的。随着培养的继续,这类细胞克隆增殖较快,但其中的SSCs逐渐消失。当通过吸管吹打悬起第二级贴壁筛选后的SSCs并转移到丝裂霉素C处理的小鼠MEF饲养细胞层上后,继续培养3~5d,再通过吹打将SSCs转移到第四级培养瓶中培养,这时培养物中的支持细胞已经基本除去。恒河猴SSCs在MEF饲养细胞层上形成大小不等的
2.2 培养的恒河猴SSCs的活性鉴定
根据研究SSCs是Oct4、c-Ret、GFRα1、NCAM、6 - integrin、Mvh 和 ngn3 阳性细胞[17~19]。选择了Oct4、c-Ret、GFRα1 3 种标志分子进行 SSCs活性的检测。免疫细胞化学分析结果(图2)表明,培养物中产生的SSCs克隆表达这3种已知的SSCs标志分子。选取GFR 1和Piwi12两个标志基因,进行了SSCs的RNA表达水平的RT-PCR检测,结果见图3。Piwi12和GFRα1两种SSCs标志分子只在SSCs上表达,由于在睾丸中的表达比较弱而未能检测出来;Mvh在SSCs和睾丸中都有表达;是生精细胞标志分子,说明培养细胞属于生精细胞,具有干细胞活性。
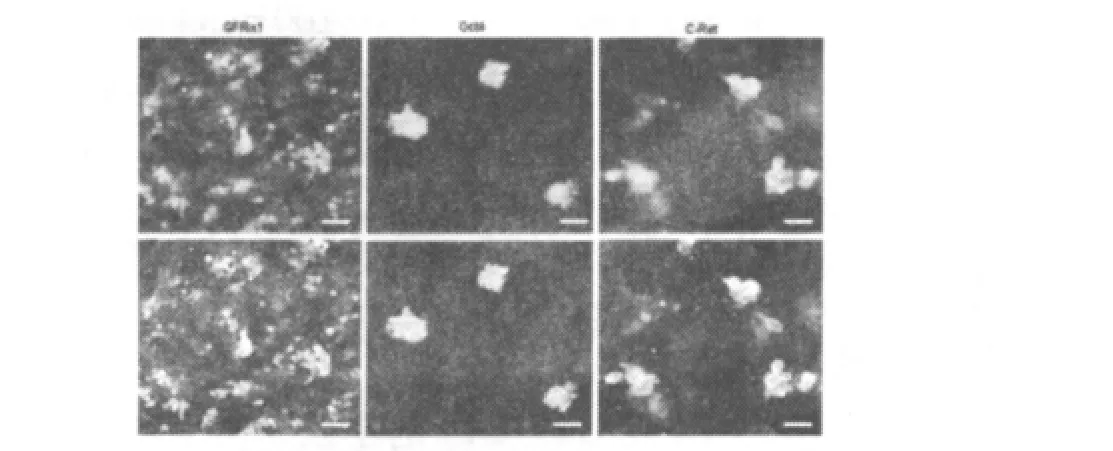
图2 培养的细胞克隆的免疫细胞化学染色(标线:50μm)
3 讨论
本研究利用改进的二步酶消化法从成年恒河猴的睾丸中分离睾丸细胞,通过改良的差异贴壁分选法来筛选和纯化SSCs,并对纯化的SSCs进行了培养、观察与鉴定。结果表明,通过对消化和纯化方法的改进,加快了睾丸细胞悬液的制备过程,缩短了SSCs纯化的时间,也加快了培养物中SSCs克隆的产生、形成和稳定的过程。因此,能够在起始培养7~10d时观察到培养物中出现的SSCs克隆,这些克隆有SSCs活性并呈克隆生长行为。形态观察表明,恒河猴SSCs具有小鼠、大鼠和人等的SSCs典型特征,细胞形态不规则,克隆中的细胞间有细胞质桥相连[19~23]。
本研究初步建立了恒河猴SSCs的分离、筛选与培养体系。但由于恒河猴睾丸来源的限制,未能进行恒河猴SSCs的长期培养等研究。恒河猴SSCs的体外培养、冷冻保存、诱导分化、转基因等研究将给人SSCs的利用提供理论借鉴和技术基础,给男性生殖障碍的干细胞治疗等带来福音。
1 Brinster RL,Avarbock MR.Germline transmission of donor haplotype following spermatogonial transplantation[J].Proc Natl Acad Sci USA,1994,91:11303 -11307.
2 Wang QZ.Theproliferation profile of mouse spermatoganial stemcells in three types of culture media[J].Zhongguo Ying Yong Sheng Li Xue Za Zhi,2009,25,:286 -288.
3 Kanatsu-Shinohara M,Muneto T,Lee J,et al.Long-term culture of male germline stem cells from hamster testes[J].Biol Reprod,2008,78:611-617.
4 Kubota H,Brinster RL.Technology insight:In vitro culture of spermatogonial stem cells and their potential therapeutic uses[J].Nat Clin Pract Endocrinol Metab,2006,2:99-108.
5 Meachem S,von Schonfeldt V,Schlatt S.Spermatogonia:stem cells with a great perspective[J].Reproduction,2001,121:825 -834.
6 Tegelenbosch RA,de Rooij DG.A quantitative study of spermatogonial multiplication and stem cell renewal in the C3H/101 F1 hybrid mouse[J].Mutat Res,1993,290:193 -200.
7 Kiger AA,White-Cooper H,Fuller MT.Somatic support cells restrict germline stem cell self-renewal and promote differentiation[J].Nature,2000,407:750 -754.
8 Kubota H,Avarbock MR,Brinster RL.Growth factors essential for self- renewal and expansion of mouse spermatogonial stem cells[J].Proc Natl Acad Sci U SA,2004,101:16489-16494.
9 Sadri-Ardekani H,Mizrak SC,van Daalen SK,et al.Propagation of human spermatogonial stem cells in vitro[J].Jama,2009,302:2127-2134.
10 Kanatsu-Shinohara M,Ogonuki N,Inoue K,et al.Long-term proliferation in culture and germline transmission of mouse male germline stem cells[J].Biol Reprod,2003,69:612 -616.
11 Nagano M,Ryu BY,Brinster CJ,et al.Maintenance of mouse male germ line stem cells in vitro[J].Biol Reprod,2003,68:2207 -2214.
12 Kanatsu-Shinohara M,Miki H,Inoue K,et al.Long-term culture of mouse male germline stem cells under serum-or feeder-free conditions[J].Biol Reprod,2005,72:985 - 991.
13 Ogawa T,Ohmura M,Tamura Y,et al.Derivation and morphological characterization of mouse spermatogonial stem cell lines[J].Arch Histol Cytol,2004,67:297 -306.
14 Maki CB,Pacchiarotti J,Ramos T,et al.Phenotypic and molecular characterization of spermatogonial stem cells in adult primate testes[J].Hum Reprod,2009,24:1480 -1491.
15 Hermann BP,Sukhwani M,Lin CC,et al.Characterization,cryopreservation,and ablation of spermatogonial stem cells in adult rhesus macaques[J].Stem Cells,2007,25:2330 -2338.
16 Johnston DS,Russell LD,Griswold MD.Advancesin spermatogonial stem cell transplantation[J].Rev Reprod,2000,5:183 -188.
17 Kubota H,Avarbock MR,Brinster RL.Culture conditions and single growth factors affect fate determination of mouse spermatogonial stem cells[J].Biol Reprod,2004,71:722 -731.
18 Hermann BP,Sukhwani M,Simorangkir DR,et al.Molecular dissection of the male germ cell lineage identifies putative spermatogonial stem cells in rhesus macaques[J].Hum Reprod,2009,24:1704-1716.
19 Shi YQ,Wang QZ,Liao SY,et al.In vitro propagation of spermatogonial stem cells from KM mice[J].Front Biosci,2006,11:2614-2622.
20 Kossack N,Meneses J,Shefi S,et al.Isolation and characterization of pluripotent human spermatogonial stem cell- derived cells[J].Stem Cells,2009,27:138 -149.
21 Aponte PM,van Bragt MP,de Rooij DG,et al.Spermatogonial stem cells:characteristics and experimental possibilities[J].Apmis,2005,113:727 -742.
22 Kanatsu-Shinohara M,Shinohara T.Culture and genetic modification of mouse germline stem cells[J].Ann N Y Acad Sci,2007,1120:59-71.
23 Aponte PM,Soda T,Teerds KJ,et al.Propagation of bovine spermatogonial stem cells in vitro[J].Reproduction,2008,136:543 -557.
