红车轴草总黄酮对H2O2诱导的血管内皮细胞损伤的保护作用
2013-12-08高蒙蒙孙桂波斯建勇孟祥宝孙晓波
高蒙蒙,孙桂波,斯建勇,秦 蒙,罗 云,孟祥宝,王 敏,孙晓波
血管内皮细胞与血管生理学的许多方面(如血管舒张、血管再生、炎症和屏障功能等)密切相关,内皮细胞损伤是导致动脉粥样硬化和高血压的关键因素[1]。氧化应激被认为是导致内皮细胞损伤的主要病理因素[2-3],因而寻找具有抗氧化应激作用的化合物对于治疗心血管疾病具有重要的临床意义。
红车轴草中富含黄酮类、蛋白质、氨基酸、糖类和维生素等多种成分,其中16种黄酮类物质已被检测出,总含量占干重的2%[4]。具有潜在抗氧化作用的黄酮类化合物是治疗和预防心血管疾病的中草药的主要有效成分。研究发现红车轴草总黄酮(Red clover flavonoids,RCF)具有抗氧化作用[5],且其中的芒柄花素、染料木素等可舒张动脉血管,从而减少动脉粥样硬化的发生[6];血压正常的绝经期女人食入红车轴草总黄酮(如芒柄花黄素等)可防治动脉血管硬化并减少总血管阻力[7],以上研究显示红车轴草总黄酮在预防和治疗心血管疾病中具有潜在应用价值。红车轴草来源广泛、价格低廉,具有明显的新药研发优势。但目前关于红车轴草总黄酮对血管内皮细胞损伤的保护作用及作用机制未见报道。本研究采用体外培养内皮细胞ECV-304的方法,建立H2O2对内皮细胞ECV-304的氧化损伤模型,进一步探究红车轴草总黄酮对内皮细胞损伤的保护作用及其作用机制,为开发红车轴草总黄酮治疗心脑血管疾病提供实验资料和理论依据。
1 材料与方法
1.1 主要材料 红车轴草总黄酮由中国医学科学院药用植物研究所化学室提供,用二甲基亚砜(dimethyl sulfoxide,DMSO)溶解后保存备用,DMEM高糖培养基、胎牛血清均购自 Gibco公司。LDH、SOD、MDA、CAT、GSH-Px试剂盒均购于南京建成生物工程研究所;H2O2购于北京化工厂;胰酶、四氮唑兰(MTT)购自SIGMA公司。
1.2 主要仪器 倒置显微镜(日本Olympus);超净工作台(上海智城分析仪器制造有限公司);酶标仪(美国BioTek);离心机(中国 Anke);细胞培养箱(美国Thermo);荧光倒置显微镜(德国莱卡)。
1.3 方法
1.3.1 人脐静脉血管内皮细胞ECV-304的培养人脐静脉血管内皮细胞株(内皮细胞ECV-304)由中国科学院上海细胞生物学研究所提供。镜下细胞呈“铺路石”样,多行性或短梭形镶嵌排列。当细胞生长融合至80%时,将瓶内旧培养液倒掉,PBS液轻洗细胞2~3次。加入1 ml左右0.125%胰酶,至37℃、5%CO2培养箱孵育2 min,镜下见细胞皱缩变圆、细胞间隙增大时,吸弃胰酶,加入含10%胎牛血清的完全培养液以终止胰酶的作用,用吸管反复轻轻吹打细胞,使之从瓶壁脱落成细胞悬液。细胞计数,调细胞密度为1×105个/ml,接种于96孔板每孔 100 μl,置于 37℃、5%CO2条件下培养。约 24 h后待细胞达融合状态时用于实验。
1.3.2 H2O2诱导人脐静脉血管内皮细胞损伤模型的建立 内皮细胞ECV-304血管内皮细胞以104个/孔接种于96孔培养板。用无血清培养基将H2O2配成 0、75、150、300、600、800 μmol·L-1剂量组,分别加入96孔板中,每孔100 μl,分别作用12、24、48 h 后,将上清弃掉,每孔加入100 μl培养基和20 μl MTT(5 g·L-1)作用 4 h,将上清弃掉,每孔加150 μl DMSO,微孔振荡器上振荡 10 min,570 nm 酶标仪下测细胞吸光度值(A)。细胞抑制率/%=(空白组吸光度值-各组吸光度值)(A)/空白组吸光度值(A)×100%
1.3.3 红车轴草总黄酮对H2O2损伤血管内皮细胞保护作用的时效关系研究 红车轴草总黄酮用DMSO溶解,用量为每1 mg药物加10 μl DMSO。内皮细胞ECV-304以104个/孔接种于96孔培养板,主要分以下两组实验:①红车轴草总黄酮对正常内皮细胞的影响:红车轴草总黄酮用无血清DMEM溶解,并将其配制成 12.5、25、50 mg·L-13 个剂量,正常对照组每孔100 μl无血清培养基,药物组每孔100 μl含药溶液,预孵育4 h后,MTT法检测细胞存活率。②红车轴草总黄酮对H2O2诱导的内皮细胞损伤的保护作用:正常对照组每孔加100 μl无血清培养基,红车轴草总黄酮 12.5、25、50 mg·L-1各剂量组分别预孵育2、4 h后,弃上清,加100 μl 300 μmol·L-1H2O2作用 24 h后,MTT法检测细胞存活率。细胞存活率/%=各组吸光度值(A)/空白组吸光度值(A)×100%。以确定红车轴草总黄酮保护H2O2诱导的血管内皮细胞损伤的最佳作用时间和作用浓度。
1.3.4 红车轴草总黄酮对H2O2诱导的血管内皮细胞损伤的保护作用 将细胞以2×105个/孔接种于6孔板,实验分为5组,正常对照组(control):每孔给予2 ml无血清培养基;模型组(model):每孔给予 2 ml终浓度为 300 μmol·L-1H2O2,作用 24 h;红车轴草总黄酮给药组(RCF):给予2 ml终浓度为12.5、25、50 mg·L-1的红车轴草总黄酮,孵育 4 h后,给予 2ml终浓度为 300 μmol·L-1H2O2作用 24 h。① 进行H33342和PI染色:加入2 ml终浓度为1 g·L-1的 Hoechst33342 和 PI,37 度孵箱孵育 15 min,PBS洗3次,荧光倒置显微镜下观察内皮细胞形态学;②检测细胞上清液中LDH的漏出量,细胞中SOD、CAT、GSH-Px的活力及 MDA的含量:收集各组上清以测LDH活力;消化收集各组细胞,每组加1 ml PBS,采取反复冻融的方法(-80°冰箱15 min,室温20 min,如此重复5次),至细胞破碎,内溶物流出,3 000 r·min-1离心 10 min,吸取上清,进行BCA蛋白定量,然后按试剂盒说明书进行 MDA、SOD、CAT、GSH-Px的含量测定;③ 检测内皮细胞Caspase-3活性:各组细胞经药物预孵育及H2O2损伤后,消化收集,计数并调整数目为1.5×106个/ml,加 50 μl Cell Lysis Buffer,冰上孵育 10 min,10 000 r·min-1离心1 min转移上清到新管中,每个样品加50 μl 2 ×Reaction Buffer(含终浓度 10 mmol·L-1的 DTT),每个样品再加 5 μl 4 mmol·L-1的DEVD-pNA(终浓度为 200 μmol·L-1)37℃ 孵育 1~2 h。405 nm分光光度计检测;④ 检测总ROS产量:各组细胞经药物预孵育及H2O2损伤后,Hanks液清洗1次,然后用500 μl carboxy-H2DCFDA(25 μmol·L-1)于 37°C 避光条件下孵育 30 min,置于倒置荧光显微镜下观察;⑤检测线粒体膜电位:将细胞以1×105个/孔接种于24孔板,各组处理过程同上(加药及H2O2体积为1 ml),细胞经药物预孵育及H2O2损伤后,用 PBS清洗2次。加入10 μl 200 μmol·L-1(终浓度 2 μmol·L-1)JC-1 在避光条件下孵育30 min,再用PBS清洗两遍后置于显微镜下观察JC-1标记的细胞,呈现绿色或橙红色。
1.4 统计学分析 采用统计软件包SPSS 11.5进行统计,实验数据以¯±s表示,各组间均数比较采用单因素方差分析,两样本比较采用配对t检验。
2 结果
2.1 H2O2诱导血管内皮细胞氧化损伤模型的建立 MTT实验结果显示:细胞抑制率随H2O2浓度的升高和作用时间的延长而增加,当150 μmol·L-1H2O2作用 48h 或 300 μmol·L-1H2O2作用 24 h(P<0.01)时其细胞抑制率达50%左右,为理想造模条件。综合考虑选用 300 μmol·L-1H2O2作用24 h作为最佳造模条件。结果如Fig 1所示。
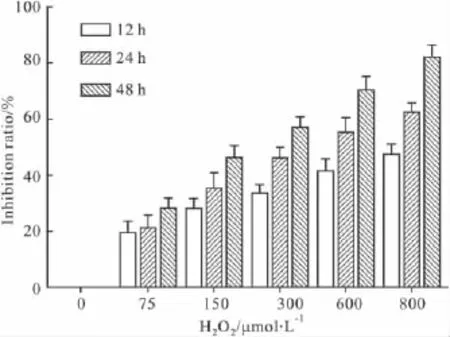
Fig 1 Effects of different concentrations and incubation time of H2O2on ECV-304 cells
2.2 红车轴草总黄酮单独给药对血管内皮细胞的影响 红车轴草总黄酮各剂量组(12.5、25、50 mg·L-1)预孵育4 h后细胞存活率分别为98.42% ±1.7%、97.60%±2.3%和97.71%±1.0%(¯±s,n=3),正常对照组细胞存活率为100%±1.6%±s,n=3),各给药组与对照组相比差异没有显著性(P>0.05),表明红车轴草总黄酮单给药对正常内皮细胞ECV-304没有损伤。
2.3 红车轴草总黄酮对H2O2损伤血管内皮细胞ECV-304的时效研究 红车轴草总黄酮预孵育2、4 h 后,加300 μmol·L-1H2O2作用24 h,细胞活力检测结果显示,与对照组相比,模型组细胞活力明显降低(P<0.01);与模型组相比,槲皮素组和红车轴草总黄酮(25、50 mg·L-1)组细胞活力明显提高(P<0.05,P<0.01),且红车轴草总黄酮对血管内皮细胞的保护作用呈剂量依赖性,与槲皮素组相比差异不具有统计学意义。与药物预孵育2 h相比,红车轴草总黄酮及槲皮素预孵育4 h后细胞活力明显提高(P<0.01)。因而红车轴草总黄酮的最佳预孵育时间为4 h。结果如Fig 2所示。
2.4 不同浓度红车轴草总黄酮对H2O2损伤血管内皮细胞ECV-304形态学影响 对照组的细胞数目较多,生长状态良好,细胞呈多角形或短梭形、饱满、大小一致;模型组的细胞数目明显减少,细胞皱缩变圆,间隙增大;与模型组相比,红车轴草总黄酮各剂量组细胞的形态均得到不同程度的改善,且呈剂量依赖性,大部分细胞呈多角形或短梭形,细胞间隙小,细胞皱缩明显减少。表明红车轴草总黄酮对内皮细胞ECV-304具有良好的保护作用。结果如Fig 3所示。
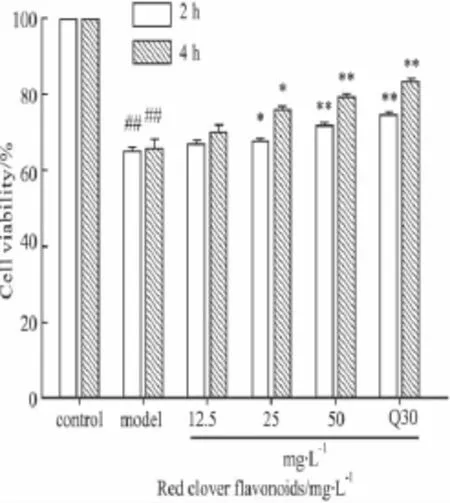
Fig 2 Red clover flavonoids on endothelial cells in

Fig 3 Effects of RCF on morphological changes inH2O2-treated ECV-304 cells
Tab 1Effects of RCF on lipid peroxidation and anti-oxidant enzyme activity(¯±s,n=3)

Tab 1Effects of RCF on lipid peroxidation and anti-oxidant enzyme activity(¯±s,n=3)
Q30 represents quercetin 30 mg·L-1.##P <0.01 vs control;*P <0.05,**P <0.01 vs model.
Group SOD/U·ml-1 MDA/nmol·ml-1protein LDH/U·L-1 CAT/U·mg-1protein GSH-Px/U·mg-1protein Control 17.33+0.092 5.64+0.093 319.4+6.18 28.38+0.23 80.03+0.64 Model 10.74+0.557## 7.60+0.189## 525.34+23.35### 16.42+0.88## 46.55+1.06##RCF(12.5 mg·L-1) 12.66+0.094* 6.89+0.057* 504.97+5.58 19.72+0.41* 51.65+1.53*RCF(25 mg·L -1) 15.41+0.214** 6.18+0.056** 464.04+5.01* 22.02+0.89* 60.85+1.24**RCF(50 mg·L-1) 16.55+0.365** 6.03+0.118** 408.21+2.60** 24.43+1.22** 71.19+0.98**Q(30 mg·L-1) 16.84+0.173** 5.72+0.131** 403.69+8.86** 25.61+1.27** 69.47+0.61**
Fig 4 Effects of RCF on H2O2-induced ECV-304 cells apoptosis
2.5 红车轴草总黄酮对H2O2损伤血管内皮细胞ECV-304凋亡情况的影响 H33342及PI染色结果显示,正常对照组细胞的细胞核呈完整椭圆形,细胞数目多,几乎无凋亡细胞;与对照组相比,模型组细胞核皱缩变形,细胞数目减少,凋亡细胞明显增多;与模型组相比,RCF(12.5、25、50 mg·L-1)及槲皮素预孵育组细胞核形态较完整,细胞数目较多,凋亡细胞较少。且RCF对内皮细胞抗H2O2损伤的作用具有剂量依赖性。结果见Fig 4。统计3次实验结果,对照组、模型组、RCF 各剂量组(12.5、25、50 mg·L-1)的细胞凋亡率分别为 2.06% ±0.51%、33.92% ±1.35%、12.68% ±1.36、7%.96% ±0.88%和3.54%±0.80%(¯±s,n=3),与对照组相比,模型组细胞凋亡率升高(P<0.001);与模型组相比,RCF各剂量组的细胞凋亡率降低(P<0.01,P<0.001),说明RCF预孵育可显著降低细胞凋亡率而较好地保护内皮细胞。
2.6 不同浓度红车轴草总黄酮对H2O2损伤血管内皮细胞ECV-304酶活力的影响 与正常对照组相比,H2O2模型组加剧细胞膜的脂质过氧化反应,LDH从内皮细胞漏出增加,内源性抗氧化酶(SOD、CAT、GSH-Px)活性降低,MDA含量升高。与H2O2模型组相比,RCF和槲皮素预孵育组LDH漏出量减少,SOD、CAT、GSH-Px活性升高,MDA 含量下降。结果如Tab 1所示。
2.7 不同浓度红车轴草总黄酮对H2O2损伤血管内皮细胞ECV-304线粒体膜电位的影响 统计3次线粒体膜电位检测实验结果,对照组、模型组、RCF 各剂量组(12.5、25、50 mg·L-1)细胞的红色荧光/绿色荧光的荧光强度比率分别为100% ±9.1%、65% ±6.2%、71% ±8.4%、83% ±9.7%、91%±7.7%(¯±s,n=3)。与对照组相比,模型组线粒体膜电位显著降低(P<0.01);与模型组相比,红车轴草总黄酮各剂量组线粒体膜电位升高(P<0.01),且红车轴草总黄酮各剂量组对线粒体膜电位的作用具有剂量依赖性。结果如Fig 5所示。
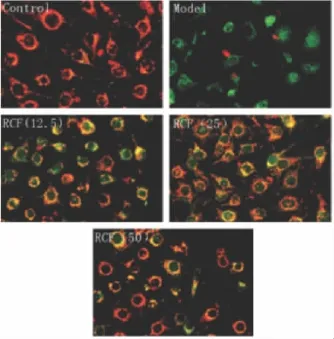
Fig 5 Effects of RCF on H2O2-induced mitochondrialtransmembrane potential in ECV-304 cells
2.8 红车轴草总黄酮对内皮细胞内ROS表达水平的影响 根据实验统计结果得知,对照组、模型组、RCF 各剂量组(12.5、25、50 mg·L-1)细胞中 ROS阳性细胞率分别为10% ±4.1、60% ±8.2、43% ±5.8、34%±6.9和22%±4.0(¯±s,n=3)。与对照组相比,模型组中ROS水平升高(P<0.01);与模型组相比,预孵育不同浓度的红车轴草总黄酮能够抑制细胞内由H2O2诱导的ROS高表达,使ROS水平降低(P<0.01),且呈剂量依赖性。结果如Fig 6所示。

Fig 6 Effects of RCF on intracellular ROSproduction in ECV-304 cells
2.9 红车轴草总黄酮对H2O2损伤血管内皮细胞ECV-304 caspase-3活性的影响 Caspase-3活性的结果显示,与对照组相比,模型组中活化的Caspase-3水平升高(P<0.001);与模型组相比,红车轴草总黄酮(25、50 mg·L-1)预孵育组的 Caspase-3水平均有不同程度的降低,且红车轴草总黄酮对Caspase-3活性降低的作用具有剂量依赖性。实验结果表明,红车轴草总黄酮抗凋亡作用可能与其调节Caspase级联反应的激活有关。结果如Fig 7所示。
3 讨论
血管内皮细胞的凋亡与动脉粥样硬化的发生发展密切相关,是动脉粥样硬化的始动因素[8]。活性氧自由基是内皮细胞损伤的主要原因之一。H2O2是机体产生的活性氧,在过氧化条件下能分解成氧自由基,通过对生物膜中多不饱和脂肪酸的过氧化引起细胞损伤,最终形成动脉粥样硬化斑块。据此本实验建立了以H2O2为刺激因素的内皮细胞氧化损伤模型。
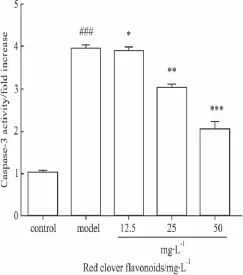
Fig 7 Caspase-3 activity(fold increase)of endothelial cells in different groups(¯ ± s ,n=3)
脂质过氧化对内皮细胞有明显的损伤作用,因此,具有抗脂质过氧化能力的药物,也可达到防治动脉粥样硬化的目的。LDH是胞内酶,漏出量的多少可反映细胞膜的受损程度;内皮细胞MDA量的变化可反映内皮细胞产生ROS的情况[9]。同时细胞内存在一个包括SOD、CAT、GSH-Px等酶在内的内源性抗氧化体系,他们通过代谢转化来清除ROS。GSH-Px氧化还原循环是内皮细胞中最重要的H2O2-解毒体系[10]。本实验发现,与对照组相比,H2O2模型组内皮细胞的LDH漏出量和MDA的含量显著增加,而抗氧化酶(SOD、MDA、GSH-Px)的活性显著降低,不能清除瞬间产生的大量的ROS,从而导致H2O2模型组的ROS水平升高,这一点与检测ROS的实验结果一致。而红车轴草总黄酮的预作用可抑制H2O2的损伤作用,使LDH漏出量和MDA含量降低,内皮细胞中SOD、CAT和GSH-Px的活力增强,胞内ROS的水平降低,提示红车轴草总黄酮可能是通过增强脂质抗氧化酶活性而拮抗氧化应激诱导的内皮细胞损伤。
线粒体在内皮细胞凋亡中发挥着核心的作用[11]。在线粒体调控的凋亡过程中最早期的变化就是线粒体膜的改变,这表现为线粒体跨膜电位的降低和线粒体膜通透性的改变[12]。本实验采用JC-1荧光探针法检测细胞的线粒体膜电位,结果显示,模型组线粒体膜电位显著降低,细胞凋亡比例显著升高,这与模型组的PI染色凋亡统计结果一致。而红车轴草总黄酮预处理组可抑制H2O2损伤引起的膜电位的降低,细胞凋亡比例降低,这种保护作用在RCF50 mg·L-1时最明显,且具有剂量依赖性。结果表明红车轴草总黄酮可能通过稳定线粒体膜电位来发挥保护内皮的作用。
氧化应激可诱发Caspase-3及其他许多不同激酶的活化[13],而Caspase-3是导致凋亡的最重要的凋亡执行蛋白酶[14]。有研究表明,Caspase-3活化与H2O2诱导的内皮细胞的凋亡相关[15]。本实验中,模型组Caspase-3活性显著升高,细胞大量凋亡,而红车轴草总黄酮处理组可抑制H2O2引起的Caspase-3活性的升高,剂量依赖性减少凋亡细胞数目。结果表明红车轴草总黄酮通过抑制Caspase-3的活化而抑制细胞凋亡。
总之,本实验结果表明H2O2可诱发ECV-304细胞产生凋亡,而红车轴草总黄酮预处理可抑制细胞凋亡,保护内皮细胞。红车轴草总黄酮的这种保护作用可能与其增强体内抗氧化性应激系统、清除氧自由基、抗脂质过氧化、降低Caspase-3的活性及稳定线粒体膜电位有关。
近年来研究表明,血管内皮细胞功能损害是心血管疾病早期的重要特征,是促进动脉粥样硬化最重要的始动因素[16],因而寻找抗内皮细胞凋亡和保护内皮细胞功能的药物是防治心血管疾病的重要思路。本实验虽然对红车轴草总黄酮对内皮细胞的保护作用及其机制做了初步探究,但仍需进行大量的体内和体外实验,进一步深入研究药物作用机制,才能为其在临床的开发应用提供可靠的科学依据,并有望将其开发成新的临床治疗心血管疾病的药物。
[1] Wang Y K,et al.Curculigoside attenuates human umbilical vein endothelial cell injury induced by H2O2[J].J Ethnopharmacol,2010,132:233-9.
[2] Griendling K K,FitzGerald G A.2003a.Oxidative stress and cardiovascular injury.PartⅡ[J].Animal and human studies Circ,108,2034-40.
[3] Griendling K K,FitzGerald G A.2003b.Oxidative stress and cardiovascular injury.Part I.Basic mechanisms and in vivo monitoring of ROS[J].Circulation,108,1912 - 6.
[4] 刘宝剑,郭延生,刁鹏飞,等.红车轴草总黄酮清除自由基作用的研究[J].天然产物研究与开发,2009,21:44-7.
[4] Liu B J,Guo Y S,Diao P F,et al.Free Radical scavenging effect of total flavonoids from red clover[J].Nat Prod Res Dev,2009,21:44-7.
[5] Liu Y,Liu S H,Wang P.Advance in researches on red clover[J].Chin Tradit Herbal Drugs,2007,38:801 -4.
[6] Wu J H,Li Q,Wu M Y,et al.Formononetin,an isoflavone,relaxes rat isolated aorta through endothelium-dependent and endo-thelium-independent pathways[J].J Nutrit Biochem,2010,21(7):613-20.
[7] Teede H J,McGrat h B P,DeSilva L,et al.Isoflavones reduce arterial stiffness:a placebo-controlled study in men and postmenopausal women[J].Arter Thromb Vasc Biol,2003,23:1066-71.
[8] Xu Z R,Hu L,Cheng L F,et al.Dihydrotestosterone protects human vascular endothelial cells from H2O2-induced apoptosis through inhibition of caspase-3,caspase-9 and p38 MAPK[J].Eur J Pharmacol,2010,643:254 -9.
[9] 何 玲,孙桂波,孙 潇,等.木樨草苷对阿霉素诱导乳鼠心肌细胞损伤的保护作用[J].中国药理学通报,2012,28(9):1229-34.
[9] He L,Sun G B,Sun X,et al.The protective effects of Luteoloside against adriamycin-induced injury in suckling mouse myocardial cells[J].Chin Pharmacol Bull,2012,28(9):1229 -34.
[10] Andreoli S P,Mallett C P,Bergstein J M.1986.Role of glutathione in protecting endothelial cells against hydrogen peroxide oxidant injury[J].J Laborat Clin Med,108,190 -8.
[11] Lee Y,Gustafsson A B.2009.Role of apoptosis in cardiovascular disease[J].Apoptosis,14:536 - 48.
[12]姜仕先,董乃维,张 婧.藤茶中杨梅素和二氢杨梅素的分离及抗心肌细胞凋亡作用[J].哈尔滨医科大学学报,2008,1(42):4-6.
[12] Jiang S X,Dong N W,Zhang J.Separation of myricetin and dihydromyricetin in Ampelopsis grossedentata and their inhibition of cadiomyocyte apoptosis[J].J Harbin Med Univ,2008,1(42):4-6.
[13] Andersson Y,Le H,Juell S,Fodstad O.2006.AMP-activated protein kinase protects against anti-epidermal growth factor receptor-Pseudomonas exotoxin A immunotoxin-induced MA11 breast cancer cell death[J].Molecular Cancer Therapeutics,5,1050 -9.
[14] Green D R,Reed J C.1998.Mitochondria and apoptosis[J].Sci,281,1309 -12.
[15] Hermann C,Zeiher A M,Dimmeler S.1997.Shear stress inhibits H2O2-induced apoptosis of human endothelial cells by modulation of the glutathione redox cycle and nitric oxide synthase[J].Arteriosclerosis Thrombosis and Vascular Biol,17,3588 -92.
[16] Ribeiro F,Alves A J,Teixeira M,et al.Endothelial function and atherosclerosis:circulatory markers with clinical usefulness[J].Rev Port Cardiol,2009,28(10):1121 - 51.