G-CSF对大鼠烧伤合并海水浸泡后内皮祖细胞的影响
2013-12-07管云枫徐添颖缪朝玉
王 培,管云枫,徐添颖,缪朝玉
随着军事斗争准备不断深入,必须加强对未来的海上作战救治的研究。在海上及登陆作战时,可出现大批量的烧伤伤员,而且落水的可能性极大。海水具有高渗、高钠、低温的特点,烧伤后海水浸泡可引起严重的全身损害,并可进一步发展为多脏器功能障碍综合征,从而危及生命。
内皮祖细胞(endothelial progenitor cells,EPC)是近10年来发现的一种内皮系起源的祖细胞,其主要的生理功能是在发生创伤后趋化到创面,然后分化、增殖形成内皮细胞,修复血管,从而为器官、组织的最终修复提供血流输供[1]。因此,EPC的数量和功能与血管修复能力及创面的愈合都有着密切的关系,EPC在烧伤合并海水浸泡后的变化可反映战伤后的血管修复能力。但是,该方面的内容国内外均未见报道。故本研究以大鼠烧伤后合并海水浸泡模型观察模型早期EPC的数量变化,以及使用粒细胞集落刺激因子(G-CSF)对EPC数量的影响。
1 材料与方法
1.1 动物及分组 8周龄SD大鼠26只[上海中科院动物中心提供,许可证SCXK(沪)2003-0004],雄性,体重250~300 g。随机分为①对照组(n=6);②烧伤合并海水浸泡模型组(n=10):致伤后浸泡在人工配制的海水中3 h后捞出;③实验组(n=10):致伤后于海水浸泡3 h后下肢肌肉注射G-CSF(5 μg/kg)。各组大鼠在体重、鼠龄上无差异,造模后,分别在30 min、2 h、6 h和24 h从大鼠眼内眦球后静脉丛各取血0.5 ml,置于EDTA抗凝管。
1.2 人工海水的配制 按照国家海洋局第三海洋研究所提供的我国东南沿海海水成分配制,渗透压1250 ~1350 mmol/L,pH 值 8.2,比重 1.05 ~1.06。实验室温度25℃,人工海水温度23~25℃。
1.3 动物模型制作 实验动物伤前12 h禁食,采用10%水合氯醛(3 mg/kg)腹腔注射麻醉。于背部30%区域剪毛备皮,用3%凝固汽油均匀涂擦,燃烧15 s后湿巾灭火,致30%背部区域的Ⅱ度烧伤。烧伤合并海水浸泡组致伤后将动物置于固定架上,浸泡于人工海水中3 h,浸泡平面达剑突。
1.4 单个核细胞(PMBCs)分离 使用Ficoll(Amersham-Pharmacia公司,美国)梯度离心从外周血分离单个核细胞。首先将外周血与等量0.01 mol/L磷酸盐缓冲液(pH:7.2)混匀,缓慢加至淋巴细胞分离液(2∶3)中,室温下梯度离心。离心半径15 cm,2400 rpm/min离心20 min,然后分离、收集单个核细胞层(淋巴细胞分离液与血浆中间的灰白色细胞层)。以含有1%牛血清白蛋白的磷酸盐缓冲液冲洗3遍,再悬浮于0.1 ml上述缓冲液中。
1.5 双色荧光标记流式细胞术检测血EPC的数量
根据表面标记为干细胞抗原-1(stem cell antigen-1,Sca-1)阳性以及血管内皮生长因子受体2(vascular endothelial growth factor,VEGFR 2)阳性来确定血EPC数量。首先使用红细胞裂解液裂解红细胞(15 min)。然后加入10 μl异硫氰酸荧光素(FITC)标记的山羊抗大鼠Sca-1抗体和10 μl藻红蛋白(PE)标记的山羊抗大鼠VEGFR 2抗体[2]。室温避光孵育2 h单个核细胞。以同型的IgG-FITC或IgG-PE染色作为阴性对照。每份标本检测105个细胞,获得流式细胞散点图,从中圈选单个核细胞散点区,对所圈选的单个核细胞进行分析,计数FITC和PE双阳性细胞比例,反映EPC数量变化。
1.6 统计学处理 采用SPSS 13.0软件进行统计分析。数据以均数±标准差(±s)表示,组间比较用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 烧伤合并海水浸泡对血EPC数量的影响 烧伤合并海水浸泡使血EPC数量显著降低(P<0.05,表1)。
2.2 G-CSF对抗烧伤合并海水浸泡对血EPC数量的影响 G-CSF在造模后2 h、6 h和24 h均显著改善烧伤合并海水浸泡后血液中EPC数量下降趋势(P<0.05),但造模30 min后对血EPC的数量影响不大(表1)。
3 讨论
烧伤致死主要是因创面经久不愈,以及感染导致的多脏器功能衰竭。目前公认其发病机理是严重烧伤后引发过度应激又发生自身毁损炎症反应,严重者或继发感染者则并发脏器功能障碍或衰竭。烧伤创面的修复反映了从血管损伤、通透性增加,到新生血管形成及过度增殖的变化过程,临床表现为液体渗出、创面愈合、瘢痕形成等。修复过程复杂,影响因素众多,极易产生不良后果[2-5]。在海上作战,烧伤还往往伴有其他复合伤。若伤病员落水,被海水浸泡后,其感染几率更高,生存率则更低[4-6]。内皮细胞早已被证明在烧伤的愈合中具有重要意义[6-9]。烧伤合并海水浸泡可以严重损害内皮功能[10]、凝血功能[11],最终导致创面的微循环障碍[12]。
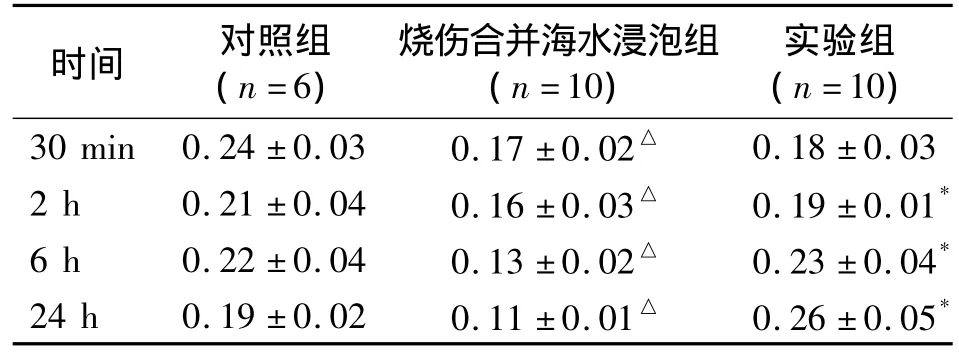
表1 各组血EPC实验结果(%)
EPC是一类存在于骨髓和全身循环血液中,能增殖、分化为血管内皮细胞,但尚未成熟为血管内皮细胞表型,也未形成血管的前体细胞[13-15]。大量国内外研究发现,EPC不仅参与血管形成,同时也参与出生后血管生成和内皮损伤后的修复。但是EPC的功能在烧伤中的作用则远未为人所知。最近3~5年以来,开始有EPC在烧伤中的作用的零星报道。2006年,谢松涛等[16]对烧伤患者脐血来源的EPC进行纯化鉴定及定向分化,发现EPC具有分化为成熟血管内皮细胞的能力,并且参与了血管重建,具有促进血管新生、加速缺血组织血管化的作用。Fox等[17]随后在2008年发现在烧伤72 h后,EPC数量明显增加。但是随后 Groger等[18]和 Foresta等[19]分别发现了烧伤可以使早期(24 h)的血EPC数量明显降低。而且,EPC数量下降最明显的那些烧伤患者,预后最差,死亡率最高[19]。笔者猜测这种差异可能是因为时间点选择的不同:烧伤后24 h和72 h EPC的动员可能完全不一样,烧伤后24 h,为骨髓中储存着的EPC动员入血;而在72 h后,则可能是经过烧伤应激后大量增殖形成的新EPC动员入血。本文发现,在烧伤合并海水浸泡后24 h,大鼠的血EPC数量明显低于对照组,和Groger等[18]和Foresta 等[19]的结果基本一致。
G-CSF属于造血生长因子,随着基因工程技术的发展,国内外许多重组的造血生长因子已投入生产[20]。G-CSF主要来源于巨噬细胞、内皮细胞及纤维母细胞,能高度特异性地刺激中性粒细胞系的前体细胞存活。早在1995年,曹丽萍等[21]就发现了烧伤患者的G-CSF浓度增高。G-CSF的增高有利于中性粒细胞的动员、增加,从而有利于抑制感染,提高患者生存率。目前,G-CSF在临床上已成为烧伤的常用药[22]。但是,增加中性粒细胞的数量可能并不是促进G-CSF对烧伤患者愈合作用的唯一机制。从本实验结果来看,G-CSF显著增加了血中的EPC数量,直接影响了新生内皮细胞的数量和在创伤局部的聚集。因此,EPC的数量无疑可以极大地影响烧伤合并海水浸泡的预后。据此可以初步推测:G-CSF的应用会增加EPC的数量,而这种量的增加作用可能有利于烧伤、烧伤合并海水浸泡的创面恢复。
综上所述,大鼠烧伤、烧伤合并海水浸泡复合伤时,血EPC数量在24 h内下降明显。而G-CSF的使用可逆转这种趋势,增加EPC数量,从而有利于创面愈合,增加血液EPC数量可能是G-CSF在烧伤合并海水浸泡治疗中显效的重要机制之一。
[1] Urbich C,Dimmeler S.Endothelial progenitor cells[J].Circulation Research,2004,95(4):343-353.
[2] Wang P,Xu TY,Guan YF,et al.Nicotinamide phosphoribosyltransferase protects against ischemic stroke through SIRT1-dependent adenosine monophosphate-activated kinase pathway[J].Ann Neurol,2011,69(2):360-374.
[3] 阮 兢,郑庆亦,陈锦河,等.成批烧伤的卫勤组织与临床救治[J].东南国防医药,2011,13(1):5-7.
[4] 李 勇,李国华,李明华.海水浸泡伤早期救治原则[J].临床军医杂志,2008,12(6):12-17.
[5] 李卫东,宋 斌.海上联合作战卫勤保障的主要特点与对策[J].海军医学杂志,2007,28(3):230-232.
[6] 宗 林,倪洋林,王玉秀,等.光棒及纤维支气管镜在头面部烧伤插管中的应用[J].东南国防医药,2011,13(5):393-395.
[7] An J,Li A,Yang Z,et al.Dynamic changes of fibrinopeptides A and B in sera of burn patients and their effects on vascular endothelial cells[J].Burns,1994,20(2):128-131.
[8] Infanger M,Schmidt O,Kossmehl P,et al.Vascular endothelial growth factor serum level is strongly enhanced after burn injury and correlated with local and general tissue edema[J].Burns,2004,30(4):305-311.
[9] 晏 泽.烧伤后一氧化氮,内皮素动态变化与烧伤的关系[J].医学综述,1999,5(4):180-183.
[10]闫 红,赖西南,葛衡江.两种复合战伤合并海水浸泡对血管内皮细胞损伤的比较研究[J].中华航海医学与高气压医学杂志,2003,10(3):133-135.
[11]闫 红,赖西南,葛衡江.战伤合并海水浸泡对内皮细胞凝血功能的影响[J].中华航海医学与高气压医学杂志,2006,13(2):121-123.
[12]马 军,王甲汉,李志清,等.大鼠烫伤合并海水浸泡后创面病理学改变的特点[J].南方医科大学学报,2009,29(6):1297-1299.
[13] Urbich C,Dimmeler S.Endothelial progenitor cells:characterization and role in vascular biology[J].Circ Res,2004,95(4):343-353.
[14]周音频,黄 岚.血管内皮祖细胞动员在损伤血管修复中的作用及调控因素[J].中国动脉硬化杂志,2004,12(2):233-234.
[15]喻 杨,黄 岚.内皮祖细胞功能状态及其调节[J].中华心血管病杂志,2007,35(11):1067-1069.
[16]谢松涛,陈 璧,陶 克.人脐血来源内皮祖细胞的纯化鉴定及定向分化的研究[J].中华烧伤杂志,2006,22(5):355-358.
[17] Fox A,Smythe J,Fisher N,et al.Mobilization of endothelial progenitor cells into the circulation in burned patients[J].Br J Surg,2008,95(2):244-251.
[18] Groger A,Piatkowski A,Grieb G,et al.The mobilisation of mononuclear cells and endothelial progenitor cells after burn injury in a porcine model[J].Burns,2010,36(4):545-551.
[19] Foresta C,Schipilliti M,De Toni L,et al.Blood levels,apoptosis,and homing of the endothelial progenitor cells after skin burns and escharectomy[J].J Trauma,2011,70(2):459-465.
[20]李 静,陶维良,魏世东,等.重组人粒细胞集落刺激因子(rhG-CSF)的安全性与临床评价[J].中国医院用药评价与分析,2008,8(7):484-486.
[21]曹丽萍,邓诗琳.烧伤后血粒细胞集落刺激因子的变化及其与感染的关系[J].中华外科杂志,1995,33(7):403-405.
[22]张道坤,郑国平,杨建秋,等.粒细胞巨噬细胞集落刺激因子在烧伤治疗中的应用进展[J].中华烧伤杂志,2009,25(4):316-318.
