两种苦瓜藤多糖提取工艺的比较分析
2013-12-06曾哲灵奚光兴葛晓环
曾哲灵,奚光兴,葛晓环
(1.南昌大学食品科学与技术国家重点实验室,江西南昌330047;2.南昌大学环境与化学工程学院,江西南昌330031;3.南昌大学生命科学与食品工程学院,江西南昌330031)
苦瓜又名凉瓜,是葫芦科植物,为一年生攀缘草本。苦瓜的多个部位都能入药,苦瓜藤能清热解毒,治痢疾、疮毒、胎毒、牙痛。《四川中药志》就有记载:“性凉,味苦,无毒。”入脾、胃二经。苦瓜含有多种有效成分,其中苦瓜多糖药用价值很高,具有提高免疫力、降血糖、抑菌、抗氧化、抗肿瘤、抑制艾滋病毒HIV的表面活性等作用[1-7]。常见的多糖提取方法有热水浸提法、酸浸提法、碱浸提法、酶法等[8-13]。热水浸提法是一种比较普遍的天然有机物的提取方法,但是耗能费时,且对热敏性的天然物质具有一定的破坏作用,是一种局限性非常大的提取方法;而酸碱提法对有机物质的结构破坏性比较强,也不利于天然物质的开发利用;酶法提取则成本较高,难以回收利用。因此,有必要开发一种高效、节能、绿色的多糖提取方法。天然植物的有效成分大多为细胞内物质,提取时需将植物细胞破碎,现有的机械破碎法难以实现细胞的有效破碎,化学方法容易造成被提取物的结构性质变化,因而很难达到理想效果。超声波提取技术逐渐兴起,其操作简单快速、多糖提取率高、速度快、效果好,且多糖结构被破坏作用小的优势日益突出。超声波提取应用于多种多糖的提取也早有报道,但其应用于苦瓜藤多糖的提取却未见报道。本文优化了超声波提取苦瓜藤多糖的工艺条件,并与传统方法作比较,以期得出一个最优的苦瓜藤多糖提取工艺参数,为进一步研究苦瓜藤多糖的药效和结构组成提供一定的理论支持,促进苦瓜藤的开发利用。
1 材料与方法
1.1 材料与仪器
苦瓜藤 购自农村;牛血清蛋白 购自美国Sigma公司;葡萄糖、考马斯亮蓝G-250、磷酸、苯酚、浓硫酸、盐酸溶液、氢氧化钠、无水乙醇等试剂 皆为国产分析纯。
KQ5200E型超声波清洗器(40KHZ,200W) 昆山超声仪器有限公司;HH恒温水浴箱 中大仪器厂;765pc型紫外-可见分光光度计 上海光谱仪器有限公司;R系列旋转蒸发仪 上海申生科技有限公司;SHB-Ⅲ循环水式多用真空泵 郑州长城科工贸有限公司。
1.2 实验方法
1.2.1 苦瓜藤多糖的提取工艺流程 新鲜的苦瓜藤晒干后,剪成2~3cm的小段,粉碎机粉碎,60℃条件下烘干至无游离水,取一定量的苦瓜藤藤粉末,按一定条件超声波提取后,离心取上清液,过滤,50℃真空旋转浓缩提取液,加入4倍体积的无水乙醇,4℃下醇沉8~12h,醇沉两次,离心,乙醚洗涤,烘干,得苦瓜藤粗多糖。
1.2.2 葡萄糖标准曲线的制备[14-15]准确称取105℃烘至恒重的葡萄糖标品1g,蒸馏水定容至1L,移取2mL,用25mL的容量瓶定容,得0.08mg/mL葡萄糖标液。分别吸取0.0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6mL葡萄糖标液于25mL比色管中,补足蒸馏水至2.0mL,加1.0mL 6%苯酚,再加入5.0mL浓硫酸,摇匀,静置冷却至室温,在490nm处测定吸光度值。以葡萄糖浓度为横坐标,吸光度值为纵坐标,绘制葡萄糖标准曲线。葡萄糖含量与吸光度值经回归处理,回归方程为:A=14.373C-0.0133,R2=0.9969(n=8),糖含量在8~64μg线性良好,见图1。

图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
1.2.3 苦瓜藤多糖得率的测定[16]取提取液上清液,过滤,定容至250mL,分别吸取0.1mL提取液,补足水至2.0mL,测定吸光度值,根据测得的吸光度值A,参照葡萄糖标准曲线,计算出多糖浓度,进而得到得率。

1.2.4 超声波提取单因素实验
1.2.4.1 提取温度 准确称取5.0g苦瓜藤粉末5份,料液比为1∶40(g/mL),pH为7,分别取30、40、50、60、70℃,超声提取20min,离心取上清液,过滤,计算多糖得率,每个因素做四个平行。
1.2.4.2 料液比 准确称取5.0g苦瓜藤粉末5份,温度为60℃,pH为7,料液比分别为1∶20、1∶30、1∶40、1∶50、1∶60(g/mL),超声20min,余下操作如1.2.4.1。
1.2.4.3 提取时间 准确称取5.0g苦瓜藤粉末5份,温度为60℃、料液比1∶30(g/mL),pH为7,分别超声10、20、30、40、50min,之后操作如1.2.4.1。
1.2.4.4 pH 准确称取5.0g苦瓜藤粉末5份,温度60℃、料液比1∶30(g/mL)、超声时间30min,研究不同pH条件3、5、7、9、11下的多糖提取得率,余下操作如1.2.4.1。
1.2.5 苦瓜藤多糖超声波提取的正交实验设计[17]在单因素实验的基础上进行L9(34)正交实验,因素水平表见表1。

表1 超声波提取苦瓜藤多糖正交实验因素水平表Table 1 Factors and levels in orthogonal array design of ultrasound-assisted extraction
1.2.6 热水提取法单因素实验 设计热水提取法单因素实验,并优化工艺,比较分析两种提取方法的优劣。以料液比、提取时间、提取温度这3个单因素为研究目标。
1.2.6.1 料液比 准确称取5.0g苦瓜藤粉末5份,温度70℃,料液比分别为1∶20、1∶30、1∶40、1∶50、1∶60(g/mL),热水提取90min,之后操作如1.2.4.1。
1.2.6.2 时间 准确称取5.0g苦瓜藤粉末5份,温度70℃、料液比1∶50(g/mL),分别浸提30、60、90、120、150min,之后操作如1.2.4.1。
1.2.6.3 温度 准确称取5.0g苦瓜藤粉末5份,料液比1∶50(g/mL)、浸提时间90min,分别在50、60、70、80、90℃条件下提取,之后操作如1.2.4.1。
1.2.7 苦瓜藤多糖热水提取的正交实验设计 根据单因素实验结果,设计L9(33)正交实验,因素水平表见表2。

表2 热水提取苦瓜藤多糖正交实验因素水平表Table 2 Factors and levels in orthogonal array design of hot-water extraction
1.2.8 超声波提取法与热水提取法的比较 分别取5.0g苦瓜藤粉末2份,分别用超声波与热水提取的最佳工艺各提取2次,测定其多糖浓度,得出多糖得率,比较两种方法的提取效率。
1.3 统计分析
各组实验数据平行4次,结果以平均值±标准偏差的形式表示。数据采用Graph Pad Prism(5.01版)进行分析,结果显示单因素数据的p值<0.05,具有统计显著性。采用正交助手Ⅱ(3.1版)对正交实验结果进行直观、极差和显著性分析。
2 结果与分析
2.1 超声波提取实验结果
2.1.1 单因素实验结果
2.1.1.1 提取温度对苦瓜藤多糖得率的影响 由图2可见,苦瓜藤多糖得率随着温度的升高而上升,但到达60℃时趋于平缓,考虑到在高温下部分多糖分子会发生键的断裂,结构破坏,其活性会遭到破坏。同时过高的温度对设备要求较高,耗能大,故温度选在60℃为宜。
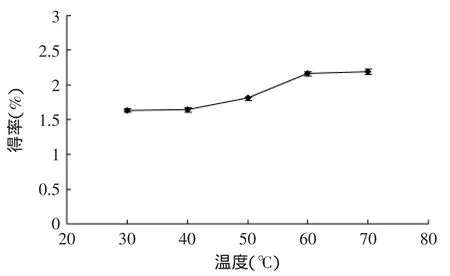
图2 温度对苦瓜藤多糖得率的影响Fig.2 Effect of ultrasound extracting temperature on the polysaccharide yield
2.1.1.2 料液比对苦瓜藤多糖得率的影响 由图3可知,苦瓜藤多糖的得率随着料液比先增高后下降,在1∶30(g/mL)达到最大。1∶30(g/mL)以后提取率下降的原因,可能是料液比过大,会增加超声波破碎细胞的阻力,使细胞破碎程度下降,降低多糖的提取率;如果料液比过小,又没有足够的水溶解出苦瓜藤多糖,也会使提取率降低[18]。故料液比宜取1∶30(g/mL)。

图3 料液比对苦瓜藤多糖得率的影响Fig.3 Effect of ultrasound ratio of solid to liquid on the polysaccharide yield
2.1.1.3 超声时间对苦瓜藤多糖得率的影响 由图4可知,随着时间的增长,提取率逐渐上升,到30min时达到最大,时间再增加时提取率又会下降,造成这一现象的原因可能是超声波作用的时间过长,也会使得部分多糖的高分支结构受到破坏,使其溶于水的特性消失[18],从而降低了多糖提取率。故时间宜取30min。
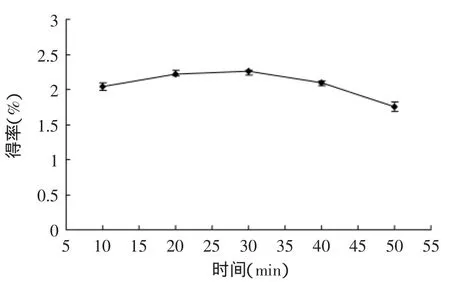
图4 超声时间对苦瓜藤多糖得率的影响Fig.4 Effect of ultrasound extraction time on the polysaccharide yield
2.1.1.4 pH环境对苦瓜藤多糖得率的影响 由图5可见,多糖得率随着pH增加而升高,可见多糖在酸性环境下不稳定,结构易变化,或分解,造成提取率降低,而在碱性环境下比较稳定,但是,过碱的环境对多糖的品质会有一定的影响,且多糖得率从pH为7时增幅就不大,故pH宜取7。
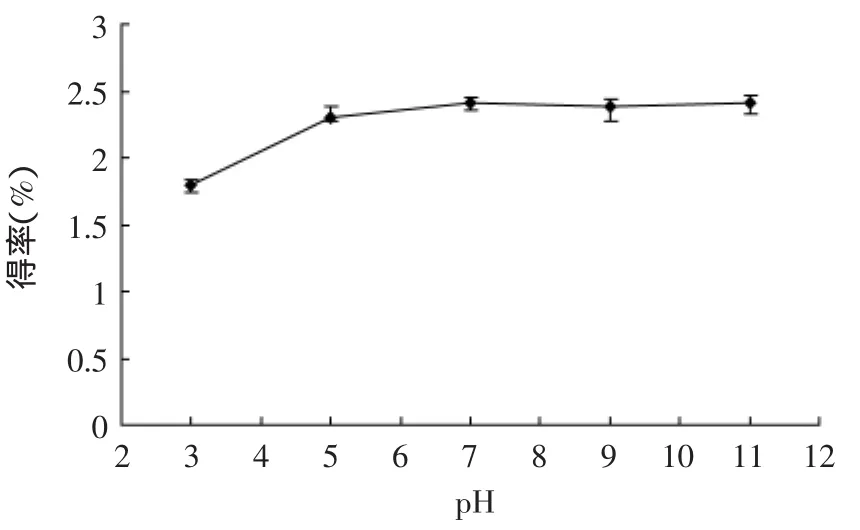
图5 pH对苦瓜藤多糖得率的影响Fig.5 Effect of ultrasound extraction pH on the polysaccharide yield
2.1.2 超声波提取正交实验结果 超声波提取苦瓜藤多糖正交实验结果见表3。
由表3可知,四因素对苦瓜藤多糖得率的影响大小为:A>C>D>B,即温度>超声时间>pH>料液比。其最佳提取工艺参数为A3B3C3D3,但由于pH和料液比为次要因素,为节约成本考虑,调整pH为7,料液比为1∶30(g/mL),其组合为A3B2C3D2。与A3B3C3D3做验证性比较,结果表明,A3B2C3D2的得率为2.36%,A3B3C3D3得率为2.38%,而表中A3B1C3D2的得率为2.35%。由此可见,从提取率和能源节约两方面综合考虑,A3B1C3D2可为最优提取工艺。根据最优提取工艺分别提取1、2、3次,结果表明,一次提取率为2.35%,两次提取混合液为提取率为3.08%,三次提取混合液为3.44%,三次提取增幅很小,出于经济因素考虑,取2次提取为宜,因此,超声提取苦瓜藤多糖的最优工艺为:提取温度65℃、料液比1∶25(g/mL)、超声时间35min、pH为7,浸提2次。

表3 正交实验结果Table 3 Orthogonal array design results of ultrasound-assisted extraction
2.2 热水提取实验结果
2.2.1 单因素实验结果
2.2.1.1 料液比对苦瓜藤多糖得率的影响 由图6可知,苦瓜藤多糖的得率随着料液比先增高后下降,在1∶50(g/mL)达到最大。1∶50(g/mL)以后提取率略有下降,如果料液比过小,又没有足够的水溶解出苦瓜藤多糖,也会使提取率降低。故料液比宜取1∶50(g/mL)。
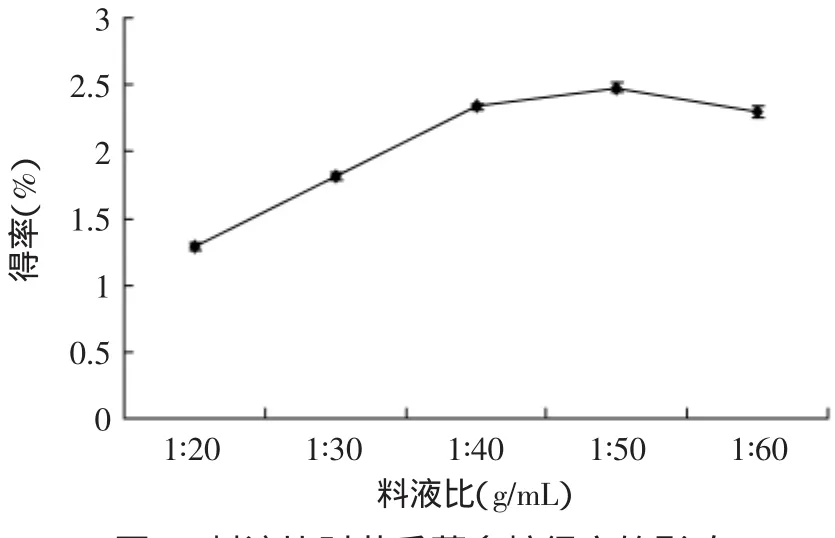
图6 料液比对苦瓜藤多糖得率的影响Fig.6 Effect of ratio of solid to liquid on the polysaccharide yield
2.2.1.2 浸提时间对苦瓜藤多糖得率的影响 由图7可知,随着时间的增长,提取率逐渐上升,到90min时达到最大,时间再增加时提取率又会下降,造成这一现象的原因可能是热提时间会使得部分多糖的高分支结构受到破坏,使其溶于水的特性消失,从而降低了多糖提取率[18]。故时间宜取90min。

图7 热提时间对苦瓜藤多糖得率的影响Fig.7 Effect of extraction time on the polysaccharide yield
2.2.1.3 提取温度对苦瓜藤多糖得率的影响 由图8可见,苦瓜藤多糖得率随着温度的升高而先升后降,在70℃时提取率最高,在高温下部分多糖分子会发生键的断裂,结构破坏,其活性会遭到破坏[19],故温度选在70℃为宜。

图8 浸提温度对苦瓜藤多糖得率的影响Fig.8 Effect of extracting temperature on the polysaccharide yield
2.2.2 热提法正交实验结果 热水提取苦瓜藤多糖正交实验结果见表4。

表4 正交实验结果Table 4 Orthogonal array design results of ultrasound-assisted extraction
由表4可知,三因素对苦瓜藤多糖得率的影响大小为B>A>C,即料液比>浸提温度>浸提时间,其最佳提取工艺参数为A3B3C2。结果表明,A3B3C2的得率为2.30%,在九组实验中最大,表明A3B3C2可为最优提取工艺。根据最优提取工艺分别提取1、2、3次,结果显示,第一次提取率可达2.30%,二次提取混合液3.06%,三次提取混合液为3.43%,两次提取比较完全,三次提取增幅不大,因此,热水提取苦瓜藤多糖的最优工艺为:提取温度75℃、料液比1∶55(g/mL)、提取时间90min,浸提2次。
2.3 超声波提取法与热水提取法的比较
在各自的最佳工艺条件下,超声波提取35min提取率能达到2.35%,热水提取90min提取率为2.30%。由此与热水提法相比,超声波提取法节约了将近60%的时间,效率约为水提法的2.5倍;两种方法的两次提取总量相当,说明第二次提取时细胞粉碎程度比较完全,超声波的影响已经不太显著,但总的来说,提取液的用量和提取温度也比热水提取法少的多,符合绿色节能的发展要求。
3 结论
通过本实验的研究,得出苦瓜藤多糖超声提取的最优工艺为:提取温度65℃、料液比1∶25(g/mL)、超声时间35min、pH为7,浸提2次,四因素对苦瓜藤多糖得率的影响大小为:温度>超声时间>pH>料液比。热水提取苦瓜藤多糖的最优工艺为:提取温度75℃、料液比1∶55(g/mL)、提取时间90min,浸提2次,三因素对苦瓜藤多糖得率的影响大小为:料液比>浸提温度>浸提时间。
通过两种提取法的最佳工艺的比较发现,超声波提取法的效率约是传统热水提取法的2.5倍,验证了超声波提取的高效性。由单因素的结果可以看出,苦瓜藤多糖对热、酸不是很稳定,所以提取苦瓜藤多糖时要避免高温、加热过久,pH环境不可过酸,以便得到较多和较稳定的多糖。苦瓜藤粗糖含有很多组分,这些都有待进一步研究。
[1]Nivitabishekam SN,Asad M,Prasad VS.Pharmacodynamic interaction of Momordica charantia with rosiglitazone in rats[J].Chem Bio Intera,2009,177(3):247-253.
[2]J Welihinda,E H Karunanayake,M H H Sheriff,et al.Effect of Momordica charantia on the glucose tolerance in maturity onset diabetes[J].Joural of Ethnopharma,1986,17(3):277-282.
[3]Cheng HL,Huang HK,Chang CI.A cell-based screening identifies compounds from the stem of Momordica charantia that overcome insulin resistance and activate AMP-activated protein kinase[J].J Agric Food Chem,2008,56(16):6835-6843.
[4]何新益,刘仲华.苦瓜多糖降血糖活性的高通量筛选研究[J].食品科学,2007,28(2):313-316.
[5]陈红漫,杭天骄,田秀艳.苦瓜多糖抗氧化活性的研究[J].食品科技,2009,34(6):166-169.
[6]董英,张慧慧.苦瓜多糖降血糖活性成分的研究[J].营养学报,2008,30(1):54-56.
[7]张文波,韦文龙,李宏睿.苦瓜多糖超声波提取与抑茵活性的研究[J].时珍国医国药,2011,22(7):1676-1677.
[8]邓镇涛,向灿辉,孙志勇,等.正交法优选党参粗多糖水提工艺[J].食品工程,2009(4):22-24.
[9]向东,赖凤英,梁平.碱法提取南瓜多糖的研究[J].食品工业科技,2004,25(11):120-122.
[10]刘贝贝.酸提菜籽饼粕多糖的研究[D].武汉:华中农业大学,2007.
[11]刘育玲,姚开,贾冬英,等.茶多糖酶法提取的优化条件及其对葡萄糖激酶活性的影响[J].食品科技,2010,35(2):134-137.
[12]梁丽军.大蒜多糖的提取纯化及生物功能活性研究[D].南昌:南昌大学,2008.
[13]吕伟,曾哲灵,代志凯,等.大蒜多糖提取及其组成测定[J].食品科学,2009,30(18):83-87.
[14]刘志明,唐彦君,吴海舟,等.苯酚-硫酸法测定葡萄酒中总糖含量的样品处理[J].中国酿造,2011(2):158-161.
[15]TAYLOR KACC.A Modification of the phenol-sulfuric acid assay for Total carbohydrates giving more comparable absorbances[J].Appl Biochem Biotech,1995,6(3):207-214.
[16]范家佑,郁建平.绞股蓝多糖提取工艺的比较及优化[J].食品工业科技,2010,31(6):199-202.
[17]杨咏洁,梁成云,崔福顺.芥菜多糖的超声波提取工艺及其抑菌活性的研究[J].食品工业科技,2010,31(4):146-151.
[18]方桂珍,马艳丽,徐凤英,等.超声波法提取木材中的阿拉伯半乳聚糖的研究[J].林产化学与工业,2004,24(4):103-106.
[19]吴先辉.苦瓜多糖超声波提取工艺的研究[J].长江农业,2009(24):42-44.
