咖啡酸衍生物对自由基致D N A氧化损伤的联合保护作用
2013-12-06李瑞锐尹文琴陈丽君戴金凤
李瑞锐,尹文琴,李 磊,王 丽,陈丽君,戴金凤
(南京医科大学公共卫生学院,江苏南京211166)
大量人群流行病学和实验研究表明,自由基参与机体多种疾病发生和发展过程,是血管损伤、细胞癌变、神经病变的原始引发机制之一[1-3]。清除自由基、提高机体抗氧化能力,是许多药物防治慢性疾病的重要途径[4-5]。咖啡酸及其衍生物属于多酚类植物化学物。多酚类植物化合物对心脑血管、糖尿病肾病及癌症等慢性非传染性疾病具有很好的预防作用[6-8]。CADs广泛存在于以唇形科、菊科、蔷薇科、十字花科等植物性食品或膳食中[9-12]。食用富含CADs的食物对心脑血管疾病、细胞损伤恶变引发的肿瘤等有一定的防治作用[13-14]。目前,CADs单体的抗氧化、抗菌、抗肿瘤、保肝等多方面的生物活性已被实验证实[15-17],但多种CADs对机体的联合保护作用研究鲜见报道。本实验选用食品/膳食中常见的三种CADs,运用DPPH自由基、·OH反应模型和CuSO4-Phen-VitC-H2O2-DNA化学发光体系,研究其清除自由基及对·OH自由基致DNA损伤的保护作用。探讨膳食复杂体系中多种植物化学成分防治慢性非传染性疾病作用效果,为植物化学物整合作用研究和膳食干预提供依据。
1 材料与方法
1.1 材料与仪器
绿原酸(ChA,纯度99%)、阿魏酸(FeA,纯度99%)、迷迭香酸(RoA,纯度99%)、维生素C(VitC)、小牛胸腺DNA 美国Sigma公司;DPPH(纯度95%)、邻啡咯啉(Phen) Johnson Mathey公司;甲醇 色谱纯;过氧化氢(30%)、乙醇、甲醇、醋酸铵、浓盐酸、硫酸铜 均为分析纯。
Orion II高灵敏度板式化学发光检测仪 德国BertholdDS公司;InfiniteM200荧光酶标仪 瑞士Tecan公司;梅特勒MS105DU分析天平 德国赛多利斯公司;SSW型电热恒温水槽 上海博迅实业有限公司;XW-80A微型旋涡混合仪 上海沪西分析仪器厂;KQ3200B型超声波清洗器 昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 DPPH自由基清除能力的测定 参照文献[17],DPPH溶液和样品质量浓度梯度的配制(DPPH溶液现配现用):精确配制质量浓度为720μg/mL DPPH溶液作为储备液。应用时,将储备液用甲醇稀释15倍,质量浓度为48μg/mL。实验分为8组(ChA、FeA、RoA、ChA+FeA(1∶1)、ChA+RoA(1∶1)、FeA+RoA(1∶1)、ChA+FeA+RoA(1∶1∶1)、VitC)。每组都分为200、100、50、25μg/mL四个浓度。
反应体系及清除率计算:将100μL不同质量浓度的样品和等量的DPPH自由基分别加入96孔板中,每孔反应体积共200μL液体,每个质量浓度3个平行样,每隔2min测一次吸光度(Aj),空白为A0(200μL甲醇),阴性对照Ai(100μL DPPH·+100μL甲醇),阳性对照(100μL DPPH+100μL VitC),按式(1)计算DPPH清除率。
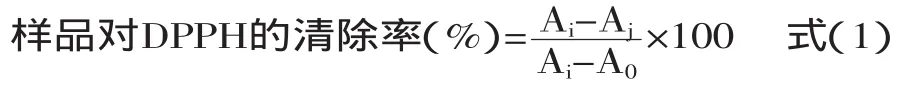
1.2.2 ·OH清除率的测定 参照文献[18],用0.1mol/L醋酸盐缓冲液(pH5.5)配制CuSO4-Phen-VitC溶液,在化学发光仪微孔板中依次加入CuSO4-Phen-VitC混合液100μL、不同组合CADs溶液60μL、H2O220μL。对照组用60μL缓冲液补齐,每组做3个平行样,立即测定发光反应值。根据发光值绘制发光反应的动力学曲线,以曲线峰值计算·OH清除率,观察不同组合CADs对·OH的清除作用。不同组合CADs样品孔发光强度以CLj表示,醋酸盐缓冲液对照组发光强度以CLi表示。·OH清除率计算公式见式(2)。

1.2.3 CADs对·OH致DNA损伤的保护作用 参照文献[19],用0.1mol/L醋酸盐缓冲液(pH5.5)配制CuSO4-Phen-VitC-DNA溶液。在化学发光仪微孔板中依次加入CuSO4-Phen-VitC-DNA混合液、100μL、60μL不同组合的植物化学物溶液(对照组用60μL缓冲液补齐),最后加入20μL H2O2启动发光反应,立即测定发光反应值(CL)。每组做3个平行试样。以DNA损伤产生的鸟嘌呤特征性化学发光强度及峰值出现时间的变化,观察不同组合多酚类植物化学物作用下抑制DNA损伤的情况。

1.3 统计学分析
2 结果与分析
2.1 CADs对DPPH自由基的清除作用
不同浓度的CADs对DPPH自由基均有清除作用见表1。在相同的作用时间内,在25~200μg/mL内CADs对DPPH自由基的清除率逐渐增加,并且质量浓度越大清除率越高。但在100μg/mL后,各种质量浓度的CADs对自由基的清除率变化不明显。
表1 CADs对DPPH自由基的清除率(%±SD,n=3)Table 1 The change in scavenging rate of CADs against DPPH free radicals(%±SD,n=3)

表1 CADs对DPPH自由基的清除率(%±SD,n=3)Table 1 The change in scavenging rate of CADs against DPPH free radicals(%±SD,n=3)
注:*,与同浓度VitC作用比较,有显著性差异(p<0.05);#,与同浓度ChA+FeA+RoA作用比较,有显著性差异(p<0.05)。
名称浓度(μg/mL)25 50 100 200 ChA 12.99±0.38 34.41±0.24* 68.46±0.14*# 69.01±0.23 FeA 17.74±0.25 49.30±0.92* 60.29±0.19*# 65.51±0.18 RoA 8.47±2.19 28.83±1.41* 52.99±0.79*# 57.53±1.24 ChA+FeA 19.80±1.25 47.71±1.75* 80.64±1.32*# 81.89±1.19 ChA+RoA 21.93±1.23 38.93±1.45* 74.63±1.03*# 74.61±1.12 FeA+RoA 20.39±1.32 38.39±1.35* 76.39±0.45*# 76.93±1.47 ChA+FeA+RoA 28.93±1.12 58.39±0.49* 83.93±0.54* 84.09±0.75 VitC 13.39±0.48 32.99±0.87 72.33±1.68 72.99±0.83
相同质量浓度下,两种CADs联用组合以及三种CADs联用组合的DPPH自由基的清除率大于单成分组。其中三种CADs联用对DPPH自由基清除能力最强。当ChA+FeA+RoA组合质量浓度为200μg/mL时,对DPPH自由基的清除率达到84.09%。实验证明多成分联用的效果在对DPPH自由基清除率的能力明显强于单一成分以及两种成分联用,说明实验所选的三种多酚类植物化学物之间存在着一定的协同作用。
2.2 CADs对·OH自由基的清除作用
CADs的浓度越大发光峰值越小,则其对·OH自由基的清除率越大。表2为各个实验组合在不同浓度下对·OH自由基的清除率。不加CADs溶液的空白对照组的发光峰值相对较高,实验组因加入不同组合CADs化学发光峰值很低,发光峰值下降程度明显,则其对·OH自由基的清除率大下降程度明显。相同质量浓度下组合(ChA+FeA+RoA)对·OH自由基清除作用最强,其中当组合(ChA+FeA+RoA)浓度为25、50、100、200μg/mL时,对发光峰的抑制率分别33.43%、55.27%、71.23%、77.49%,显示了CADs对·OH自由基具有明显的清除作用,且呈剂量效应关系,即CADs质量浓度越大发光峰值下降程度越明显。多成分联用更加有效的提高了CADs防止羟自由基引起的DNA损伤的效果。
表2 CADs对·OH自由基的清除率(%±SD,n=3)Table 2 The change in scavenging rate of CADs against·OH free radicals(%±SD,n=3)

表2 CADs对·OH自由基的清除率(%±SD,n=3)Table 2 The change in scavenging rate of CADs against·OH free radicals(%±SD,n=3)
注:*,与同浓度空白对照比较,有显著性差异(p<0.05);#,与同浓度ChA+FeA+RoA作用比较,有显著性差异(p<0.05)。
名称浓度(μg/mL)25 50 100 200空白对照 11.46±0.15 13.73±0.21 15.11±0.32 19.74±0.45 ChA 19.79±0.38 23.92±0.24* 38.46±0.14* 49.01±0.71 FeA 17.77±0.25 28.49±0.92* 40.29±0.13* 45.51±0.78 RoA 18.47±2.19 25.21±0.71* 42.99±0.22* 47.53±1.24 ChA+FeA 29.30±1.52 35.24±0.75*# 60.64±1.32*# 61.89±1.14 ChA+RoA 27.94±1.23 34.27±1.54*# 64.63±1.21*# 65.61±1.21 FeA+RoA 25.39±1.32 41.38±1.35*# 66.39±0.47*# 66.93±1.74 ChA+FeA+RoA 33.43±0.72 55.27±0.49* 71.23±0.54* 77.49±0.75
2.3 CADs对·OH致DNA损伤的保护作用
如表3所示,不同质量浓度的CADs加入CuSO4-Phen-VitC-H2O2-DNA体系后,各实验组对DNA损伤产物发光抑制率。
由表3可看出,不同比例的CADs均能有效防止羟自由基引起的DNA损伤。CADs能使DNA损伤产物发光峰较空白对照组有明显下降;CADs的浓度越大发光峰值下降程度明显,其对DNA损伤产物发光抑制率越大。不同组CADs对DNA损伤产物发光抑制率为12.49%~81.09%。其中三种成分联用组的作用最强,对DNA损伤产物发光抑制率高达81.09%。
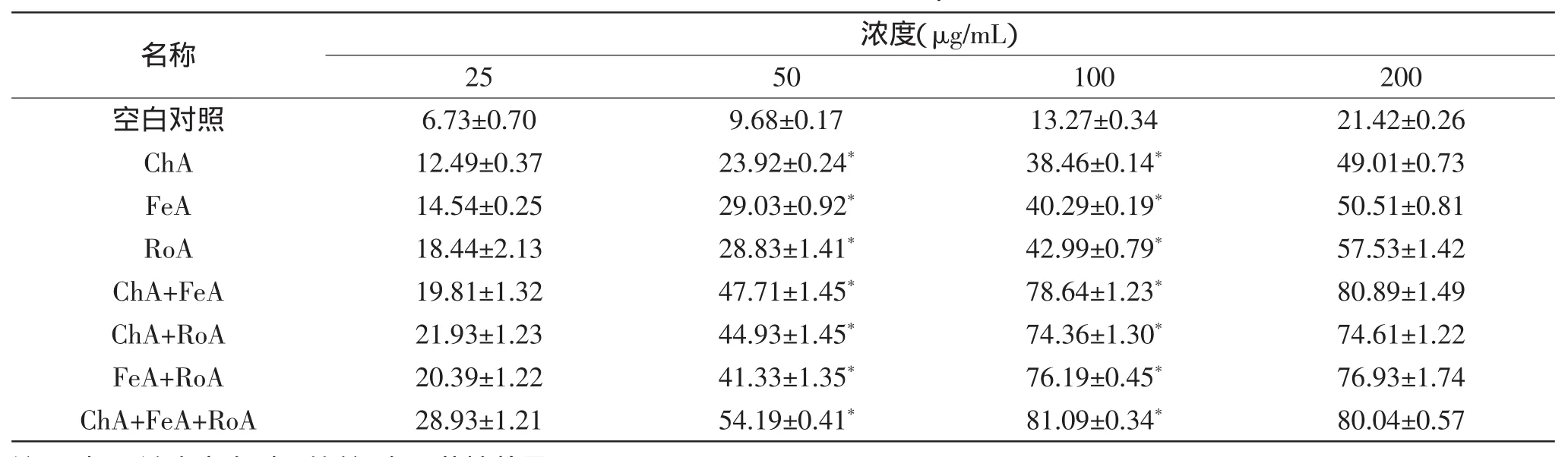
表3 不同组合CADs对CuSO4-Phen-VitC-H2O2-DNA体系化学发光的影响Table 3 Effect of different group of CADs at various concentrations on chemiluminescence intensity of CuSO4-Phen-VitC-H2O2-DNA system
3 讨论
本实验运用DPPH和·OH自由基反应模型和酶标仪观察不同组合CADs对自由基的淬灭效应。DPPH自由基是一种合成的有机自由基。通过对DPPH这种能稳定存在的自由基清除能力的检测,可以反映样品在体内清除DPPH自由基的活性[20]。实验结果表明,CADs有较强的清除DPPH自由基的能力。多种CADs联合使用显示出了协同清除DPPH自由基的能力。用CuSO4-Phen-VitC-H2O2-DNA化学发光体系测定不同组合CADs对·OH致DNA损伤的协同抑制作用[21],结果表明,不同组合CADs能有效清除DPPH和·OH自由基,联用应用能协同抑制·OH引发的DNA氧化损伤程度。
自由基的生成与许多疾病密切相关,如衰老、心脏病、动脉硬化、静脉炎、关节炎、过敏、早老性痴呆、冠心病及癌症等[22-24]。多酚类植物化学物是一类天然抗氧化剂,具有抗炎、抗氧化、消除自由基作用与免疫抑制等多种药理作用[25]。多种成分多酚类植物化学物联合抗氧化和抑制自由基的课题日益成为研究热点。
4 结论
本研究结果表明,多成分CADs联用较单一成分具有更好的保护机体DNA氧化损伤的作用。但由于本实验局限于体外模型,对CADs联合在体内的代谢及吸收机制还不很明确,体内清除自由基及对DNA的氧化损伤作用还有待进一步研究。
[1]Petersen M,Simmonds.Rosmarinic acid[J].Phytochemistry,2003,2(2):121-125.
[2]Bagchi K,Puri S.Free radicals and antioxidants in health and disease[J].Eastern Mediterranean Health Journal,2008,4(2):350-360.
[3]屠幼英,杨于银,东方飞.红茶中多酚类物质的抗氧化机制及其构效关系[J].中草药,2007,38(10):1581.
[4]赵海田,王振宇,程翠林,等.松多酚类活性物质抗氧化构效关系与作用机制研究进展[J].食品工业科技,2012,33(2):458-461.
[5]张欣,赵新淮.几种多酚化合物抗氧化性的不同化学评价及相关性分析[J].食品科学,2008,29(10):85-89.
[6]张伟农,刘大川,胡小泓.葵花籽仁中提取绿原酸的研究[J].中国油脂,2002,27(2):76.
[7]Lu HT,Jiang Y,Chen F.Application of preparative high-speed counter-counter chromatography for separation of chlorogenic acid from Flos Loncease[J].J Chromatogra,2004,1026:185.
[8]赵琳,张英锋,马子川.阿魏酸的合成和应用[J].化学教育2009(7):5-7.
[9]陈慧芳,马永华,卞学伟.植物活性成分辞典[M].第二册.北京:中国医药科技出版社,2001:888-890.
[10]韩宏星,宋志宏,屠鹏飞.迷迭香水溶性成分研究[J].中草药,2001,32(10):877.
[11]吴建章,郁建平,赵东亮.迷迭香酸的研究进展[J].天然产物研究与开发,2005,17(3):383-388.
[12]Hirata T,Kobayashi T,Wada A,et al.Anti-obesity compounds in green leaves of Eucommia ulmoides[J].Bioorg Med Chem Lett,2011,21(6):1786-1791.
[13]孙峋,汪靖超,李洪涛,等.迷迭香酸的抗菌机理研究[J].青岛大学学报:自然科学版,2005,18(4):41-43.
[14]Ito N,Yabe T,Gamo Y,et al.Rosmarinic acid from Perillae Herba produces an antidepressant-like effect in mice through cell proliferation in the hippocampus[J].Biol Pharm Bull,2008,31(7):1376-1380.
[15]侯晋,付杰,张志明,等.咖啡酸衍生物的生物活性与化学结构的改造[J].复旦学报:医学版,2011,38(6):546-552.
[16]Rastija V.QSAR study of antioxidant activity of wine polyphenols[J].European Journal of Medicinal Chemistry,2009,44:400-408.
[17]许申鸿,杭瑚.溶剂及pH对1,1-二苯基-2-苦肼基自由基分析法的影响[J].分析测试学报,2010,19(3):50-52.
[18]胡天喜.测量活性氧、自由基及脂质过氧化的化学发光技术[M].北京:原子能出版社,2007:65-71.
[19]赵珺,王丽,李磊,等.芹菜素对自由基致DNA损伤的保护作用及机制[J].食品科学,2011,29(13):1-4.
[20]Youn J,Lee KH,Won J,et al.Beneficial effects of rosmarinic acid on uppression of collagen induced arthritis[J].The Journal of Rheumatology,2003,30(6):1203.
[21]Ramos AA,Marques F,Fernandes-ferreira M,et al.Water extracts of tree Hypericum sps.protect DNA from oxidative and alkylating damage and enhance DNA repair in colon cells[J].Food Chem Toxicol,2012,51:80-86.
[22]Scheckel KA,Degner SC,Romagnolo DF.Rosmarinic acid antagonizes activator protein-l-dependent activation of cyclooxygenase-2 expression in human cancer and nonmalignant cell lines[J].Journal of Nutrition,2008,138(11):2098-2105.
[23]Aboulenein HY,Kruk I,Kladna A,et al.Scavenging effects of phenolic compounds on reactive oxygen species[J].Biopolymers,2007,86(3):222-230.
[24]Lee HJ,Cho HS,Park E,et al.Rosmarinic acid protects human dopaminergic neuronal cells against hydrogenperoxideinduced apoptosis[J].Toxicology,2008,25(2):109-115.
[25]Vostálová J,Zdarilová A,Svobodová A.Prunella vulgaris extract androsmarinic acid prevent UVB-induced DNA damage and oxidative stress in HaCaT keratinocytes[J].Arch Dermatol Res,2010,302(3):171-181.
