羊草生长率的研究和生长率假说的验证
2013-12-06徐劲草许新宜
徐劲草,许新宜
(北京师范大学水科学研究院 水沙科学教育部重点实验室,北京 100875)
羊草生长率的研究和生长率假说的验证
徐劲草,许新宜
(北京师范大学水科学研究院 水沙科学教育部重点实验室,北京 100875)
生长率假说(GRH)是研究生物生长率与化学计量特征之间关系的理论。为了验证生长率假说,以北方草原重要建群种羊草(Leymuschinensis)为材料,将取自内蒙古和吉林省4个地点的羊草在相同的光照、水肥条件下盆栽土培,用称重法测定了羊草的生长率,用PCR的方法分析了羊草核糖体DNA基因间隔区(IGS)长度,研究了羊草生长率与羊草磷含量、氮磷比、IGS长度及取样地土壤中氮、磷含量之间的关系。结果表明,羊草生长率与羊草全磷含量存在正相关关系,与羊草氮磷比存在负相关关系,生长率较高的羊草具有较长的IGS,符合生长率假说的预测。不同来源的羊草种植在相同环境下,来自氮、磷含量较高土壤的羊草具有较高的生长率,这可能是羊草对特定地域生境条件长期适应的结果。高的生长率和长的IGS可能是植物对较高氮、磷含量环境的适应。
生长率假说;羊草;IGS长度;氮磷比
化学计量生态学是研究生态作用中化学元素平衡的科学[1]。该理论认为,有机体是由各种元素组成的,这些元素的比值决定了有机体的关键特征,同时也决定了有机体对资源种类和数量的需求[2]。近年来,化学计量生态学已在个体、种群、群落、生态系统各个层次得到了应用[3-6],成为生态学研究的热点。
生长率假说(Growth Rate Hypothesis,GRH)是化学计量生态学中的重要假说,是研究化学计量比、RNA分配和有机体生活史相关机制的理论[7]。该假说认为,生物的快速生长需要大量的核糖体,核糖体富含磷,同时核糖体合成速率与核糖体DNA基因间隔区(Intergenic Spacer,IGS)长度相关,这是因为IGS序列中常常包含启动子和增强子。因此,生长率与生物体的磷含量、碳磷比、氮磷比、RNA含量以及IGS长度都有密切联系[1,3,8-9]。一般说来,较高的生长率对应于较高的磷含量和RNA含量,较低的碳磷比、氮磷比以及较长的IGS。
前人对生长率假说的研究主要集中在动物和微生物中,植物是否符合生长率假说还需进一步验证。目前已有一些研究对植物的生长率进行测定[10],对植物生长与化学计量特征之间的关系进行分析[11-12]。本研究以羊草(Leymuschinensis)为研究对象,验证生长率假说在植物中存在的规律。羊草广泛分布在我国东北平原以及内蒙古高原东部,是欧亚草原区东部的重要草原建群种,也是野生优良牧草[13]。由于羊草存在不同的生态型或趋异类型[14-15],可以预见,不同类型羊草可能具有不同的生长率。而生长率与氮、磷元素含量和比率以及IGS长度之间的关系是否符合生长率假说的预测,这正是本研究要解决的问题。
1 研究方法
1.1野外采样 本研究在内蒙古自治区和吉林省设立4个采样地点,分别为内蒙古自治区的阿巴嘎旗、中国科学院草原定位站(简称定位站)和巴林左旗,以及吉林省长岭县腰井子羊草草原自然保护区(简称腰井子)。4个取样地点的自然生境概况和植被特征见表1。
于2007年6月,到上述4个取样地点,选取远离公路、人为干扰少、生长状况良好的羊草自然种群进行取样。在每个取样地点选取10个不同采样位点,每个位点间隔10 m,每个位点采集长势良好的成熟羊草50株。采集时连同羊草根际土壤一起取出,放进自封袋内,放入适量土壤并洒水保持湿润,防止羊草死亡。同时用土钻采集0~30 cm土样,每个取样地点采集10 个,放入自封袋,带回进行全氮、全磷分析,结果见表1。

表1 4个取样地点的生境资料
注:土壤全氮、全磷含量为均值±标准差。下同。
Note:The values of soil total N and total P contents are expressed as Mean±SD. The same below.
1.2羊草前期栽培 采样结束后立即进行盆栽土培,地点位于中国科学院植物研究所北京植物园内。取植物园内北京当地褐土和栽培用草炭土按3∶1的比例混合。栽培从2007年6月27日开始,选取大小相近、长势一致的羊草植株,采用上口直径30 cm的塑料花盆,每盆栽种从同一取样地点采集的10株羊草,每个取样地点栽培50盆。花盆放置地点为开阔地,接受自然光照和降水。羊草栽培过程中,保证充分的水分供应,一旦连续3 d没有降水,则进行人工浇水,每个花盆浇水500 mL。
栽培工作结束后进行施肥。本试验施用长效复合肥,肥料里包含氮、磷、钾等植物生长必需元素,肥效较高且作用时间较长。根据肥料使用说明和花盆面积,每个花盆每次施肥5 g,共施肥3次,每次间隔1周。施肥后立即浇水。
羊草栽培时间为2007年6月27日―8月7日,4个取样地点共栽培200盆羊草,每盆羊草的光照、水肥条件完全相同。从8月7日开始,挑选羊草生长良好且一致的花盆,每个取样地点各挑选18盆,4个取样地点共72盆,进行下一步试验。
1.3分析测定
1.3.1羊草生长率的测定 2007年8月7日,将挑选出来的72盆羊草的地上部分全部剪掉,以使羊草的地面部分统一从零开始生长,使生长率测定有一个统一的标准。从8月7日开始经过1周,于8月14日第1次开始取样,以后每周取样一次,共6次,分别为8月14日、8月21日、8月28日、9月4日、9月11日和9月18日。每次取样时,来自不同采样地点的羊草分别取3盆,剪取地上部分,分别放入自封袋中,并做好标记。
剪下的植物样品先在105 ℃杀青30 min,然后在65 ℃烘干24 h,称其干质量。并计算生长率[10]:
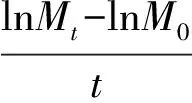
式中,Mt为t时刻的生物体质量,M0为生物体的初始质量,t为生长时段长。本试验以每盆羊草地上部分生物量来计算生长率。Mt为每盆羊草地上部分生物量,M0为第1次取样时(8月14日)同一来源的3盆羊草地上部分生物量平均值,t分别为7、14、21、28和35 d。
1.3.2化学分析 分别采用凯氏定氮法和钼锑抗比色法[16]对羊草样品和采样地土壤样品进行全氮和全磷含量的分析。
1.3.3分子生物学分析 真核生物编码5.8S、18S和28S rRNA的基因在基因组上是串联重复的,拷贝与拷贝之间的间隔序列即为核糖体DNA基因间隔区IGS。剪取来自不同取样地点盆栽羊草的幼嫩叶片,每个取样地点随机选取8个个体,采用PCR方法测定IGS长度。步骤包括DNA提取、PCR扩增和电泳检测。
采用植物基因组DNA提取试剂盒(EasyPure Plant Genomic DNA Extraction Kit,北京全式金生物技术公司)提取和纯化基因组DNA。PCR设计引物中,先在NCBI(http://www.ncbi.nlm.nih.gov/)的GenBank中找出小麦(Triticumaestivum,GenBank号:X07841)、粟(Setariaitalica,GenBank号:AB197128)、水稻(Oryzasativa,GenBank号:X54194)、玉米(Zeamays,GenBank号:X03990)和黑麦(Secalecereale,GenBank号:M37231)等禾本科植物的rDNA序列,然后使用ClustalX软件进行序列比对,找出25S~28S rDNA 3′端的保守序列和16S~18S rDNA 5′端的保守序列,最后使用Premier引物设计软件来进行引物设计。共设计了4对引物,以PCR的实际效果来进行引物筛选,最终确定引物为 IG1:5′-GGTGGGCTGAATCCTTTGC-3′和IG2:5′-GCCATTCGCAGTTTCACAG-3′。其中IG1为25S~28S rDNA 3′端的保守序列,IG2为16S~18S rDNA 5′端的保守序列。由于IGS序列较长,故选用高保真DNA聚合酶(TransTaq HiFi DNA Polymerase,北京全式金生物技术公司)。PCR反应条件为先94 ℃ 5 min预变性,然后是35个循环:94 ℃ 45 s变性,53 ℃ 45 s退火,72 ℃ 3 min延伸。最后72 ℃ 10min延伸。PCR产物使用琼脂糖凝胶电泳检测,在凝胶成像仪中拍摄照片分析。
1.3.4数据分析 对不同取样地点的羊草生长率、IGS长度之间的差异,采用Duncan法(新复极差法)进行多重比较,并绘图。对羊草生长率与其他因素之间的关系,采用线性回归分析并绘图。
2 结果与分析
2.1不同取样地点的羊草生长率 在各生长时段,不同取样地点的羊草生长率各不相同,大体上,在同一生长时段,定位站的生长率较高,阿巴嘎旗、巴林左旗、腰井子依次降低(图1)。随着生长时段的延长,生长率呈下降趋势,不同取样地点之间的差异也逐渐减小。同一地点的样本内具有一定的变异,生长时段7 d的样本内部变异较大,随时间推移,样本内部变异逐渐减小。
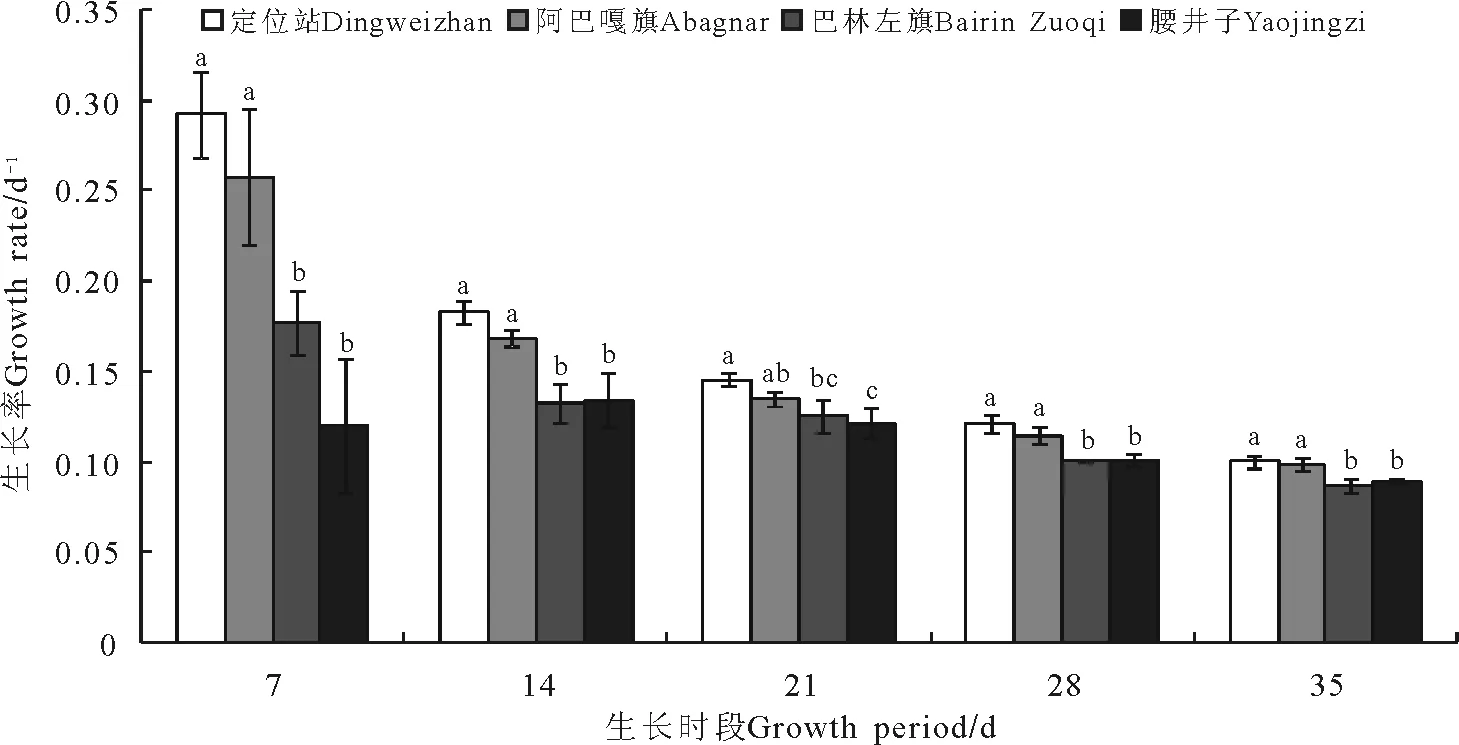
图1 4个取样地点的羊草在各生长时段的生长率Fig.1 The growth rate of Leymus chinensis of four sampling sites during all growth periods
注:同一生长时段下,具有不同字母者表示各站点差异显著(Plt;0.05)。下同。
Note:Different lower case letters for the same growth period show significant difference at 0.05 level. The same below.
2.2羊草生长率与羊草全磷、氮磷比的关系 在第1个生长时段7 d时,羊草生长率与全磷含量之间具有显著的正相关关系(R2=0.46,Plt;0.05)(图2)。在生长时段14、21、28和35 d时,尽管相关不显著(Pgt;0.05),但羊草生长率仍然有随着全磷含量增加而增加的趋势。
在第1个生长时段7 d时,羊草生长率与氮磷比之间具有极显著的负相关关系(R2=0.57,Plt;0.01);生长时段14 d时,两者之间具有显著负相关关系(R2=0.36,Plt;0.05)(图3)。由于生长率的差异随生长时段延长而逐渐减小,在生长时段21、28和35 d时,生长率与氮磷比关系未达到显著水平(Pgt;0.05),但生长率仍存在随着氮磷比的增加而减小的趋势。
2.3不同取样地点的羊草IGS长度 对IGS片段PCR扩增后电泳检测(图4),结果表明,来自阿巴嘎旗的羊草IGS长度为(3.60±0.56) kb,定位站为(4.38±0.35) kb,巴林左旗为(3.58±0.82) kb,腰井子为(3.48±0.32) kb(图5)。定位站羊草IGS长度显著高于其他三者(Plt;0.05),阿巴嘎旗、巴林左旗、腰井子三者间的差异不显著(Pgt;0.05)。不同取样地点的羊草IGS长度不同,说明可能是遗传因素导致了羊草生长率的差异。定位站的羊草生长率较高,同时其IGS较长,符合生长率假说的预测。
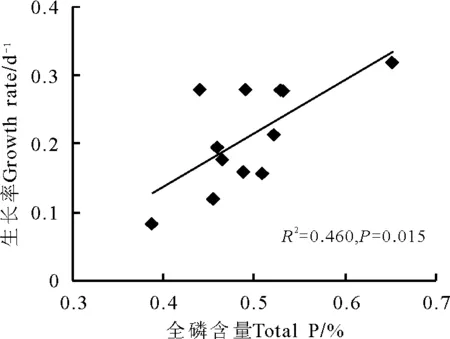
图2 羊草生长率与羊草全磷的关系(7 d生长时段)Fig.2 The relationship between plant growth rate and plant P content ( growth period of 7 days)
2.4羊草生境与生长率及IGS长度的关系 不同取样地点的羊草生长率和IGS之间存在显著差异,这种差异有可能是羊草对取样地生境产生了适应所致。定位站土壤的全氮和全磷含量明显高于其他3个取样地点(Plt;0.05)(图6)。阿巴嘎旗、巴林左旗和腰井子土壤的全氮含量无显著差异(Pgt;0.05),阿巴嘎旗和腰井子土壤的全磷含量无显著差异,巴林左旗土壤全磷含量最低。定位站土壤环境中氮、磷含量较高,羊草的生长率也较高,同时其IGS较长。在较高氮、磷含量土壤中生长的羊草生长率较高,IGS较长,预示着高的生长率和长的IGS可能是羊草对较高氮、磷含量环境的适应。
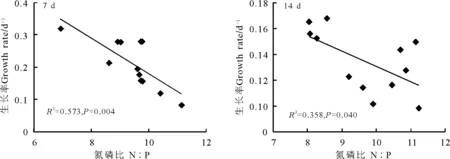
图3 羊草生长率与羊草氮磷比的关系Fig.3 The relationship between plant growth rate and plant N∶P
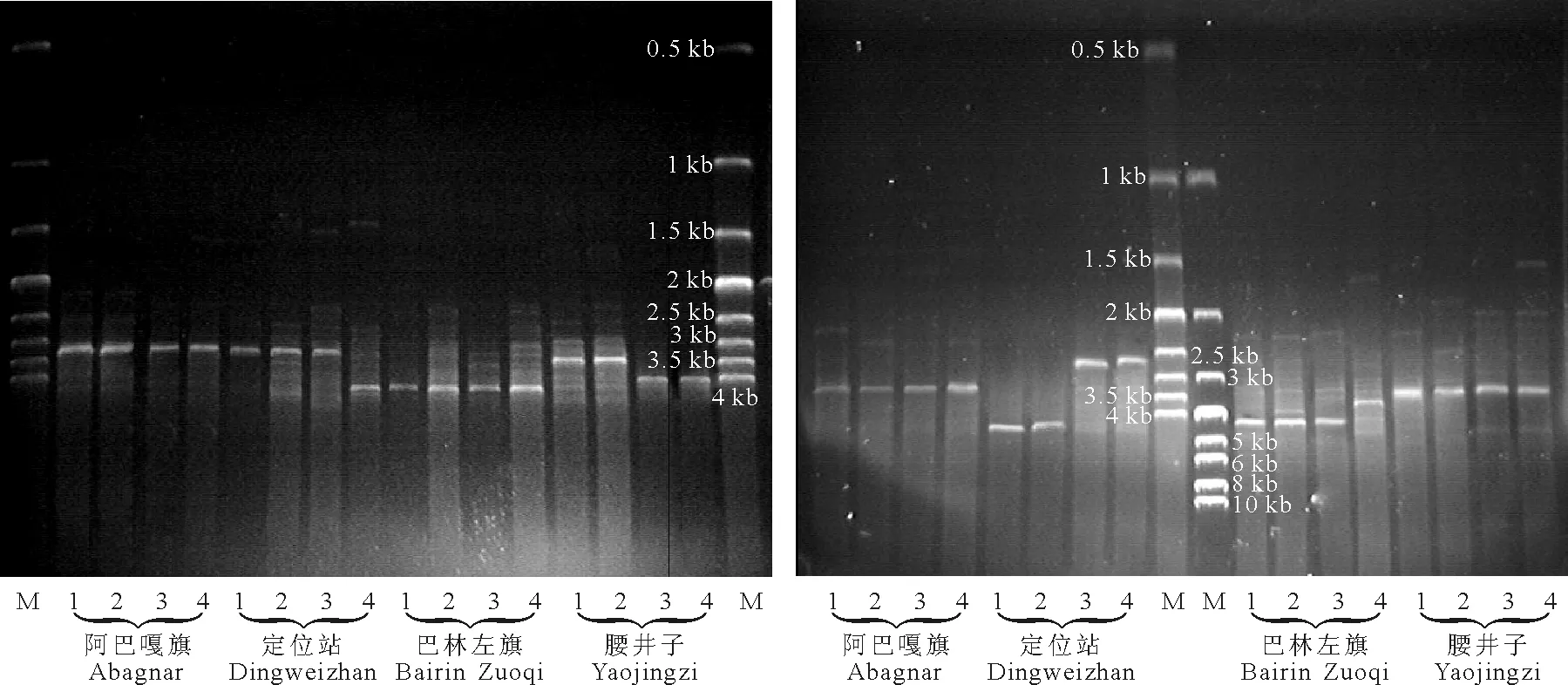
图4 4个取样地点的羊草IGS片段电泳图Fig.4 The electrophoretogram of Leymus chinensis IGS fragments in the four sampling sites
3 讨论与结论
目前对生长率假说的研究主要集中于微生物、动物和低等植物,研究材料多为细菌、水蚤和果蝇。Weider等[3]对水蚤的研究表明,IGS长度与生长率存在显著正相关,同时RNA∶DNA的比值分别与生长率和IGS长度之间存在显著正相关,符合生长率假说。Clemente等[17]对蝗虫的研究表明,IGS的长度和生长率之间存在明显的正相关。Shimizu和Urabe[4]的试验证明,在食物的高碳磷比下,水蚤的生长率和身体磷含量之间呈正相关。Elser等[18]研究发现,果蝇的5个种在种内的生长率、身体RNA含量和磷含量三者呈正相关,而物种间则关系较复杂。本研究发现,羊草在不受营养元素限制的条件下,生长率与全磷存在正相关关系,与氮磷比存在负相关关系;生长率较高的羊草具有较长的IGS。上述结果符合生长率假说的预测,证明了生长率假说在高等植物中同样适用。
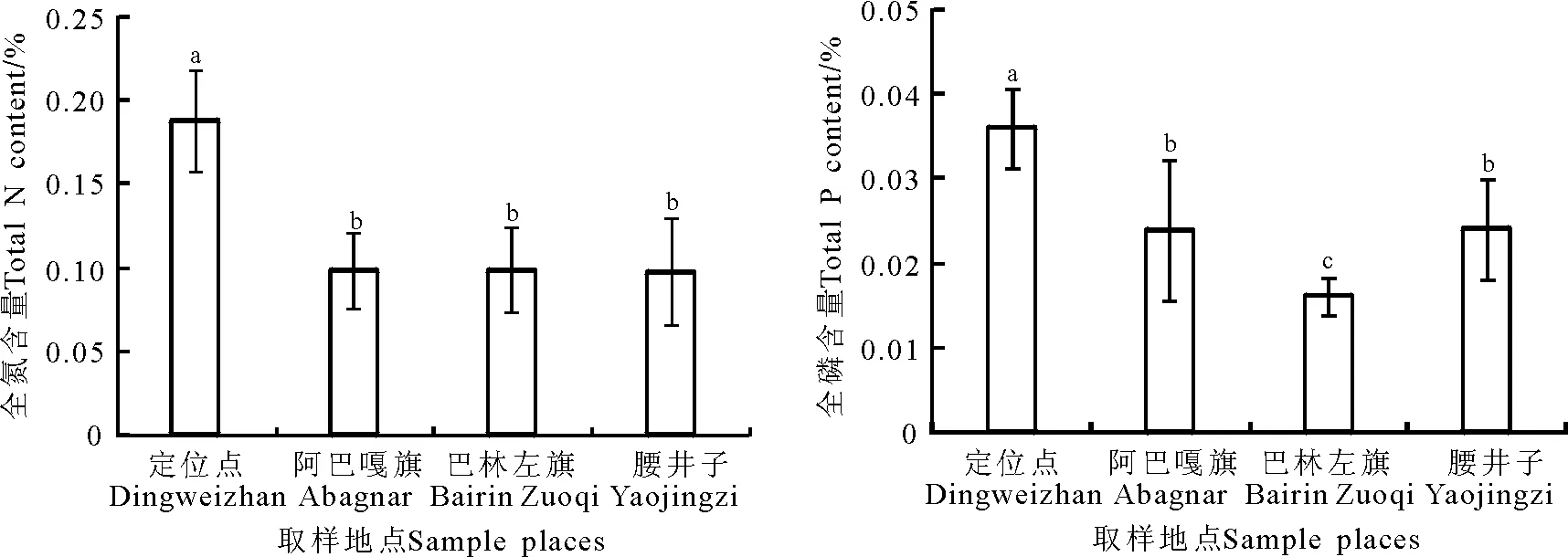
图6 4个取样地点土壤全氮和全磷含量差异Fig.6 The difference of soil N and P content in the four sampling sites
本研究结果显示,不同来源的羊草种植在同样环境下,来自氮、磷含量较高土壤的羊草具有较高的生长率。这可能是由于羊草对特定地域生境条件长期适应,产生了分化和差异所致。这种差异可能是生理上的[19]、生态上的和遗传上的。不同取样地点的羊草IGS长度不同,表明不同取样地点羊草之间的差异可能是遗传上的。钱吉等[20]和任文伟等[21]对羊草的研究表明了不同地理种群的羊草存在遗传上的分化,本研究结果与其结果吻合。高的生长率和长的IGS可能是羊草对较高氮、磷含量环境的适应。
在本研究中,羊草的生长并未受到氮或磷的限制,而前人对生长率的研究很多情况下是在生长受到元素限制条件下进行的。高等植物在某种元素限制下的生长是否符合生长率假说还需进一步验证。
[1] Elser J J,Sterner R W,Gorokhova E,etal.Biological stoichiometry from genes to ecosystems[J].Ecology Letters,2000,3(6):540-550.
[2] Schimel D S.All life is chemical[J].BioScience,2003,53:521-524.
[3] Weider L J,Glenn K L,Kyle M,etal.Associations among ribosomal (r)DNA intergenic spacer length,growth rate,and C∶N∶P stoichiometry in the genusDaphnia[J].Limnology and Oceanography,2004,49(4):1417-1423.
[4] Shimizu Y,Urabe J.Regulation of phosphorus stoichiometry and growth rate of consumers: theoretical and experimental analyses withDaphnia[J].Oecologia,2008,155(1):21-31.
[5] Andersen T,Elser J J,Hessen D O.Stoichiometry and population dynamics[J].Ecology Letters,2004,7(9):884-900.
[6] Moe S J,Stelzer R S,Forman M R,etal.Recent advances in ecological stoichiometry: Insights for population and community ecology[J].Oikos,2005,109(1):29-39.
[7] Elser J J,Dobberfuhl D,Mackay N A,etal.Organism size,life history,and N:P stoichiometry: towards a unified view of cellular and ecosystem processes[J].BioScience,1996,46:674-684.
[8] Elser J J,Acharya K,Kyle M,etal.Growth rate-stoichiometry couplings in diverse biota[J].Ecology Letters,2003,6(10):936-943.
[9] Gorokhova E,Dowling T E,Weider L J,etal.Functional and ecological significance of rDNA intergenic spacer variation in a clonal organism under divergent selection for production rate[J].Proceedings of the Royal Society of London Series B-Biological Sciences,2002,269(1507):2373-2379.
[10] 邢福,李建和.线叶菊草地地下植物量及其生长率的动态分析[J].草业科学,1996,13(1):24-28.
[11] 牛得草,董晓玉,傅华.长芒草不同季节碳氮磷生态化学计量特征[J].草业科学,2011,28(6):915-920.
[12] 王冬梅,杨惠敏.4 种牧草不同生长期 C、N 生态化学计量特征[J].草业科学,2011,28(6):921-925.
[13] 陈孝泉,李艳芹.羊草植物的研究[J].草业科学,1989,6(2):7-12.
[14] 周婵,杨允菲.我国北方2个生态型羊草种群生理特性研究[J].草业科学,2007,24(2):40-46.
[15] 李海燕,李建东,徐振国,等.内蒙古图牧吉自然保护区羊草种群营养繁殖特性的比较[J].草业学报,2011,20(5):19-25.
[16] 鲍士旦.土壤农化分析[M]第3版.北京:中国农业出版社,2000:42-49,71-79,264-270.
[17] Clemente M,Remis M I,Vilardi J C.Ribosomal DNA variation in the grasshopper,Dichropluselongatus[J].Genome,2002,45(6):1125-1133.
[18] Elser J J,Watts T,Bitler B,etal.Ontogenetic coupling of growth rate with RNA and P contents in five species ofDrosophila[J].Functional Ecology,2006,20(5):846-856.
[19] 张丽萍,陈丽颖.东北松嫩草原羊草过氧化物同工酶及酯酶同工酶的研究[J].草业科学,1992,9(3):49-51.
[20] 钱吉,马玉虹,任文伟,等.不同地理种群羊草分子水平上生态型分化的研究[J].生态学报,2000,20(3):440-443.
[21] 任文伟,钱吉,郑师章.不同地理种群羊草的遗传分化研究[J].生态学报,1999,19(5):689-696.
AstudyongrowthrateandthegrowthratehypothesisinLeymuschinensis
XU Jin-cao, XU Xin-yi
(College of Water Sciences, Key Laboratory for Water and Sediment Science of Ministry of Education, Beijing Normal University,Beijing 100875, China)
The growth rate hypothesis (GRH) concerns the relationship between the stoichiometry of an organism and its growth rate. To verify the growth rate hypothesis, four samples ofLeymuschinensisfrom different areas in Inner Mongolia and Jilin province were collected and cultured in pots under the same light, water and fertilizer conditions. The plant growth rate was measured by weighing method. The IGS (intergenic spacer) length of plants was measured by PCR method. The relationships between growth rate and content of N, P of plants; growth rate and IGS length; and growth rate and content of N, P of the sampling site soil were studied. The results showed as the following: there were a positive correlation between growth rate and content of plant P and a negative correlation between growth rate and N to P ratio of plants. The higher growth rate of plants had the longer IGS. These results accorded with the prediction of the GRH. The plants collected from the sampling site with higher content of soil N and P had higher growth rate, which might indicated adaptive evolution ofL.chinensisto specific geographical habitat conditions in long-term. The higher growth rate and longer IGS length might be caused by the adaptation ofL.chinensisto high content of N and P in the environment.
the growth rate hypothesis;Leymuschinensis; IGS length; N to P ratio
XU Xin-yi E-mail:xuxinyi@bnu.edu.cn
2012-03-08接受日期:2012-05-07
国家自然科学基金(青年基金)“植被坡面水流动力学及输沙能力确定”(40801103)
徐劲草(1982-),男,四川崇州人,博士,主要从事生态学研究。E-mail:xujincao@mail.bnu.edu.cn
许新宜(1954-),男,湖北宜昌人,教授,博士生导师,主要从事水资源、生态学与环境科学研究。E-mail:xuxinyi@bnu.edu.cn
S812;S543+.901
A
1001-0629(2013)01-0074-06
