阿托伐他汀促进体外培养大鼠乳鼠皮层神经元树突生长及突触相关蛋白表达
2013-12-06郁盛雪屈文慧隋海娟金迎新金向楠
郁盛雪,屈文慧,隋海娟,金迎新,金向楠,金 英
(辽宁医学院1.药理学教研室、2.2008级临床医学专业学生,辽宁 锦 州 121001)
神经元树突的功能是接收整合临近神经细胞的传入信息,其长度和分支可反映细胞的功能状态,而许多营养因子和应激可影响树突发育,进而影响神经环路的形成和功能[1]。树突棘是树突分支上的棘状突起,是神经元间形成突触的主要部位,其形态变化与学习记忆密切相关[2-3]。在一些退行性疾病中,如阿尔采末病(Alzheimer disease,AD),其主要病理改变是神经元,突触的缺失以及突触-轴突的病理性改变。因此,促进神经元树突生长的药物可能对神经退行性疾病的治疗和预防有着重要的意义。突触蛋白(synapsins)是一组与突触相关的具有神经元特异性的磷酸蛋白,它作为突触的特异性标志物用于AD的研究,突触素(SYP)是突触囊泡膜上的特异性蛋白质,参与了中枢神经系统突触连接的形成和维持。突触后致密蛋白95(PSD-95)是位于谷氨酸能突触PSD中的一种膜相关蛋白,可通过不同结构域与其它蛋白相互作用,串集NMDA受体及其信号通路中的相关蛋白,组成受体-信号分子靶分子复合物,在信号转导中起关键作用[4]。两者作为突触的特异性标志物,是突触核心构建蛋白,在维持突触正常功能和可塑性方面具有重要作用。他汀类药物属羟甲戊二酰辅酶A(3-hydroxy-3-methylgutaryl coenzyme A,HMG-CoA)还原酶抑制剂,是已知作用最强的降胆固醇药物。阿托伐他汀(Ato)属于他汀类药物,现广泛用于临床,并呈现出生物效应的多效性,包括抗氧化、抗炎症、抗血小板聚集、抗肿瘤生长、改善内皮细胞等。目前,有很多证据显示他汀类药物有不依赖于其降脂作用的神经细胞保护作用[5-8]。现已有研究证实进展性脑梗死早期应用Ato可缩短脑梗死损害加重的达峰时间,可改善预后,具有神经保护作用。一些在体实验已经证实Ato可以减少神经元凋亡[9-10]。而Ato对大脑皮层神经元树突生长及突触相关蛋白表达的影响,国内外报道罕见。本研究应用体外培养皮层神经元细胞观察Ato对正常皮层神经元树突生长及突触相关蛋白的影响。
1 材料与方法
1.1 药品和试剂 阿托伐他汀(#23922105,纯度 >98%)购于LKT公司,用二甲基亚砜(dimethyl sulfoxide,DMSO)溶解。DMEM、F12培养基购于 Invitrogen 公司、DMSO、Hoechst 33258、胰蛋白酶(Trypsin,1 ∶250)、L-多聚赖氨酸(Poly-L-lysine,#P2636)均购于Sigma公司;新生胎牛血清、马血清购于广州蕊特生物科技有限公司;HEPES(#391338)购于Calbiochem公司;阿糖胞苷购于意大利S.P.A公司;鼠SYP单克隆抗体、兔PSD-95多克隆抗体、山羊抗兔、山羊抗鼠二抗、鼠抗微管相关蛋白-2(MAP2)单克隆抗体及NeuN多克隆抗体和GFAP抗体购自Santa Cruz公司;β-肌动蛋白(β-actin)抗体购于Beyotime试剂公司;Super Signal West Pico化学发光底物购于美国Thermo Scientific公司。其他相关试剂均由辽宁医学院药理实验室提供。
1.2 大脑皮层神经元原代培养 取出生0~24 h Sprague-Dawley大鼠乳鼠[动物合格证号:SCXK(辽)2003-0007,辽宁医学院动物实验中心提供],体积分数为75%乙醇浸泡消毒,无菌条件下取出大脑皮层,置于培养基中,剔除血管和软脑膜,剪成1 mm3左右的小块。加入0.125%胰蛋白酶37℃消化10 min。待细胞分散后,加入含10%胎牛血清和10%马血清的DMEM/F12培养基终止消化。200目筛网过滤,1 000×g离心10 min,用含10%胎牛血清和10%马血清的DMEM/F12培养基制成细胞悬液,调整细胞密度为 1×108~1×109·L-1,接种在铺有L-多聚赖氨酸24孔或6孔培养板中,置于37℃,5%CO2培养箱中培养。培养48 h后加入含阿糖胞苷(终浓度为5 mg·L-1)的培养基,抑制非神经细胞增殖。以后每2天换液1次,培养4 d后用于实验。应用NeuN抗体和GFAP抗体进行免疫荧光染色鉴定,结果显示神经元培养纯度在90%以上。
1.3 细胞分组及处理 本实验分为三部分:第一部分观察不同浓度Ato处理组对树突生长的影响,细胞分为对照组,加入含等量0.1%DMSO培养基;Ato处理组,培养4 d 神经元加入 Ato(0.1、1、5、10 μmol·L-1)作用48 h;第二部分观察Ato处理不同时间组对树突生长的影响,细胞分为对照组,加入含等量0.1%DMSO培养基;Ato处理不同时间组,将Ato 5 μmol·L-1加入培养4 d 神经元,分别作用12、24、48 h;第三部分检测Ato不同浓度处理组(0.1、1、10 μmol·L-1)作用 48 h 对 SYP、PSD-95 蛋白表达的影响;检测 Ato 1 μmol·L-1时处理不同时间组(12、24、48、96 h)对 SYP、PSD-95 蛋白表达的影响。
1.4 神经元树突形态学观察分析 体外培养神经元用配置CCD和Tsview软件的Olympus CKX41型倒置相差显微镜,结合MAP2免疫荧光染色,用10倍或20倍物镜观察以确保将1个神经元拍摄到1个视野中,分析时采取了Ohara和Havton的命名法[11]:从胞体直接伸出的树突分支为一级分支,用Image J软件测量,随机选取的1个神经元TDBL,并计数这个神经元PDN。计数样本来自3个不同批次培养的神经元,每批次选取10~15个细胞。为了减少实验误差,实验采取双盲方法进行。
1.5 免疫荧光染色检测SYP、PSD95表达 培养7 d的皮层神经元,移去培养基,用冷的PBS漂洗3次;用新鲜配置的4%的多聚甲醛室温固定30 min,PBS漂洗3次,每次10 min;0.3%Triton X-100作用30 min,PBS漂洗3次,每次10 min;室温下3%山羊血清封闭30 min;加入MAP2、SYP、PSD-95抗体 (1∶100)4℃过夜,PBS漂洗后,加入异硫氰酸荧光素(FITC)或罗丹明(TRITC)标记的二抗作用2 h,PBS漂洗后Hoechst 33258核复染10 min。荧光倒置显微镜下检测MAP2、SYP、PSD-95表达。
1.6 Western blot检测 SYP、PSD95蛋白表达水平原代培养的皮层神经元,经各种药物处理不同时间后,用冷的PBS冲洗,立即放入预冷的裂解缓冲液中(1%Triton,0.1%SDS,0.5%Deoxycholate,1 mmol·L-1EDTA,20 mmol·L-1Tris(pH 7.4),150 mmol·L-1NaCl,10 mmol ·L-1NaF,1 mmol·L-1Na3VO4,0.1 mmol·L-1PMSF),4℃ 超声粉碎后,12 000×g离心30 min,取上清,用BCA法测定蛋白质含量,以牛血清白蛋白(BSA)为标准品,将各组蛋白浓度调成一致。用10%~12%的SDS-PAGE分离蛋白质,每个泳道蛋白上样量为20 μg。为了准确判断目的蛋白带的位置,一个泳道加See Blue Plus 2预染蛋白标记物,电泳后将PAGE凝胶中的蛋白质电转移至硝酸纤维素膜上,取出后将膜放入3%BSA阻断缓冲液中,封闭60 min,再用TBS[10 mmol·L-1Tris(pH 8.0),150 mmo·L-1NaCl]洗膜 3次,每次10 min。将膜放入一抗中(1∶1 000),4℃过夜。TTBS冲洗后,将膜放入二抗(1∶1 000)中,室温孵育1~2 h,然后用TTBS洗膜3次,每次10 min,将膜在SuperSignal West Pico底物工作液中孵育5 min,吸干多余试剂,放置化学发光凝胶系统分析仪中进行ECL化学发光。测定SYP、PSD-95。每个抗体测定时都进行β-肌动蛋白测定,以保证蛋白上样量的一致性。利用Visionworks 6.3.3.图像采集及分析软件对蛋白带进行分析。实验重复3次。
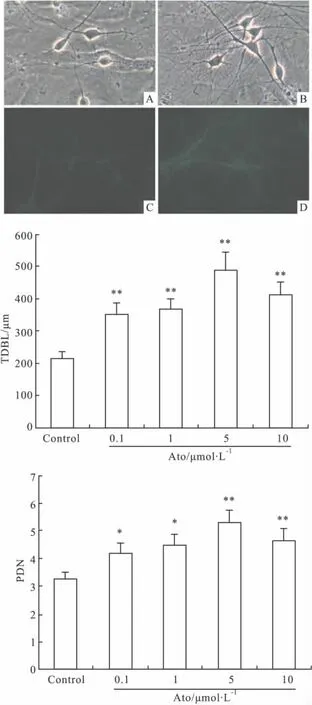
Fig 1 Effect of atorvastatin on the growth of dendrite cultured cortical neurons in vitro
2 结果
2.1 阿托伐他汀对培养皮层神经元树突的影响应用倒置相差显微镜和MAP2免疫荧光染色,观察发现Ato处理组(Ato 5 μmol·L-1)可促进皮层神经元树突生长(Fig 1);应用Tsview软件测量神经元TDBL和PDN,结果Ato能促进皮层神经元TDBL、PDN增加(Fig 1)。
2.2 阿托伐他汀处理不同时间对皮层神经元树突的影响 根据不同浓度Ato处理组对树突的影响,我们选用Ato的最佳浓度5 μmol·L-1加入培养4 d神经元分别作用12、24、48 h,结果显示,Ato作用24 h,就可使培养神经元TDBL和PDN均明显增加,Ato作用48h后TDBL、PDN进一步增加 (Fig 2),但Ato 12 h这种作用不明显。
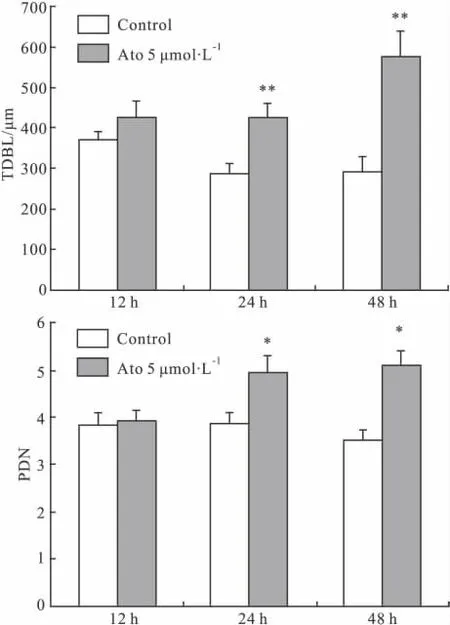
Fig 2 The quantitative analysis of the results of TDBL,PDN affected by atorvastatin at different time points in each group(n=30)
2.3 阿托伐他汀对皮层神经元突触素和突触后致密蛋白95蛋白表达的影响 Fig 3结果显示,正常对照组SYP、PSD-95呈特征性颗粒状或点状分布于胞体周围和沿着神经元突起分布,染色浅且荧光表达强度较暗(Fig 3A、C)。Ato(5 μmol·L-1)作用48 h可使SYP和PSD95表达量明显增多,点状小颗粒连成细丝,能映衬出突起分支的轮廓;荧光表达强度也明显增强(Fig 3B,D),说明Ato能上调皮层神经元SYP、PSD-95蛋白表达水平。

Fig 3 Expression of SYP and PSD-95 affected by atorvastatin with immunofluorescence,green shows SYP,red shows PSD-95,blue shows Hoechst 33528 nuclear redyeing
Fig 4 Western blot结果进一步证明了Ato(0.1、1、10 μmol·L-1)作用48 h 可明显增加 SYP 蛋白表达水平(P<0.01),Ato 1 μmol·L-1作用最明显。应用Ato作用12 h就可使SYP蛋白表达明显增加(P<0.05),随着给药时间延长,其作用进一步增加。
Fig 5 Western blot结果进一步证明了Ato(0.1、1、10 μmol·L-1)作用 48 h 可明显增加 PSD-95 蛋白表达水平(P<0.05),Ato 1 μmol·L-1作用最明显。应用Ato作用12 h就可使PSD-95蛋白表达明显增加(P<0.05),随着给药时间延长,作用进一步增加,应用Ato作用48 h达到高峰。
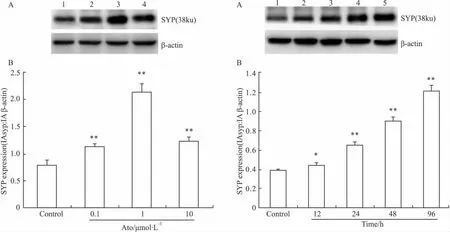
Fig 4 Concentration-dependent effect of atorvastatin on synaptophysin(SYP)protein levels in rat cortical neurons by Western blot.B is semiquantitative result of A(±s,n=3)*P<0.05,**P<0.01 vs control group.
3 讨论
神经元树突具有接受刺激并将冲动传入细胞体的功能。树突表面可见许多棘状突起,称树突棘,是神经元间形成突触的主要部位。树突分支的增加可以提供更多的表面进行突触发生[11],因此树突的发育决定了神经元接受到突触的数目和方式,所以树突生长出现缺陷的结果是非常严重的,常常伴随着一些神经退行性疾病如AD。因此突起正常的生长和分支对神经系统正常行使功能是很关键的。
大量研究显示在神经元刚分化出树突和轴突后,突触蛋白基因表达合成包含突触前和突触后蛋白复合物的囊泡,此时当轴突和树突接触就形成初步配对的暂时性突触联系,最终由突触活动决定这些突触会稳定存在还是消失。SYP和PSD-95作为突触功能的分子标志,分别代表了突触前和突触后的可塑性过程,在皮层可塑性中发挥作用。说明突触蛋白在反应性的突触发生过程中起重要作用并参与发育神经元的突触形成。早期研究发现AD患者脑内的突触蛋白均有降低。Ho等[12]采用重排的方法筛选了人的6 794种候选基因,结果发现synapsin-Ⅱ基因在早期AD患者的皮质中的表达减少,提示synapsin-Ⅱ的表达在AD的早期有一定的调节作用。另有研究表明AD患者脑中残存的突触终端,在Aβ聚集的同时伴有PSD-95的减少、突触后结构的改变[13],这一改变可能与NMDA受体过度激活所引起的钙超载有关[14]。
本实验研究了不同浓度、不同时间条件下,Ato促进皮层神经元树突生长和SYP、PSD-95蛋白表达,结果表现为Ato剂量依赖性的增加TDBL、PDN。可更有意义的是Ato并未剂量依赖性的增加SYP、PSD-95 表达,反而是当 Ato 1 μmol·L-1时 SYP、PSD-95 表达达高峰,而 Ato 10 μmol·L-1增加 SYP、PSD-95 的效果不及 Ato 1 μmol·L-1,我们考虑为药物浓度过大可能会对神经元产生抑制作用。就本次研究发现而言,对于直接作用于神经元的化学物质,往往破坏神经元内在平衡机制,当浓度过大时可能会对神经元产生一种不良反应或毒性,其深层机制有待于进一步研究。
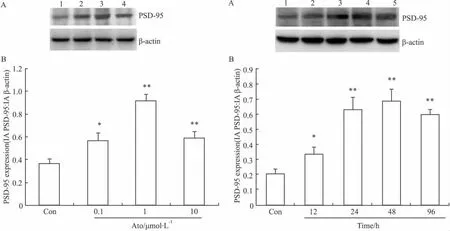
Fig 5 Concentration-dependent effect of atorvastatin on PSD-95 levels in rat cortical neurons by Western Blot.B is semiquantitative result of A(±s,n=3).*P<0.05,**P<0.01 vs control group
[1]Cully M,You H,Levine A J,et al.Beyond PTEN mutations:the PI3K pathway as an integrator of multiple inputs during tumor genesis[J].Nat Rev Cancer,2006,6(3):184-92.
[2]Staal S P,Hartley J W,Rowe W P.Isolation of transforming marine leukemia viruses from mice with a high incidence of spontaneous lymphoma[J].Proc Natal Acad Sci USA,1977,74(7):3065-7.
[3]Staal S P.Molecular cloning of the akt oncogene and its human homologues AKT1 and AKT2:amplification of AKT1 in a primary human gastric Aden carcinoma[J].Proc Natl Acad Sci USA,1987,84(14):5034-7.
[4]闵 嵘,秦 川,赵志炜,等.APP17肽对APP转基因小鼠突触相关蛋白表达的影响[J].中国药理学通报,2006,22(6):710-4.
[4]Min R,Qin C,Zhao Z W,et al.Effect of APP17 peptide on the expression of synaptic associated protein in amyloid precursor protein transgenic mice[J].Chin Pharmacol Bull,2006,22(6):710-4.
[5]Koseoglu S,Lu Z,Kumar C,et al.AKT1,AKT2 and AKT3-dependent cell survival is cell line-specific and knockdown of all three isoforms selectively induces apoptosis in 20 human tumor cell lines[J].Cancer Biol Ther,2007,6(5):755-62.
[6]Lawlor M A,Alessi D R.PKB/Akt:a key mediator of cell proliferation,survival and insulin responses[J].J Cell Sci,2001,114(Pt 16):2903-10.
[7]Heitman J,Movva N R,Hall M N.Targets for cell cycle arrest by the immunosuppressant rapamycin in yeast[J].Science,1991,253(5022):905-9.
[8]Wullschleqer S,Loewith R,Hall M N.TOR signaling in growth and metabolism[J].Cell,2006,124(3):471-84.
[9]Zhou X,Tan M,Stone Hawthome V,et al.Activation of the Akt/mammalian target of rapamycin/4E-BP1 pathway by ErbB2 over expression predicts tumor progression in breast cancers[J].Clin Cancer Res,2004,10(20):6779-88.
[10]Debnath J,Walker S J,Brugge J S.Akt activation disrupts mammary acinar architecture and enhances proliferation in an mTOR-dependent manner[J].J Cell Biol,2003,163(2):315-26.
[11]Stroemer R P,kent T A,Hulsebosch C E.Neocortical neural sprouting.Synaptogensis,and behavioral recovery after neocortical infarction in rats[J].Stroke,1995,26(11);2135-44.
[12]Ho L,Guo Y,Spielma L,et al.Altered expression of a-type bue not b–type synapsin isoform in the brain of patients at high risk for Alzheimer's disease asscssed by DNA microarray technique[J].Neurosci Lett,2001,298(3):191-4.
[13]Gylys K H,Fein J A,Yang F,et al.Synaptic changes in Alzheimers disease increased amyloid-beta and gliosis in surviving terminals is accompanied by decreased PSD-95 fluorescence[J].Am J Pathol,2004,165:1809-17.
[14]Kelly B L,Ferreira A.beta-Amyloid-induced dynamin 1 degradation is mediated by N-methyl-D-aspartate receptors in hippocampus neurons[J].J Biol Chem,2006,281:28079-89.
