我国医疗器械标准化现状及发展策略研究
2013-12-05田小俊徐红蕾彭晓龙
【作 者】田小俊,徐红蕾,彭晓龙
国家食品药品监督管理局广州医疗器械质量监督检验中心,广州市,510663
0 引言
医疗器械标准是医疗器械生产企业研发及生产产品的重要依据,也是医疗器械监管部门行使职权的法定依据,更是医疗器械生产企业开拓国际市场的先决条件。随着医疗器械行业的迅猛发展,以及经济全球化的逐步加深,“技术专利化-专利标准化-标准许可化”已经成为高新技术企业发展的基本模式,那么标准自然也就成为最新的核心竞争力。
1 我国医疗器械标准化现状
我国自1984年发布第一个医疗器械标准以来,医疗器械标准的数量是急速增长,表明医疗器械标准体系渐趋完善,但仍存在着覆盖面较窄,标龄偏长,质量较低,基础研究薄弱,以及各参与主体协同机制不完善等问题[1-3]。
1.1 医疗器械标准现状
据统计[1],截至2011年11月底,现行有效医疗器械标准1051项,其中国家标准187项,行业标准864项。2012年8月,有专家对我国现行有效医疗器械标准的标龄进行统计分析[2],结果显示标龄大于10年的国家标准占22%,行业标准占13.5%,而且还有标龄大于20年的国家标准和行业标准仍在使用。
1.2 医疗器械标准制修订现状
2009年国家食品药品监督管理局医疗器械标准管理中心(标管中心)成立,对加强和规范我国医疗器械标准管理,提高医疗器械市场运作效率,保证生产、审批、监管各个环节的安全,起到了积极的促进作用。标管中心统筹管理全国22个医疗器械标准化技术委员会(标技委),22个标技委中有21个秘书处挂靠在9个国家级医疗器械检测中心[2]。
从目前实际情况来看,标准化制修订工作还存在很多问题,主要表现在以下几个方面:(1)医疗器械标准体系不完整。现有医疗器械标准不能涵盖市场上所有产品,如组织工程医疗产品标准。标技委的设置应随着产业的发展不断补充或调整。(2)标准制修订机构技术力量薄弱。自标管中心成立以来,对我国医疗器械的统筹规划做出了积极的贡献。但软件建设方面还有所欠缺,急需建立统一的标准制修订工作平台,以及标准发布和检索平台。(3)标技委人员结构不合理。目前,标技委人员结构中管理者和研究者占大多数,处于绝对的主导地位,而使用者和制造者仅占小部分[3]。这种人员结构极不利于市场信息的有效反馈,不符合市场经济中企业为创新主体的规律,必将导致标准滞后于市场。(4)标准研究工作不足。22个标技委中有19个为产品类标技委,3个基础类标技委,说明我国对基础标准的研究力度不足,如医疗器械动物源性产品的毒性灭活方法、外源性因子的检验方法、免疫毒性检验方法等均为空白[4]。目前,我国大部分医疗器械标准仍是直接转化国际标准,自主研制的标准很少。高新技术产品缺乏相应的行业标准或国家标准,不能满足监管需求。我国急需加快标准自主创新能力建设。
2 中国标准化的发展对策
医疗器械标准制修订是一项复杂的系统的工程,受到监管制度、创新体制和市场环境等因素的影响[5]。在我国医疗器械标准制修订过程中涉及人群较广,可将其分为六类:(1)管理者:负责统筹标准制修订工作,负责标准的制定与评定,如国家食品药品监督管理局、标准化技术委员会;(2)协助者:负责向管理者提供决策建议,参与标准的制定和宣贯,如中国医疗器械行业协会、学会;(3)制造者:执行标准化的制造者,如原材料生产企业、医疗器械生产企业;(4)使用者:标准化工作的最终对象,如医院、患者;(5)技术研究者:指从事医疗器械科技研发的工作者;(6)标准研究者:指从事标准本身架构研究的工作者。以上六大主体在标准化进程各阶段中的角色如图1所示。
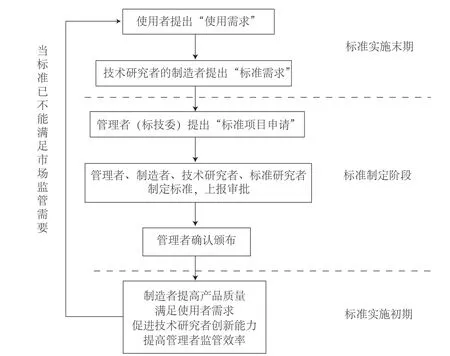
图1 我国医疗器械标准制修订程序及各参与主体角色分工Fig.1 Chinese medical device standards developing and revising process and participants’ role
要解决我国医疗器械标准化工作现存的问题,可以从以上六大主体的职责,及其优势出发,提出以下对策:
(1) 加快制定我国医疗器械标准化建设的战略目标。一项国际标准不仅能为标准制定国带来重大的经济利益,同时也体现了该国在相应行业的领先地位。我国已经意识到医疗器械标准化建设的重要性,但还未制定出相应的战略目标。
(2)补充或调整标技委设置,加大基础类标准的研究力度,建立完善的医疗器械标准体系。在现有22个医疗器械标技委的基础上,加强对基础类标准的研制投入。例如通过借鉴美国材料与试验协会(American Society for Testing Materials,ASTM)的工作组设置及工作机制,结合我国产业现状,建立适合我国国情的标准化技术委员会,如组织工程医疗产品标准化技术委员会。
(3)建立以企业为主体、产学研结合的标准化工作机制。根据所制定标准的类别确定人员结构。产品类标准制修订人员应以企业为主体,产品研发初期,鼓励监管领域专业人员共同参与技术标准的探索;产品研发中后期,监管机构与企业合作共同起草标准;待技术成熟时,标准颁布,同时新产品投放市场,进入标准与技术的良性互动阶段,同时酝酿新一代产品及标准。基础类标准制修订人员应以科研机构为主体,结合产业需求,政府监督协调,颁布实施。最终目的在于提高标准化工作各主体的参与积极性,构建各主体之间的协同创新机制。
(4)合理采纳国际标准,提升自主创新能力。积极参加国际标准化活动的同时,坚持自主制定标准。唯有在了解国际大环境的前提下,帮助本国优势企业制定标准,也为本国自主创新产品占领国际市场创造有利契机,同时提升本国在该产品领域的行业地位。
(5)加大对全国医疗器械标准制修订工作网络平台的建设。借助信息化技术完善标准的发布和检索平台,提升标准化工作的效率和质量。
(6)注重标准化人才的储备与选拔。加大各大院校对医疗器械相关专业的设置,培养一批具有竞争优势的专业化人才队伍。也可以在科研院所中设立一批标准研究中心,与高等院校联合培养标准化专业人才,为标技委、企业、学会、协会、监管部门输送专业人才,并建立有效的人才保障机制。同时注重国际化标准化人才的培养,此类人才不仅要掌握专业领域内的知识,还要有国际视野,良好的英文水平,洞悉各国产业状况和政策趋向。
3 结语
随着我国科学技术的发展及国内外医疗器械产业格局的调整,我国医疗器械标准化建设也面临着新的机遇和挑战,需要在组织、机构、管理、权责、人才、金融、信息化等方面进行一系列的改进,建立起一套科学合理的制度,我国医疗器械的标准化建设工作任重而道远。
[1]王宝亭.在开拓创新中前行——2011年全国医疗器械监管工作成果盘点[N].中国医药报,2012-01-19.
[2]储云高,朱颖峰,钱虹,等.对我国医疗器械标准体系建设的几点建议[J].上海食品药品监管情报研究,2012,8: 21-26.
[3]董放.对医疗器械标准技术委员会的几点思考[J].中国药物警戒,2010,17(4): 211-213.
[4]杜然然.我国医疗器械标准化建设的协同机制研究[D].北京协和医学院,2012.
[5]Lyytinen K,King JL.Around the cradle of the wireless revolution:the emergence and evolution of cellar telephony[J].Telecommun Policy,2002,26(34): 97-100.
