苯并[a]芘和镉暴露对食蚊鱼求偶行为的影响
2013-12-03谢勇平方展强
苏 方,谢勇平,方展强
(华南师范大学生命科学学院广东省高等学校生态与环境科学重点实验室,广州510631)
随着工业的快速发展,向水环境排放污染物的种类和数量也越来越多。研究表明,一些污染物影响水生脊椎动物生长发育的内分泌调节过程[1],这些污染物被称为环境内分泌干扰物(Endocrine-Disrupting Chemicals,简称EDCs)。其中多环芳烃(PAHs)如苯并〔a〕芘(BaP)是一种很强的致畸、致突变剂和内分泌干扰物[2,3],已有研究表明,BaP主要影响动物的雄激素分泌系统[4]。镉(Cadmium,Cd)是常见的环境和工业污染物,镉离子(Cd2+)有一定的致癌和致突变特性[5]。一些研究也表明Cd2+具有雌激素活性,也影响雌激素分泌[2,6]。食蚊鱼(Gambusia affinis)属鳉形目,胎鳉科,食蚊鱼属,原产于中南美,后引入中国,因嗜吃蚊子幼虫而得名[7]。食蚊鱼分布广泛,能够耐受很多不同的环境同时能够生存在污染较严重的水体中。雄性食蚊鱼是非常理想的监测水体中EDCs的指示生物,它们在雄激素或雌激素的控制下所产生的性别特征非常容易区别[8-10]。因此,本课题选取食蚊鱼作为研究对象,通过室内暴露实验来研究水体中存在的低浓度BaP和Cd2+暴露对成年雄性食蚊鱼的求偶行为的影响。同时进行了成年雌性食蚊鱼的暴露实验,研究经暴露后其对成年雄鱼向雌鱼求偶行为所产生的影响,从而了解水环境中BaP、Cd2+污染对食蚊鱼个体生殖行为的负面生物效应,探讨BaP、Cd2+对鱼类是否具有类雌激素效应,分析BaP和其对鱼类繁殖内分泌生理过程的干扰而导致其生殖行为上的变化,其研究成果将为水环境污染的保护与恢复工作提供有价值的数据和资料。
1 材料与方法
1.1 实验试剂
BaP试剂,CdCl2试剂。由于B[a]P在水中的溶解度极低,因此使用高纯度的二甲基亚砜(dimethyl sulfoxide,DMSO,99.8%,sigma)作为助溶剂配制成保存液。DMSO在预实验中已证明其对实验结果没有产生明显的影响。
1.2 实验动物
食蚊鱼购自广州市花鸟鱼虫市场,室内驯养1个月,驯养期间每日喂食红虫2次,每3 d换水1/3,及时清除沉积物。随机挑选驯养后体长相近的性成熟雄(♂)、雌(♀)鱼各45尾(性成熟♂、♀鉴别:将雄鱼放入冰水混合液中使其麻痹,在解剖镜下观察其生殖鳍末端具有钩状结构即为成年雄鱼;雌鱼个体较大,均没有生殖鳍的结构,挑选具有胎斑的为怀妊个体,属性成熟的雌鱼,图1-1)。雄鱼平均体长26 mm,雌鱼体长35~43 mm。
1.3 实验方法
1.3.1 BaP和Cd2+暴露实验设置
BaP暴露:设定0.1和100 μg/L浓度暴露组,另设浓度为0的对照组,每组雄鱼与雌鱼各15尾,分别放入3个15L的40 cm×25 cm×30 cm的玻璃鱼缸中。暴露期间水温保持在26℃,每日喂食红虫两次,每2 d换水一次,保持溶液所设置的暴露浓度不变,并保持缸中水是流动循环的。BaP暴露分别于2010年6月18日—7月30日(持续暴露6周)和2010年6月18日—8月13日(持续暴露8周)。

图1 食蚊鱼3种求偶行为Fig 1 3 kinds of courtship behavior of mosquitofish
Cd2+暴露:设定5和500 nmol/L浓度暴露组,另设浓度为0的对照组,每组雄鱼与雌鱼各15尾,分别放入3个15L的40 cm×25 cm×30 cm的塑料鱼缸中。暴露期间保持温度在26℃,每日喂食红虫两次,每2 d换水一次,保持溶液所设置的暴露浓度不变,并保持缸中水是流动循环的。Cd2+暴露分别于2010年6月27日—8月8日(持续暴露6周)和2010年6月18日—8月22日(持续暴露8周)。
1.3.2 食蚊鱼配对求偶行为实验分组
分别从暴露BaP和Cd2+6周后不同浓度组和对照组中随机挑选健康雄鱼和腹部带有孕斑黑点的雌鱼进行实验。分别将各组雌、雄鱼分开置于装有15L清水的鱼缸中适应1 d时间。暴露8周的BaP和Cd2+组的食蚊鱼也按上述方法先进行处理。食蚊鱼配对求偶行为的实验分组见表1和表2,每组至少观察5对(n=5),最高达9对(n=9)。分别记录暴露6周和8周后食蚊鱼的求偶行为。
对食蚊鱼3种求偶行为的观察时间共3 d,每天从上午8点至12点进行。将已分开的雌、雄个体按照观察分组的设定,各随机选取1♂:1♀配对放入同一鱼缸中。混合1 min后开始用JVC录像机进行录像,每对录像时间是10 min。每组进行3次录像,录像完毕后,将食蚊鱼放入原来暴露时期的鱼缸中。同时分别进行重复实验。

表1 食蚊鱼BaP和Cd2+暴露6周实验分组Table 1 Experimental groups of mosquitofish exposed to BaP and Cd2+for 6 weeks

表2 食蚊鱼BaP和Cd2+暴露8周实验分组Table 2 Experimental groups of mosquitofish exposed to BaP and Cd2+for 8 weeks
将记录的数据通过SPSS17.0及Excel计算均值和标准差。除此之外,还进行单因素方差(ANOVA)分析的方差齐性检验分析总体样本方差的差异性,当P<0.05时,认为差异显著,再用独立样本T检验每两组间的差异性。所有数据和图表均以平均值±标准差的方式表示。
2 结果
2.1 雄鱼BaP暴露后对其求偶行为的影响
如图2-A所示,经BaP暴露6周后雄鱼对雌鱼其3种求偶行为平均次数均减少,且随着暴露浓度的增加而依次降低。实验组1(BaP 0.1 μg/L)和实验组2(BaP 100 μg/L)与对照组相比,在交配次数上明显低于对照组(P<0.01)。实验组2在靠近行为次数上较对照组减少明显(P<0.05)。BaP暴露6周后食蚊鱼的追尾行为次数虽然有所下降,但与对照组比较并没有较大差异(p>0.05)。
1.3.3 录像分析
通过录像统计食蚊鱼3种求偶行为的次数,包括:1)靠近行为;2)交配行为;3)追尾行为。食蚊鱼的繁殖行为曾有报道[6],结合本研究的观察,本文也将雄鱼繁殖行为区分为3种方式:靠近行为(图1-2)、交配行为(图1-3,1-4,1-5,1-6)和追尾行为(图1-7,1-8)。当雄鱼表现为靠近行为时,它会跟在雌鱼后面游动,头部正对着雌鱼的生殖口。交配通常是雄鱼生殖鳍强行插入雌鱼生殖孔。在这个过程中,雄鱼从后方靠近雌鱼,用力把生殖鳍插入雌鱼的生殖管里[7]。而追尾行为是靠近行为里的一种,这时雄鱼会紧挨着雌鱼的生殖口并且快速跟随雌鱼游动。本文详细记录其观察结果,以上的3种求偶行为在录像中可以清楚地分辨出来。
1.3.4 统计数据
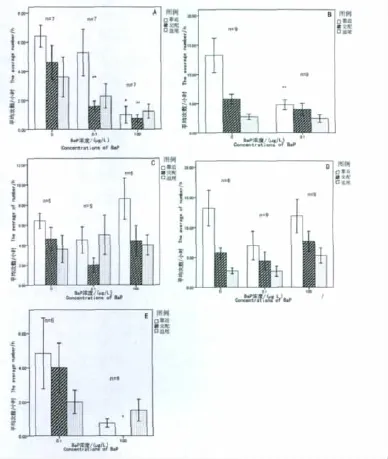
图2 BaP暴露雄、雌鱼6周或8周后其对雄鱼求偶行为(次数/小时)的影响Fig 2 Effects on the courtship behavior frequency of male mosquitofish exposed to BaP after 6 and 8 weeks
如图2-B所示,实验组7雄鱼暴露在BaP 0.1 μg/L 8周后其较对照组雄鱼对雌鱼的3种求偶行为平均次数下降,其中靠近次数远少于对照组,两组间在靠近次数上差异非常显著(P<0.01)。表明雄鱼在低浓度BaP暴露8周后其求偶行为,尤其是靠近行为受到影响明显且次数降低。
2.2 雌鱼BaP暴露后对雄鱼向其求偶行为的影响
如图2-C所示,实验组3雌鱼经BaP 0.1 μg/L暴露6周后,雄鱼向其靠近和交配行为平均次数比对照组中有所减少,追尾行为次数则略有上升。而实验组4雌鱼经BaP 100 μg/L暴露6周后,雄鱼除了靠近行为平均次数增多,其他两种求偶行为次数与对照组相近。对照组与实验组3和实验组4在求偶行为次数上分别没有明显差异(P>0.05),表明雌鱼暴露BaP后对雄鱼向其求偶的行为不会产生明显影响。
如图2-D所示,实验组8雌鱼经BaP 0.1 μg/L暴露8周后,雄鱼向其的求偶行为中靠近与交配行为平均次数低于对照组,追尾平均次数则维持相同水平。实验组9雌鱼经BaP 100 μg/L暴露8周后,雄鱼向其的求偶行为中除了靠近平均次数略微下降外,交配与追尾的平均次数都比对照组有所上升。对照组与实验组8和实验组9之间虽然分别没有显著性差异(P>0.05),但仍可见雌鱼在低BaP浓度(0.1 μg/L)中暴露8周后,雄鱼对其的求偶行为次数有所减少;而雌鱼在高浓度BaP(100 μg/L)暴露8周后,雄鱼对其求偶行为次数都呈升高的趋势。
2.3 雌、雄鱼BaP同时暴露后对雄鱼向雌鱼求偶行为的影响
如图2-E所示,观察了实验组5和实验组6雌、雄鱼分别同时暴露在BaP浓度分别为0.1和100 μg/L的每对食蚊鱼的求偶行为。可见,实验组5雄鱼向雌鱼求偶行为平均次数比实验组6的次数多,两组在交配平均次数上存在着极为明显的差别,实验组6的交配平均次数为0,即在高浓度100 μg/L的BaP暴露6周后的雌鱼对雄鱼的交配行为起到了阻碍的作用。
2.4 雄鱼Cd2+暴露后对其求偶行为的影响
由图3-A可见,实验组1雄鱼经Cd2+5 nmol/L暴露6周后其对雌鱼3种求偶行为平均次数低于对照组次数。实验组2雄鱼经Cd2+500 nmol/L暴露6周后对雌鱼其靠近和交配平均次数比对照组少,但追尾平均次数有所增加,同时实验组2雄鱼的3种求偶行为平均次数也比实验组1有所增加。但对照组与实验组1和实验组2之间的3种求偶行为分别都没有显著差异(P>0.05)。表明在5和500 nmol/L的Cd2+中暴露6周后的雄鱼,它的求偶行为没有因为Cd2+暴露而受到较大的影响。
图3-B所示,实验组7雄鱼暴露在Cd2+5 nmol/L和实验组8雄鱼暴露在Cd2+500 nmol/L 8周后分别与对照组比较,3种求偶行为平均次数存在显著差异(P<0.05),其中交配平均次数存在极显著差异(P<0.01)。求偶行为次数随着暴露Cd2+浓度的增加而下降,暴露8周Cd2+后的雄鱼其求偶行为受到较大影响而减少。

图3 Cd2+暴露雄、雌鱼6周或8周后其对雄鱼求偶行为(平均次数/小时)的影响。Fig 3 Effects on the courtship behavior frequency of male mosquitofish exposed to Cd2+after 6 and 8 weeks
2.5 雌鱼Cd2+暴露后对雄鱼向其求偶行为的影响
由图3-C所示,实验组3雌鱼暴露在Cd2+5 nmol/L 6周后,与对照组相比,雄鱼对其的3种求偶行为平均次数相近;而实验组4雌鱼暴露在Cd2+500 nmol/L 6周后与对照组相比,雄鱼对其的3种行为次数均有所增加。但是对照组与实验组3和实验组4分别对照,其差异都不显著(P>0.05),表明雌性食蚊鱼暴露在Cd2+中,并不影响雄鱼对其求偶行为。
图3-D所示,实验组9雌鱼暴露在Cd2+5 nmol/L和实验组10雌鱼暴露在Cd2+500 nmol/L 8周后,与对照组相比,雄鱼对其的靠近平均次数较对照组减少,交配平均次数保持稳定,追尾平均次数在实验组9略为上升,实验组10稍微下降,但均比对照组高。实验组9和实验组10雄鱼的求偶行为平均次数与对照组不存在显著差异(P>0.05),说明分别暴露在浓度为5 nmol/L和500 nmol/L的Cd2+中的雌鱼对雄鱼求偶行为影响不大。
2.6 雌、雄鱼Cd2+同时暴露后对雄鱼向雌鱼求偶行为的影响
图3-E所示,与对照组相比较,实验组5雌雄鱼同时暴露在5 nmol/L Cd2+中,其雄鱼向雌鱼求偶的行为平均次数少于实验组6雌雄鱼同时暴露在500 nmol/L Cd2+的次数。尤其是在交配行为次数上,分别暴露在Cd2+浓度为500 nmol/L的雌雄鱼是暴露在5 nmol/L Cd2+浓度的雌雄鱼的约4倍,但是与对照组相比,这两实验组雄鱼向雌鱼求偶的3种行为分别都没有显著差异(P>0.05),表明雌雄鱼都暴露在这两种浓度的Cd2+时,他们的求偶行为次数不会因为暴露浓度不同而产生明显差异。
图3-F可知,雌雄鱼都在Cd2+中暴露8周后,实验组11(Cd2+5 nmol/L)的食蚊鱼的求偶行为平均次数明显高于实验组12(Cd2+500 nmol/L)的食蚊鱼,尤其在靠近平均次数上两组间存在极为明显差别(P<0.01)。雌雄鱼在Cd2+500 nmol/L暴露8周后比在Cd2+5 nmol/L暴露时雄性食蚊鱼在靠近雌鱼行为上有明显减少,但其他两种行为没有太大变化,表明实验组12雄鱼的靠近行为是因为暴露浓度较高而受到显著影响,其下降明显。
3 讨论
3.1 BaP暴露对雄性食蚊鱼求偶行为的影响
雄鱼暴露在BaP中对其求偶行为影响很大,且随着暴露浓度增加与暴露时间的延长,其求偶行为与对照组的雄鱼相比呈下降趋势。靠近行为在求偶中先于追尾行为出现[11]。一般来说,雄鱼会尝试多次交配,但是只有很少的一部分交配行为能够成功将精子转移到雌鱼体内[12]。通过BaP暴露各组实验可知,这3种求偶行为平均次数依次是:靠近行为>交配行为>追尾行为。在较低浓度(0.1 μg/L)就已经对雄鱼交配行为有明显抑制作用,在较高浓度(100 μg/L)中雄鱼的靠近行为也开始显著下降。也就是说在0.1 μg/L的BaP暴露6周后的雄性食蚊鱼的求偶行为已经受到抑制作用。食蚊鱼求偶行为与鱼体内的睾酮浓度水平相关性表明,求偶行为至少有部分是受到雄激素的的控制[11]。有研究表明,雄性激素在鱼类和其他脊椎动物的求偶行为中有重要作用[11]。雄鱼的求偶行为会因为去除了生殖腺而受到干扰或消失,求偶行为也可在雄性激素调节下恢复[11]。由于BaP主要影响动物的雄激素分泌系统,且暴露BaP后的雄鱼求偶行为的减少,推测BaP可能减少雄鱼体内雄激素的分泌水平,从而在一定程度上降低了雄鱼的求偶行为。雄鱼求偶行为的减少会使得雌鱼怀孕的机率也随之减少。
本实验中,雌鱼暴露在BaP中对雄鱼的求偶行为与对照组的求偶行为没有显著差异,但是无论暴露时间是6周还是8周,在较低浓度一组(0.1 μg/L),雄鱼对其3种求偶行为有不同程度地减少,而在较高浓度一组(100 μg/L),雄鱼对其求偶行为次数比前者有所增加。推断,雌鱼无论暴露在高浓度或低浓度的BaP时,对雌鱼雌激素的分泌都没有产生明显的作用,低浓度中的求偶行为减少或高浓度中的求偶行为有所提高,有可能是由于受到样本个体间差异的影响所致。怀孕的雌鱼在腹部有一个明显的妊娠黑点(孕斑),它会随着怀孕的过程逐渐扩大[12]。Peden证实雌鱼的生殖口附近的妊娠黑点能够在求偶过程中吸引雄鱼[13]。在本实验过程中发现,雄鱼对妊娠黑点较大的雌鱼求偶行为次数比雌鱼腹部黑点较小的多,原因可能是除了BaP能够提高雌激素分泌外,雌鱼的雌激素分泌本身会随着怀孕的过程而增加,从而对雄鱼的吸引加强。但是本文发现,妊娠黑点的大小不会对雄鱼求偶行为产生较大的影响(P>0.05)。
将雄鱼与雌鱼同时暴露在浓度为100 μg/L的BaP中6周,雄鱼的求偶行为比暴露同样时间浓度为0.1 μg/L的要低很多,其中暴露100 μg/L的食蚊鱼交配平均次数为0,表明将雄鱼和雌鱼同时暴露在较高浓度的BaP中,雄鱼的求偶行为受到显著抑制。原因是由于高浓度BaP对雄激素水平的干扰,使得与之相关的求偶行为也受到了一定程度影响,特别是交配行为几乎不出现。在BaP暴露8周后,浓度为100 μg/L组中雄鱼全部死亡,导致本实验设置8周后100 μg/L组的缺失,也说明暴露在较高浓度的BaP(100 μg/L)8周后,还会对雄鱼有严重的致死效应。此外本实验结果还表明,水温与食蚊鱼的求偶行为也有密切相关,本文发现,暴露实验持续至8周雄鱼的3种求偶行为都比6周的要高。原因应该是与水温升高有关。有文献指出,温度和日照是调节硬骨鱼类年繁殖周期的基本环境影响因素。雌性食蚊鱼在春季开始繁殖活动是与水温逐渐升高有关,而繁殖期的的结束是由日照长度变短引起的[14]。
3.2 Cd2+暴露对食蚊鱼求偶行为的影响
暴露于Cd2+各组实验可见,雄鱼3种求偶行为平均次数依次是:靠近行为>交配行为>追尾行为。雄鱼暴露在Cd2+中6周后,在低浓度(5 nmol/L)的求偶行为均比对照组减少,而高浓度(500 nmol/L)求偶行为则有所上升。但对照组与实验组间不存在显著差异性说明可能是由于个体存在的差异导致。而暴露在Cd2+8周后,无论是低浓度组还是高浓度组与对照组比较都出现极为显著的差异,可能是暴露8周后,Cd2+对雄鱼求偶行为的抑制作用才变得十分明显。有研究表明Cd2+具有雌激素活性,也被称为环境雌激素,长期暴露下可能会扰乱雄鱼的雄性激素分泌,导致雄鱼求偶行为减少[15]。
雌鱼暴露在低浓度(5 nmol/L)Cd2+中6周和8周后,对雄鱼求偶行为产生影响很小。而暴露在高浓度(500 nmol/L)6周和8周后则能提高雄鱼对其的求偶行为,虽然暴露6周及8周的求偶行为与对照组没有差异,但由于Cd2+能够影响雌激素分泌系统,所以可能在高浓度下对雌鱼的雌激素分泌会有促进作用。将雄鱼和雌鱼暴露在高浓度(500 nmol/L)的Cd2+中,求偶行为都比低浓度(5 nmol/L)有所上升,尤其表现在交配次数上。但是暴露6周的两组间没有显著差异,可能是因为在Cd2+中暴露6周的雄鱼及雌鱼,他们的性激素分泌系统没有受到明显影响,只是个体间存在的差异所致。但是暴露8周后,高浓度的求偶行为都比低浓度的要低得多,且在靠近行为上有显著差异。可能是因为暴露时间增加后,Cd2+对食蚊鱼的性激素分泌系统的影响表现明显。虽然暴露在高浓度8周可能促使雌鱼的雌激素分泌增加,但是此时雄鱼的雄激素分泌受到严重干扰,所以最终雄鱼与雌鱼均暴露在高浓度8周后,它们的求偶行为下降明显。
4 结论
雄性食蚊鱼暴露在BaP及Cd2+中,其求偶行为随着暴露浓度的升高和暴露时间的延长而呈现下降趋势。雌性食蚊鱼暴露在BaP及Cd2+中,不影响雄鱼对其求偶行为。水体中的BaP及Cd2+主要影响雄性食蚊鱼的求偶行为,推测这与BaP及Cd2+会明显地影响雄鱼体内雄激素分泌水平有关。
[1]Batty J,Lim R.Morphological and reproductive characteristics of male mosquitofish(Gambusia affinis holbrooki)inhabiting sewagecontaminated waters in New South Wales,Australia [J].Archives of Environmental Contamination and Toxicology,1999,36:301-307.
[2]邓南圣,吴 峰.环境中的内分泌干扰物[M].北京:化学工业出版社,2004,7-10.
[3]刘宇红,于晓英,韩 宁.苯并[a]芘(BaP)的毒性作用与致毒机理研究现状[J].内蒙古农业大学学报,2008,29(1):184-188.
[4]任 仁,黄俊.哪些物质属于内分泌干扰物(EDCs)[J].安全与环境工程,2004,11(3):7-10.
[5]刁书永,张立志,袁 慧.镉中毒机理研究进展[J].动物医学进展,2005,26(5):49-51.
[6]雷 忻,李东升,张育辉.浅谈环境化学污染物的雌激素效应——环境雌激素[J].延安大学学报(自然科学版),2002,21(1):56-58,89.
[7]刘灼见,高书堂,邓 青.食蚊鱼的性腺发育及性周期研究[J].武汉大学学报(自然科学版),1996,42(4):487-493.
[8]Game C M,Gagnon M,Webb D,et al.Endocrine disruption in male mosquitofish(Gambusia holbrooki)inhabiting wetlands in Western Australia[J].Ecotoxicology,2006,15:665-672.
[9]Hou L,Xie Y,Ying G,et al.Developmental and reproductive characteristics of western mosquitofish(Gambusia affinis)exposed to paper mill effluent in the Dengcun River,Sihui,South China[J].A-quatic Toxicology,2011,103(3-4):140-149.
[10]Wen R,Xie Y,Wan C,et al.Estrogenic and androgenic effects in mosquitofish(Gambusia affinis)from municipal effluent contaminated streams in Guangzhou,China[J].Aquatic Toxicology,2013,132-133:165-172.
[11]Toft G,Guillette Jr L J.Decreased sperm count and sexual behavior in mosquitofish exposed to water from a pesticide-contaminated lake[J].Ecotoxicology and Environmental Safety,2005,60:15-20.
[12]Doyle C,Lim R.Sexual behavior and impregnation success of adult male mosquitofish following exposure to 17 beta-estradiol[J].Ecotoxicology and Environmental Safety,2005,61:392-397.
[13]Krotzer M J.The effects of induced masculinization on reproductive and aggressive behaviors of the female mosquitofish,Gambusia afinis affinis[J].Environmental Biology of Fishes,1990,29:127-134.
[14]Koya Y,Iwase A.Annual reproductive cycle and rate of the spermatogenic process in male mosquitofish Gambusia affinis[J].Ichthyological Research,2004,51:131-136.
[15]刘 冰.镉和苯并[a]芘对长江河口弹涂鱼(Periophthamus modestus)毒性效应的研究[D].上海,华东师范大学,2007.
