左乙拉西坦片在健康人体内的生物等效性研究
2013-12-03何小爱刘智朱刚直海口市人民医院暨中南大学湘雅医学院附属海口医院海口57008湖南泰格湘雅药物研究有限公司长沙41000
何小爱,刘智,朱刚直(1.海口市人民医院暨中南大学湘雅医学院附属海口医院,海口57008;.湖南泰格湘雅药物研究有限公司,长沙 41000)
左乙拉西坦(Levetiracetam)为吡拉西坦的类似物,是一种新型抗癫痫药,用于成人及4岁以上儿童癫痫患者部分性发作的添加治疗。与传统的抗癫痫药相比,左乙拉西坦作为添加治疗对于儿童各型癫痫均有疗效,尤其对于复杂局限性发作、肌阵挛发作等具有较好的治疗效果,且不良反应轻,是一种安全性好、疗效佳的抗癫痫新药;对于成人耐药性癫痫部分性发作治疗亦有效,且不良反应轻,对耐药性癫痫患者是一种有益的选择。本试验对2个不同厂家生产的左乙拉西坦片进行人体相对生物利用度测定,从而作出生物等效性评价。
1 材料
1.1 仪器
1200型高效液相色谱仪,包括在线脱气机、自动进样器、四元泵、柱温箱、紫外检测器及Chemstation化学工作站(美国安捷伦公司);AB135-S十万分之一天平(瑞士梅特勒托利多公司);TGL16 M型冷冻离心机(长沙英泰仪器有限公司);AHL-2001-P型实验室纯水系统(重庆颐洋企业发展有限公司)。
1.2 药品与试剂
受试制剂:左乙拉西坦片(天津泰普药品科技发展有限公司,规格:每片250 mg,批号:20110304);参比制剂:左乙拉西坦片(UCB Pharma S.A,规格:每片250 mg,批号:31745);左乙拉西坦对照品(天津药物研究院药业有限责任公司,含量:99.87%,批号:101201);内标:戊巴比妥钠对照品(北京化学试剂公司,批号:061206);乙腈为色谱纯,其他试剂均为分析纯。
2 方法
2.1 色谱条件
色谱柱:Ultimate LP-C18(250 mm×4.6 mm,5 μm);保护柱:Ultimate LP-C18(10 mm×4.6 mm,5 μm);流动相:0.6%磷酸水溶液-乙腈[梯度洗脱程序:0~8.45 min,84∶16(V/V)];8.45~8.5 min,由84∶16(V/V)均匀变换到10∶90(V/V);8.5~9.45 min,10∶90(V/V);9.45~9.5 min,由10∶90(V/V)均匀变换到84∶16(V/V);流速:1 ml/min;柱温:40℃;进样量:20 μl;检测波长:210 nm。
2.2 溶液的配制
2.2.1 左乙拉西坦贮备液:准确称取左乙拉西坦对照品10 mg,置于10 ml量瓶中,以少量水溶解后,加水至刻度线,摇匀,即得含左乙拉西坦浓度为1 g/L的贮备液,置于4℃冰箱保存。
2.2.2 内标溶液:准密称取戊巴比妥钠对照品10 mg,置于10 ml量瓶中,用少量水溶解后,加水至刻度,摇匀,即得浓度为1 g/L的内标戊巴比妥钠贮备液,置于4℃冰箱保存。临用前将内标贮备液用水稀释成浓度为500µg/L的内标戊巴比妥钠工作溶液。
2.3 血样预处理
精密移取200 μl血浆样本于10 ml玻璃离心试管中,加入内标溶液(500 μg/ml戊巴比妥钠)50 μl,涡旋混匀30 s,加入乙酸乙酯3 ml,涡旋3 min,450 g离心力离心5 min,吸取上清液2.5 ml至另一洁净玻璃试管中,40℃氮气流下吹干,100 μl纯水复溶,进样20 μl到色谱系统分析。
2.4 方法学验证
2.4.1 系统适用性:配制含左乙拉西坦0.3125 μg/ml的血浆样本1份,按照“2.3”项下方法处理后进样分析5次,分别记录待测物与内标的色谱峰面积值,并计算待测物与内标的色谱峰面积比值,考察其精密度。结果表明,每个分析批的5次重复分析的RSD均<10%,满足生物样本测试方法要求。
2.4.2 特异性:选取6份不同来源的健康受试者空白血浆,按照“2.3”项下操作处理(不加内标),进样分析得到空白血浆样本色谱图,其典型色谱图见图1 A;选取6份不同来源的健康受试者空白血浆,配成含左乙拉西坦质量浓度为0.3125 μg/ml的血浆样本,按照“2.3”项下操作处理,进样分析得到加样血浆样本色谱图,其典型色谱图见图1 B;取健康受试者用药物后0.5 h的血浆样本,按照“2.3”项下操作处理,进样分析得到受试者使用药物后的代表性血浆样本色谱图,其典型色谱图见图1 C。结果表明,左乙拉西坦和内标戊巴比妥钠保留时间分别为5.4 min和10.6 min左右,血浆中内源性物质不干扰左乙拉西坦和内标戊巴比妥钠的测定。

图1 典型色谱图A.空白血浆;B.空白血浆+0.3125 μg/ml左乙拉西坦对照品溶液;C.口服左乙拉西坦片500 mg后0.5 h血浆样品Fig 1 Typical chromatogramsA.blank plasma;B.blank plasma+0.3125 μg/ml levetiracetam control;C.plasma sample 0.5h after a single oral dose of Levetiracetam tablets 500 mg
2.4.3 标准曲线和最低定量限:配制含左乙拉西坦40.0、20.0、10.0、5.0、2.5、1.25、0.625、0.3125 μg/ml的8个不同质量浓度级别的系列标准血浆样本,按照“2.3”项下操作后处理进样分析,记录色谱。以左乙拉西坦和内标戊巴比妥钠峰面积比值(y)作为纵坐标、左乙拉西坦浓度(x)为横坐标进行回归分析,得标准曲线方程y=0.2498 x-0.0001(r=0.9997),权重二次曲线(响应值)。结果表明,左乙拉西坦血药浓度在0.3125~40 μg/ml范围内线性关系良好。最低定量限为0.3125 μg/ml。
2.4.4 绝对回收率试验:配制含左乙拉西坦0.625、5.0、32.0 μg/ml的血浆样本各5份,按照“2.3”项下操作处理后进样到色谱系统分析,分别得到血浆样本中左乙拉西坦的峰面积A1;另取含左乙拉西坦6.25、50.00、320.00 μg/ml的对照品溶液各20 μl,加入50 μl内标工作液和30 μl纯水,混匀后进样到色谱系统分析,各浓度平行5份。分别得到左乙拉西坦的色谱峰面积A2。绝对回收率计算公式为3/2.5×A1/A2×100%,结果见表1。
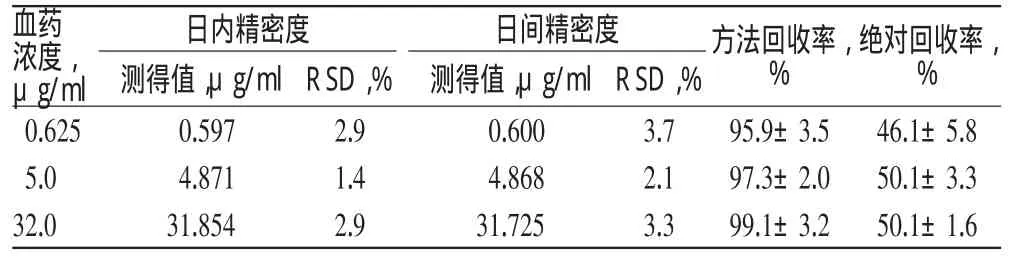
表1 精密度及回收率试验结果Tab 1 Results of precision and recovery tests
2.4.5 精密度与回收率试验:配制含左乙拉西坦0.625、5.0、32.0 μg/ml的血浆样品各5份,按照“2.3”项下方法操作,进样分析,以当日的标准曲线计算左乙拉西坦浓度。连续3 d做3批次,考察左乙拉西坦测定方法的精密度和准确度。精密度和方法回收率结果见表1。
2.4.6 稳定性试验:配制含左乙拉西坦0.625、5.0、32.0μg/ml的血浆样本,平行各4份。1份配制好后按“2.3”项下方法操作后,立即进样分析;1份血样室温放置4 h后提取操作;1份冷冻保存60 d后取出,解冻后提取操作;1份反复冻融3次后提取操作。结果显示,所有稳定性考察试验测定值与添加值的相对偏差(RE)均<15%,说明分析测试过程中的样本较为稳定。
2.5 受试者选择
选择20名健康男性志愿者,年龄为(22.2±2.1)岁,体质量为(65.4±6.1)kg,身高为(173.1±4.3)cm,无烟、酒嗜好。试验前经询问病史、体格检查和实验室检查均未发现异常;受试者无药物过敏史和药物依赖史,无精神病史以及其他慢性病史;2周内未使用任何药物;试验期间统一清淡饮食;签署知情同意书。试验方案经中南大学湘雅三医院伦理委员会批准。
2.6 给药方法
采用随机、开放、两制剂、两周期、交叉试验设计,将20名健康男性受试者随机分为2组,每组10人。于试验前一日20:00开始禁食,禁食12 h后,试验当日8:00空腹给药,每名受试者用200 ml温水送服左乙拉西坦片500 mg,服药2 h后进水,4 h后统一进标准餐。洗脱期7 d,交叉重复上述试验。
2.7 血样采集
分别于给药前(0 h)及给药后0.25、0.5、0.75、1.0、1.25、1.5、2.0、3.0、4.0、6.0、9.0、12.0、24.0、36.0 h时抽取肘静脉血5 ml,于3000 r/min离心5 min,分离血浆,-20℃保存待测。
2.8 数据处理及统计分析
使用WinNonlin 6.0软件,采用非房室参数求算方法(NCA模块),对左乙拉西坦的人体药动学参数进行求算。采用SPSS 13.0软件进行统计分析。
3 结果
3.1 相对生物利用度试验结果
20名健康受试者随机交叉单剂量口服左乙拉西坦受试制剂或参比制剂500 mg后,其平均药-时曲线见图2;主要药动学参数见表2。
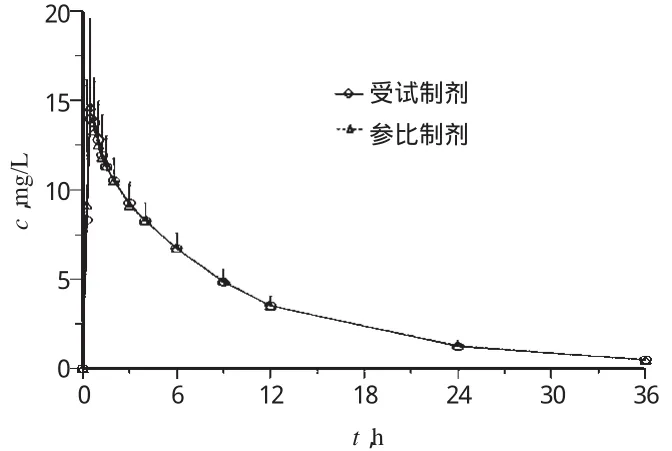
图2 健康志愿者单剂量口服2种左乙拉西坦片500mg后的平均药-时曲线(n=20)Fig 2 Mean plasma concentration-time curves of levetiracetam in healthy volunteers after a single oral dose of 500mg Levetiracetam tablet(n=20)
3.2 生物等效性评价
受试制剂和参比制剂中左乙拉西坦的AUC0-36h、AUC0-∞及cmax经对数转换后,进行方差分析,方差分析及Mann-WhitneyU检验均以P<0.05为组间的差异有统计学意义。结果表明,AUC0-36h、AUC0-∞和cmax在不同周期间及不同制剂间差异均无统计学意义,双单侧t检验结果表明AUC0-t、cmax值的统计参数th和tl均>单侧t(0.05,18)(1.734)。受试制剂和参比制剂tmax值经Mann-Whitney非参数检验,结果表明tmax在不同制剂间差异均无统计学意义。受试制剂对参比制剂的相对生物利用度(F)为(102.0±7.8)%。双单侧t检验计算所得的受试制剂AUC0-36h、AUC0-∞及cmax的90%可信区间分别为97.9%~104.1%、98.6%~105.0%和98.0%~116.0%,把握度(Power)均>0.8。其中cmax落在参比制剂cmax的75%~133%的范围内,AUC0-36h、AUC0-∞落在参比制剂AUC的80%~125%的范围内。根据以上结果判定,受试制剂与参比制剂具有生物等效性。
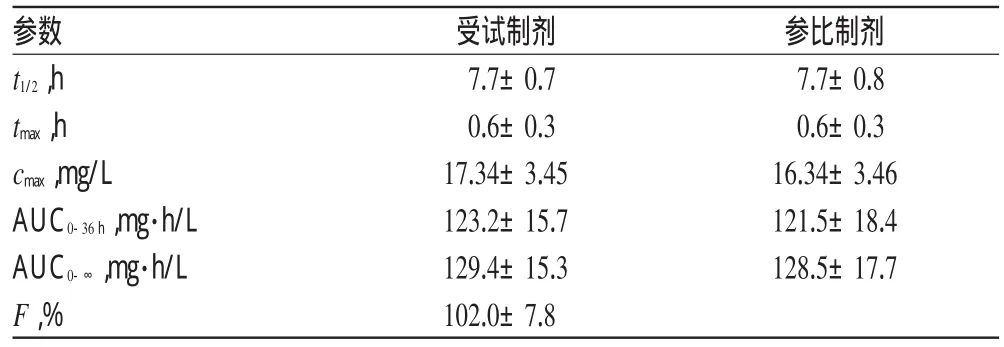
表2 健康志愿者单剂量口服2种左乙拉西坦片500mg的主要药动学参数(n=20)Tab 2 Main pharmacokinetics parameters of levetiracetam in healthy volunteers after single oral dose of 500mg Levetiracetam tablet(n=20)
4 讨论
本研究分析测试方法灵敏度和准确度高、专属性强、重现性好,经方法学考察确证其相对回收率和日内、日间精密度均符合生物样品测定的要求,适用于血浆中左乙拉西坦质量浓度测定及其药动学研究。在本文中,2种左乙拉西坦片的主要药动学参数不存在显著性差异,且与文献报道基本一致[1-5],表明2种制剂在体内的药动学过程基本一致。受试制剂的相对生物利用度为(102.0±7.8)%,2种制剂具有生物等效性。
[1]马涛,钱江华,祝晓光,等.左乙拉西坦片健康人体药动学[J].中国医院药学杂志,2007,27(7):858.
[2]王颖慧,魏敏吉,王云秀,等.高效液相色谱法测定左乙拉西坦血药浓度[J].儿科药学杂志,2010,16(4):34.
[3]Coupez R,Straetemans R,Sehgal G,et al.Levetiracetam:relative bioavailability and bioequivalence of a 10%oral solution(750mg)and 750mg tablets[J].J Clin Pharmacol,2003,43(12):1370.
[4]Rouits E,Burton I,Guénolé E,et al.Pharmacokinetics of levetiracetam XR 500mg tablets[J].Epilepsy Research,2009,84(2/3):224
[5]Leppik IE,Goel V,Rarick J,et al.Intramuscular and intravenous levetiracetam inhumans:safety and pharmacokinetics[J].Epilepsy Research,2010,91(2/3):289.
