HPLC法测定注射用阿奇霉素枸橼酸二氢钠的含量及有关物质
2013-12-03柏大为泰州市食品药品检验所江苏泰州225300
柏大为,陈 佳(泰州市食品药品检验所,江苏泰州 225300)
阿奇霉素为15元环新型大环内酯类抗菌药物[1-3],结构上与红霉素类似[4],作用机制也相似,是通过抑制细菌蛋白质的合成而发挥作用,且具有抗菌谱广、不良反应小等优点[5-6]。由于阿奇霉素物质自身显碱性,在一定酸性条件下不稳定[2];而阿奇霉素枸橼酸二氢钠是阿奇霉素的枸橼酸二氢钠盐,稳定性更高,且其溶液的pH值接近人体血液酸碱度(pH 7.35~7.45),因而刺激性小、耐受性更好。国家部颁标准[7]中对其含量采用抗生素微生物检定法测定,对有关物质采用薄层色谱法测定。这2种方法操作均较复杂,试验周期长,人为影响因素较多。笔者参考有关文献[8-10]建立了高效液相色谱(HPLC)法测定注射用阿奇霉素枸橼酸二氢钠含量和有关物质的方法,结果表明建立的方法简便、准确、专属性强、重复性好,可用于注射用阿奇霉素枸橼酸二氢钠的含量及有关物质的测定。
1 材料
2695 HPLC仪、2996二极管阵列检测器(DAD)、Empower色谱工作站(美国Waters公司);AG-135电子天平(瑞士Mettler Toledo公司);Milli-Q超纯水系统(美国密理博公司)。
样品为市售注射用阿奇霉素枸橼酸二氢钠(浙江普洛康裕制药有限公司,含量测定有2批,批号:20101210B、20080702,有关物质测定有5批,批号编号为1~5,规格:每支0.25 g);阿奇霉素对照品(中国食品药品检定研究院,批号:130593-201002,纯度:94.3%);乙腈为色谱纯,水为超纯水,其余试剂均为分析纯。
2 方法与结果
2.1 色谱条件
色谱柱:资生堂C18MG Ⅱ柱(150 mm×4.6 mm,5 μm);流动相:磷酸盐缓冲液(取0.05 mol/L磷酸氢二钾溶液,用20%的磷酸溶液调节pH至8.2)-乙腈(45∶55,V/V),流速:1.0 ml/min;柱温:35 ℃;进样量:20 μl;检测波长:215 nm。
2.2 溶液制备
2.2.1 对照品溶液的制备。精密称取阿奇霉素对照品53.00 mg,置于25 ml量瓶中,加流动相适量使其溶解,定容,摇匀,待用。
2.2.2 供试品溶液的制备。取样品5支,精密称定,研细;精密称取细粉适量(约相当于阿奇霉素200.00 mg),置于100 ml量瓶中,加流动相适量使其溶解,定容,摇匀,过滤,待用。
2.3 阿奇霉素含量测定方法的建立
2.3.1 线性关系考察。精密称取阿奇霉素对照品约212.06 mg,置于20 ml量瓶中,用乙腈溶解并定容至刻度,摇匀,制成10 mg/ml的溶液。精密量取上述溶液0.5、1.0、1.5、2.0、2.5、3.0 ml,分别置于10 ml量瓶中,加流动相稀释至刻度,按“2.1”项下色谱条件,进样测定,以阿奇霉素质量浓度(x)为横坐标,相应的峰面积(y)为纵坐标,进行线性回归,得线性方程为y=9.59562x-0.16459(r=0.9999)。结果表明,阿奇霉素检测质量浓度线性范围为0.5~3.0 mg/ml。
2.3.2 精密度试验。取“2.2.2”项下供试品溶液,连续进样6次,记录色谱峰面积。结果RSD=0.7%,表明精密度良好。
2.3.3 溶液稳定性试验。取“2.2.2”项下供试品溶液,于0、1、2、4、6、8 h分别进样测定,记录色谱峰面积。结果,阿奇霉素色谱峰的RSD=0.8%,表明供试品溶液在8 h内稳定。
2.3.4 重复性试验。精密称取样品(批号:20101210B)6份,按“2.2.2”项下方法制备成6份供试品溶液,进样测定,记录色谱峰面积,以含量为指标计算RSD。结果样品中阿奇霉素的平均含量为99.9%,RSD=0.8%,表明本方法的重复性良好。
2.3.5 回收率试验。精密吸取供试品溶液5 ml 9份,分别置于10 ml量瓶中,分别加入对照品溶液1、2、3 ml各3份,加流动相至刻度,摇匀,进样测定,计算回收率。结果,供试品中阿奇霉素平均回收率为100.2%,RSD=0.7%,详见表1。

表1 回收率试验结果(n=9)Tab 1 Results of recovery tests(n=9)
2.3.6 检出限。取“2.2.1”项下对照品溶液稀释70倍,进样测定,记录主成分峰高约为噪音峰高3倍时的色谱图,测得其最低检出限为4 μg/ml。
2.4 样品含量测定
取样品2批,分别按“2.2.2”项下方法每批制备3份供试品溶液,进样测定并记录峰面积;另取“2.2.1”项下对照品溶液,同法测定,记录峰面积,阿奇霉素对照品以及供试品的色谱图见图1。按外标法以峰面积计算样品中阿奇霉素的含量,并与抗生素微生物检定法相比较,结果见表2。
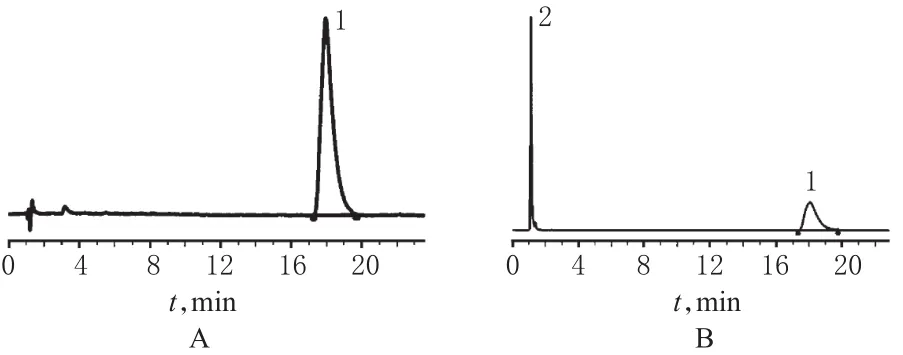
图1 主成分含量测定高效液相色谱图Fig 1 HPLC chromatograms of main components

表2 2批样品中阿奇霉素含量测定结果Tab 2 Results of content determination of azithromycin in 2 batches of samples
2.5 有关物质的专属性试验
2.5.1 高温破坏试验。取供试品溶液在100℃条件下放置30 min,取此样液按有关物质测定法进行操作,图谱出峰时间保留至主成分出峰时间的1.5倍。结果各杂质峰与阿奇霉素之间分离度>1.5,分离效果良好,详见图2A。
2.5.2 酸破坏试验。精密称取样品适量(约相当于阿奇霉素25 mg),置于25 ml量瓶中用流动相稀释,加1 ml盐酸(1 mol/L),在沸水浴中加热25 min,冷却,用氢氧化钠(1 mol/L)调节至pH 7.0,过滤,按有关物质测定法操作。结果各杂质峰与阿奇霉素峰完全分离,详见图2B。

图2 破坏性试验高效液相色谱图Fig 2 HPLC chromatograms of destroyed test
2.5.3 碱破坏试验。精密称取样品适量(约相当于阿奇霉素25 mg),置于25 ml量瓶中,用流动相稀释,加1 ml氢氧化钠(1 mol/L),在沸水浴中加热25 min,冷却,用盐酸(1 mol/L)调节至pH 7.0,过滤,按有关物质测定法操作。结果各杂质峰与阿奇霉素峰之间分离度>1.5,实现完全分离,详见图2C。
2.5.4 氧化破坏试验。精密称取样品适量(约相当于阿奇霉素25 mg),置于25 ml量瓶中,用流动相稀释,加1 ml H2O2(30%),置于沸水浴中加热20 min,冷却,过滤,取此滤液按有关物质测定法操作。结果各杂质峰与阿奇霉素峰完全分开,有较好的分离度,详见图2D。
2.5.5 光照破坏试验。取样品适量,于4000 lx光照12 h后按有关物质测定方法操作。结果阿奇霉素峰与各杂质峰之间分离度>1.5,完全分离,详见图2E。
2.6 样品中有关物质的测定
采用不加校正因子的自身对照法来测定,结果5批样品中有关物质的含量分别为0.9%、1.3%、1.2%、1.5%和1.1%。
综合以上结果显示,在建立的HPLC条件下,有关物质峰(降解产物峰)与主成分峰均达到基线分离,说明该色谱条件可用于阿奇霉素有关物质的检测。
3 讨论
(1)吸收波长的选择。阿奇霉素为大环内酯类抗菌药物,紫外吸收较弱,通过DAD进行全波长扫描,发现其在200 nm波长附近有末端吸收。通过比较,在215 nm波长处阿奇霉素峰出峰良好,与相邻杂质锋分离显著,杂质不干扰主药测定,故选择215 nm作为测定波长。
(2)色谱柱的选择。阿奇霉素枸橼酸二氢钠pH值偏碱性,而普通C18色谱柱中的硅醇基会造成碱性化合物的峰形拖尾,所以选用了型号为MGⅡ的ODS色谱柱。该色谱柱采用高纯度硅胶为基质,对硅胶表面进行了高分子包被,可最大限度地抑制硅醇基的影响,结果峰形满意。
(3)溶剂的选择。阿奇霉素对照品在乙腈中溶解较好,但阿奇霉素枸橼酸二氢钠在乙腈中溶解度不好,会产生浑浊。在采用流动相作溶剂后,溶解效果良好,对照品和样品均能很好溶解,故选用流动相为溶剂。
综上,通过本试验表明,所建立的HPLC法与抗生素微生物检定法含量测定结果基本一致,同时也可替代原薄层色谱法对有关物质的检测;而且所建立的方法相对更简便、快捷,并具有良好的准确性和重复性。
[1]Wu YH,Ji XB,Hu SS.Studies on electrochemical oxidation of azithromycin and its interaction with bovine serum albumin[J].Bioelectrochemistry,2004,64(1):91.
[2]栾杰,周庆国,王海霞.HPLC法电化学检测阿奇霉素片的有关物质[J].中国药房,2008,19(25):1975.
[3]Hoepelmana IM,Schneider MM.Azithromycin:the first of the tissue-selective azalides[J].Int J Antimicrob Agents,1995,5(3):145.
[4]Escudero E,Fernandez-Varon E,Marin P,et al.Pharmacokinetics and tissue tolerance of azithromycin after intramuscular adminis-tration to rabbits[J].Res Vet Sci,2006,81(3):366.
[5]Hoepelman IM,Möllers MJ,van Schie MH,et al.A short(3-day) course of azithromycin tablets versus a 10-day course of amoxycillin-clavulanic acid(co-amoxiclav)in the treatment of adults with lower respiratory tract infections and effects on long-term outcome[J].Int J Antimicrob Agents,1997,9(3):141.
[6]Hand WL,Hand DL.Characteristics and mechanisms of azithromycin accumulation and efflux in human polymorphonuclear leukocytes[J].Int J Antimicrob Agents,2001,18(5):419.
[7]国家食品药品监督管理局.WS-538(X-445)-2002 注射用阿奇霉素枸橼酸二氢钠[S].2002.
[8]王明娟,许明哲,胡昌勤,等.HPLC法分析阿奇霉素及各类注射剂中有关物质的含量[J].中国抗生素杂志,2008,33(12):740.
[9]纪标,王东凯,薛梅妍,等.HPLC法测定注射用门冬氨酸阿奇霉素的含量和有关物质[J].中国抗生素杂志,2005,30(6):347.
[10]刘柯,张亚杰.HPLC法测定阿奇霉素及阿奇霉素胶囊的含量[J].中国药师,2010,13(1):81.
