阿托伐他汀对ox-LDL诱导的人脐静脉内皮细胞缝隙连接的影响
2013-12-03张秀梅于晓玲申玉超骆振华辽宁医学院附属第一医院老年医学科辽宁锦州00辽宁医学院附属第一医院普外科辽宁锦州00
张秀梅,于晓玲,申玉超,骆振华(.辽宁医学院附属第一医院老年医学科,辽宁锦州00;.辽宁医学院附属第一医院普外科,辽宁锦州 00)
动脉粥样硬化(AS)是常见的心血管疾病之一,常引起重要脏器的严重病变(如心肌梗死和脑梗死),但其发病机制十分复杂。近年来,细胞间缝隙连接与AS形成的关系备受研究者的关注。组成缝隙连接的蛋白亚单位称为连接蛋白(Connexins),现已发现有20种以上的Connexins亚型,其中内皮细胞表面有 Connexin 43、Connexin 37、Connexin 40 的表达[1]。Connexin 43、Connexin 40在改变内皮细胞功能和AS的发生发展中有着重要作用。另一方面,氧化型低密度脂蛋白(ox-LDL)在AS的发生发展中起着关键作用,内皮下脂质沉积是AS的始动因素,ox-LDL可通过多种机制促进AS的发生发展[2-3]。研究表明,他汀类药物除了调脂作用外,可通过多种途径发挥抗炎、抗氧化、改善内皮细胞功能等作用,但确切途径尚不清楚。本研究观察阿托伐他汀对ox-LDL诱导的人脐静脉内皮细胞(HUVECs)的Connexin 43、Connexin 40表达的影响,探讨其改善AS可能的机制。
1 材料
1.1 仪器
CO2培养箱(美国Thermo forma公司);倒置显微镜(日本Olympus公司);超速离心机(美国Sigma公司);CIAS-1000细胞图像分析系统(北京恒大图像视觉有限公司);Power Pac3000电泳仪、EC-120电泳槽(美国Bio-Rad公司)。
1.2 药品与试剂
阿托伐他汀原料药(美国Sigma公司,批号:PZ0001,纯度:≥98%);达尔伯克改良伊格尔培养基(DMEM)高糖细胞培养液、胰酶、磷酸缓冲液(PBS)(美国Gibco公司);胎牛血清(美国Hyclone公司);ox-LDL(广州奕源生物科技有限公司,批号:YB-002,规格:2.0 mg/ml);兔抗人 Connexin 43(批号:bs-0651R)、Connexin 40(批号:bs-4087R)多克隆抗体(北京博奥森生物技术有限公司);庚醇、辣根过氧化物酶(HRP)标记的鼠抗兔的二抗、β-肌动蛋白(β-actin)、山羊血清(封闭液)、1×TBST洗膜液、二氨基联苯胺(DAB)显色液、Connexin 43蛋白二抗B液、Connexin 43蛋白二抗C液、Griess试剂由辽宁医学院实验中心配制。
1.3 细胞株
HUVECs购自美国ATCC公司。
2 方法
2.1 细胞培养与分组
取HUVECs常规传代,传至5代后接种于已放入盖玻片的6孔板培养液中,待HUVECs长至盖玻片的约80%满时换液。将其分为对照组、ox-LDL组、阳性对照组和阿托伐他汀组,对照组给予含10%胎牛血清的DMEM高糖细胞培养液培养;其余组分别先在培养液、加入50µmol/L庚醇的培养液、加入不同剂量(0.01、0.1、1.0、10 µmol/L)阿托伐他汀的培养液中处理30 min,再分别加入50 mg/L的ox-LDL继续培养24 h。
2.2 硝酸还原酶法检测一氧化氮(NO)浓度
取传代HUVECs,检测前24 h各组换为无血清培养基,之后按组培养收集细胞培养液。每组取样500µl置于含有20µmol/L亚硝酸钠的试管中,各管分别加入Griess试剂1.2 ml,振荡混匀后,静置10 min,4000 r/min离心10 min,取上清0.8 ml,加入显色剂0.4 ml,混匀放置15 min,用可见分光光度仪检测550 nm波长处NO的吸光度(A值),计算NO浓度。
2.3 免疫细胞化学法检测Connexin 43蛋白定位表达
用冰PBS冲洗各组6孔板3次,每次各4 min,4%多聚甲醛固定30~60 min,以30%H2O2-纯甲醇(1∶9,V/V)混合液室温浸泡30 min,PBS清洗标本3次,每次各4 min;加入封闭液于37℃下封闭30 min,加入兔抗人Connexin 43多克隆抗体孵育(用PBS配置,滴度1∶600),4℃下过夜,PBS清洗标本3次,每次各4 min;二抗B液于37℃下孵育30 min,PBS清洗标本3次,每次各4 min,加二抗C液于37℃下孵育30 min,PBS清洗标本3次,每次各4 min,DAB显色(避光,镜下观察至棕色)约3~10 min,蒸馏水洗2次,每次各2 min,苏木素复染15 min后以自来水冲洗,制成标本。用倒置显微镜观察标本中细胞形态、细胞周围Connexin 43蛋白染色。
2.4 蛋白印迹法检测Connexin 43、Connexin 40蛋白定量表达
收集每组细胞于EP管内,超声裂解,再4℃、1000 r/min离心2 min,用考马斯亮蓝法检测上清蛋白浓度。将所有蛋白样品调至等浓度上样,以80 V电压常规十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳后,转移到硝酸纤维膜上,用封闭液4℃封闭过夜。将稀释的兔抗人Connexin 43、Connexin 40多克隆抗体(1∶400)加入硝酸纤维膜,置于小封口塑料袋内37℃孵育2 h,1×TBST洗膜液洗膜,加入稀释HRP标记的鼠抗兔的二抗(1∶4500),37 ℃孵育1 h,1×TBST洗膜液洗膜,将膜置于含5-溴-4-氯-3-吲哚磷酸盐33µl/氯化硝基四氮唑蓝66µl的染色液10 ml中,于室温下轻轻摇晃,使蛋白条带逐渐显影、定影,胶片洗涤干燥。对图片各电泳条带亮度进行扫描,并以β-actin为对照,用统计学分析Connexin 43、Connexin 40蛋白表达的相对值。
2.5 数据处理
3 结果
3.1 各组HUVECs中NO浓度
与对照组比较,ox-LDL组、阳性对照组和阿托伐他汀组HUVECs上清液中NO浓度显著减少(P<0.01)。与ox-LDL组比较,阳性对照组和阿托伐他汀组中NO浓度均显著增加(P<0.05或P<0.01),其中阿托伐他汀组呈剂量依赖性增加。与阳性对照组比较,10µmol/L阿托伐他汀组中NO浓度无统计学差异(P>0.05)。各组HUVECs中NO浓度比较见表1。
表1 各组HUVECs中NO浓度和Connexin 43、Connexin 40蛋白表达比较(±s,n=6)Tab 1 Comparison of NO concentration,protein expression of Connexin 43 and Connexin 40 in HUVECs among those groups(±s,n=6)

表1 各组HUVECs中NO浓度和Connexin 43、Connexin 40蛋白表达比较(±s,n=6)Tab 1 Comparison of NO concentration,protein expression of Connexin 43 and Connexin 40 in HUVECs among those groups(±s,n=6)
与对照组比较:*P<0.01;与ox-LDL组比较:#P<0.05,##P<0.01;与阳性对照组比较:ΔP>0.05vs.control group:*P<0.01;vs.ox-LDL group:#P<0.05,##P<0.01;vs.positive control group:ΔP>0.05
组别对照组ox-LDL组阳性对照组阿托伐他汀0.01 μmol/L组阿托伐他汀0.1 μmol/L组阿托伐他汀1 μmol/L组阿托伐他汀10 μmol/L组NO,μmol/L 53.23±1.08616.82±0.970*46.30±0.895*##18.25±0.88*#28.08±0.825*##37.86±0.795*##46.11±0.878*##ΔConnexin 43,%0.406±0.0341.052±0.025*0.778±0.080*#1.010±0.041*#0.92±0.035*##0.862±0.056*##0.791±0.048*##ΔConnexin 40,%0.385±0.0280.917±0.04*0.695±0.075*#0.878±0.018*#0.801±0.021*##0.764±0.021*##0.698±0.037*##Δ
3.2 各组HUVECs中Connexin 43蛋白定位表达
对照组细胞中见较弱的Connexin 43蛋白染色,即淡黄色。与对照组比较,10 μmol/L阿托伐他汀组和阳性对照组细胞形态均无明显差异。ox-LDL组细胞皱缩、紊乱,细胞中可见大量的棕褐色颗粒、浓染。0.01、0.1、1.0 μmol/L阿托伐他汀组可见细胞皱缩、中等量的棕褐色颗粒,其显微镜图略,其余各组HUVECs中Connexin 43蛋白定位表达显微镜图见图1。
3.3 各组HUVECs中Connexin 43、Connexin 40蛋白定量表达
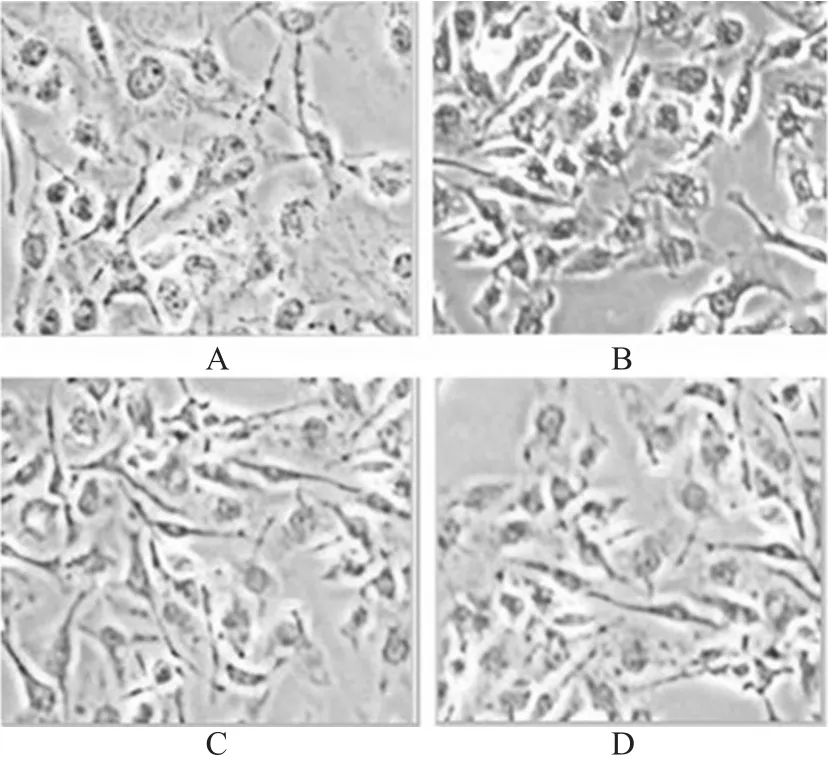
图1 各组HUVECs中Connexin 43蛋白定位表达显微镜图(×100)Fig 1 Micrograph of location expression of Connexin 43 in HUVECs among those group(s×100)
与对照组比较,ox-LDL组、阳性对照组和阿托伐他汀组细胞中Connexin 43、Connexin 40蛋白定量表达均明显增加(P<0.01)。与ox-LDL组比较,阳性对照组和阿托伐他汀组细胞中Connexin 43、Connexin 40蛋白表达均明显减少(P<0.01),其中阿托伐他汀组呈剂量依赖性减少。与阳性对照组比较,10µmol/L阿托伐他汀组细胞中Connexin 43、Connexin 40蛋白定量表达无统计学差异(P>0.05)。各组HUVECs中Connexin 43、Connexin 40蛋白表达见表1,电泳图见图2。

图2 各组HUVECs中Connexin 43、Connexin 40蛋白定量表达电泳图Fig 2 Electrophoresis of quantitative expression of Connexin 43 and Connexin 40 in HUVECs among those groups
4 讨论
众所周知,血管内皮细胞损伤和功能改变在AS的形成过程中起着非常重要的作用,而ox-LDL在AS的发生发展中起着关键作用,ox-LDL可通过促进细胞黏附于内皮并向内皮下趋化和促进血小板黏附、聚集、血栓形成等多种途径促使AS的发生发展[4]。通过Connexin 43基因半敲除的LDL受体基因缺陷小鼠与LDL受体基因缺陷的、带有正常Connexin 43基因的小鼠相比,其Connexin 43蛋白表达减少;喂养高胆固醇饲料14周后其胸腹主动脉和主动脉根部动脉粥样病变后,其粥样斑块中含更少的炎症细胞和更多的胶原蛋白、更厚的平滑肌纤维帽,提示Connexin 43不仅参与白细胞聚集,而且在AS斑块形成中起重要作用[5]。研究证实,在人类冠状AS的早期,Connexin 43、Connexin 40造成内膜的增厚,增加白细胞黏附,加速AS的进展[6]。对内皮功能紊乱进行药物干预治疗,已成为心血管领域一个全新的发展趋势。他汀类药物在没有产生任何降脂作用的情况下,能保护冠状动脉的内皮功能,尤其在心肌对血液的需求增加时,能保持正常的冠状动脉灌注和冠状动脉微血管的完整性[7]。在兔AS斑块中,Connexin 43、Connexin 40表达明显上调,而通过他汀类药物治疗者的粥样硬化斑块中Connexin 43、Connexin 40的表达明显受抑制[8]。笔者通过观察阿托伐他汀对ox-LDL诱导的HUVECs中Connexin 43、Connexin 40表达的影响,发现阿托伐他汀可通过抑制ox-LDL诱导的HUVECs中Connexin 43、Connexin 40蛋白的增加,发挥保护内皮功能,从而改善AS。
内源性一氧化氮合酶生成的NO能够预防AS,并对不同阶段的AS的病理形成均有改善和逆转作用。与对照组比较,其余各组中NO浓度均明显减少;与ox-LDL组比较,阿托伐他汀组中NO浓度呈剂量依赖性增加;10µmol/L阿托伐他汀组与阳性对照组中NO浓度差异无统计学意义。说明阿托伐他汀可通过增加NO浓度,进一步改善内皮功能;且阿托伐他汀剂量越大,增加的NO浓度越多,对内皮功能改善可能越明显。但10µmol/L阿托伐他汀是否为最佳剂量尚需进一步证实。对照组内皮细胞胞质内见较弱的Connexin 43蛋白阳性染色,呈淡黄色;ox-LDL组细胞胞质内出现大量棕褐色颗粒;0.01、0.1、1.0µmol/L阿托伐他汀组细胞可看到细胞皱缩、中等量的棕褐色颗粒;而10µmol/L阿托伐他汀组和阳性对照组细胞胞质内仅可见少量棕褐色颗粒,说明阿托伐他汀减少了受损HUVECs中Connexin 43的表达。与ox-LDL组比较,阳性对照组细胞的Connexin 43、Connexin 40蛋白显著减少;阿托伐他汀组细胞中Connexin 43、Connexin 40蛋白表达呈剂量依赖性减少;10µmol/L阿托伐他汀组与阳性对照组差异无统计学意义。以上说明,阿托伐他汀可通过增加细胞中NO浓度和减少Connexin 43、Connexin 40蛋白的表达来保护内皮细胞间的缝隙连接功能,为他汀类药物抗AS作用提供了新的靶点。
综上所述,阿托伐他汀可通过影响内皮细胞间Connexin 43、Connexin 40蛋白的表达,减弱ox-LDL对内皮细胞的损害,从而抑制AS的发生发展。目前研究[9]表明,人类Connexin 43基因的转录调控涉及转录因子Sp1、Sp3、Nkx2-5、Tbx5、GATA4等,其中Sp1、Sp3、NKX2-5和GATA4的激活是Connexin 43、Connexin 40的基因启动子,而Tbx5能抑制Nkx2-5/GATA4调节Connexin 43、Connexin 40基因启动子的激活。内皮细胞间缝隙连接功能改变的研究是AS治疗的新领域,这为改善冠心病患者的治疗与预后提供了一个新的理论依据。但对于阿托伐他汀影响Connexin 43、Connexin 40蛋白表达的转录因子和信号通路尚需进一步研究。
[1]Morel S,Burnier L,Kwak BR.Connexins participate in the initiation and progression of atherosclerosis[J].Semin Immunopathol,2009,31(1):49.
[2]Itabe H.Oxidative modification of LDL:its pathological role in atherosclerosis[J].Clin Rev Allergy Immunol,2009,37(1):4.
[3]Tabas I,Williams KJ,Borén J.Subendothelial lipoprotein retention as the initiating process in atherosclerosis:update and therapeutic implications[J].Circulation,2007,116(16):1832.
[4]石翠格,胡刚,汪海.天然药物槟榔碱对氧化低密度脂蛋白致血管内皮细胞损伤的保护作用研究[J].科学技术与工程,2007,7(12):2780.
[5]Kwak BR,Veillard N,Pelli G,et al.Reduced Connexin 43 expression inhibits atherosclerotic lesion formation inlow-density lipoprotein receptor-deficient mice[J].Circulation,2003,107(7):1033.
[6]Chadjichristos CE,Scheckenbach KE,Van veen TA,et al.Endothelial-specific deletion of Connexin 40 promotes atherosclerosis by increasing CD73-dependent leukocyte adhesion[J].Circulation,2010,121(1):123.
[7]戴萍,金蜀蓉.他汀类药物非调脂作用研究进展[J].中国药房,2005,16(12):949.
[8]Wang LH,Chen JZ,Sun YL,et al.Statins reduce Connexin 40 and Connexin 43 expression in atherosclerotic aorta of rabbits[J].Int J Cardiol,2005,100(3):467.
[9]Linhares VL,Almeida NA,Menezes DC,et al.Transcriptional regulation of the murine Connexin40 promoter by cardiac factors Nkx2-5,GATA4 and Tbx5[J].Cardiovasc Res,2004,64(3):402.
