大黄素对实验性自身免疫性心肌炎大鼠IFN-γ及IL-17水平的影响
2013-12-03宋占春王占胜白静慧胡健
宋占春,王占胜,白静慧,3,胡健
(1.中国医科大学附属第一医院心内科,沈阳 110001;2.抚顺市中心医院心内科,辽宁 抚顺 113006;3.辽宁省肿瘤医院ICU,沈阳110001)
心肌炎(myocarditis)是心脏的炎症性疾病,是扩张型心肌病(dilated cardiomyopathy,DCM)的主要病因,并可导致青少年发生心力衰竭及猝死[1]。目前,心肌炎仍是心血管研究领域中一个具有挑战性的临床问题。心肌炎的具体发病机制仍未完全清楚,但越来越多的证据表明炎症和免疫因素在心肌炎和DCM的发病中起着至关重要的作用[2]。因此,抗炎治疗和免疫治疗已经成为近年来的研究热点。大黄素长期以来一直被用于各种炎症性疾病及肿瘤相关疾病的治疗。以往的多项研究表明,大黄素(emodin)具有明显的抗炎和免疫调节作用[3,4]。本研究观察了大黄素对自身免疫性心肌炎(experimental au-toimmune myocarditis,EAM)大鼠细胞因子 IFN-γ 及IL-17的调节作用,旨在探讨大黄素对EAM大鼠心肌的保护作用及其机制。
1 材料与方法
1.1 材料
1.1.1 实验动物:6周龄SPF级雄性Lewis大鼠24只(160~180 g),购于北京维通利华实验动物技术有限公司。
1.1.2 主要试剂及材料:猪心肌肌球蛋白(美国Sigma公司),弗氏完全佐剂(美国Sigma公司),二甲基亚砜(美国Sigma公司),大黄素(中国药品生物制品检定所,浓度>98%),IFN-γ、IL-17 ELISA 试剂盒(美国Biosource公司),IFN-γ抗体(北京博奥森生物制剂有限公司),IL-17抗体(武汉博士德公司)。
1.2 方法
1.2.1 动物模型制备及分组:Lewis大鼠24只随机分为3组:实验性自身免疫性心肌炎(EAM)组,大黄素(Emodin)组和对照(Control)组。参照文献建立EAM模型[5],将浓度为11.7 mg/mL的猪心肌球蛋白原液经0.01 mol/L PBS稀释成10 mg/mL的溶液后与等体积弗氏完全佐剂(含有结核分支杆菌H37Ra 1 mg/mL)混匀成乳浊液。实验0 d及7 d,于EAM组及Emodin组大鼠的左右后肢足垫皮下各注射混合后的乳浊液0.1 mL(即每只大鼠共注射0.2 mL乳化液);Control组用完全弗氏佐剂(等体积0.01 mol/L PBS与完全弗氏佐剂混合液)假性免疫。
1.2.2 给药方式:大黄素以二甲基亚砜(美国Sigma公司)溶解后加蒸馏水制成3 mg/mL溶液,Emodin组大鼠于0 d起,每日给予50 mg/kg大黄素(中国药品生物制品检定所,浓度>98%)空腹灌胃治疗,共21 d。EAM组和Control组大鼠每日给予蒸馏水灌胃。21 d时处死大鼠,留取心肌组织及血清标本。
1.2.3 心肌组织病理学检测:将心肌组织在10%甲醛溶液中固定后,经过梯度乙醇脱水,浸蜡和包埋等步骤,制成石蜡块,间断切片,厚度5 μm。常规HE及Masson′s三联染色,光学显微镜观察结果。
1.2.4 ELISA法检测血清中IFN-γ、IL-17的水平:大鼠采血后,静置15~20 min,离心后(3 000 r/min,10 min)分离血清,ELISA法检测血清IFN-γ、IL-17的水平。检测严格按ELISA试剂盒说明书步骤进行。
1.2.5 Western blot法检测心肌组织中IFN-γ、IL-17的水平:制备SDS-PAGE胶,心肌组织匀浆后取上清,40 μg(20 μL)上样,电压 70 V 电泳 1.5 h 后,转印至PVDF膜,5%脱脂奶粉封闭,一抗孵育(稀释比例1∶5 000)4℃过夜,HRP标记的二抗37℃孵育(稀释比例1∶5 000)45 min,ECL显色,暗室曝光,显影后扫描其光密度值。GAPDH为内参。
1.3 统计学分析
2 结果
2.1 各组大鼠一般情况
在实验结束前,各组大鼠均无死亡。Control组大鼠精神状态、活动及饮食均正常。EAM组大鼠从10 d开始陆续出现食欲下降,倦怠少动、毛发晦暗蓬松;Emodin组的大鼠也出现上述改变,但与EAM组相比症状有所减轻。
2.2 各组大鼠心肌组织病理学结果
结果显示,Control组未见炎性细胞浸润(图1A),EAM组可见大量的淋巴细胞、中性粒细胞及多核巨细胞浸润(图1B),Emondin组也可见炎性细胞浸润,但浸润程度较EAM组明显减轻(图1C)。Masson′s染色结果显示,Control组无明显心肌纤维化改变(图2A),EAM组大鼠心肌纤维化改变较明显(图2B),而Emodin的干预减轻了纤维化的程度(图2C)。
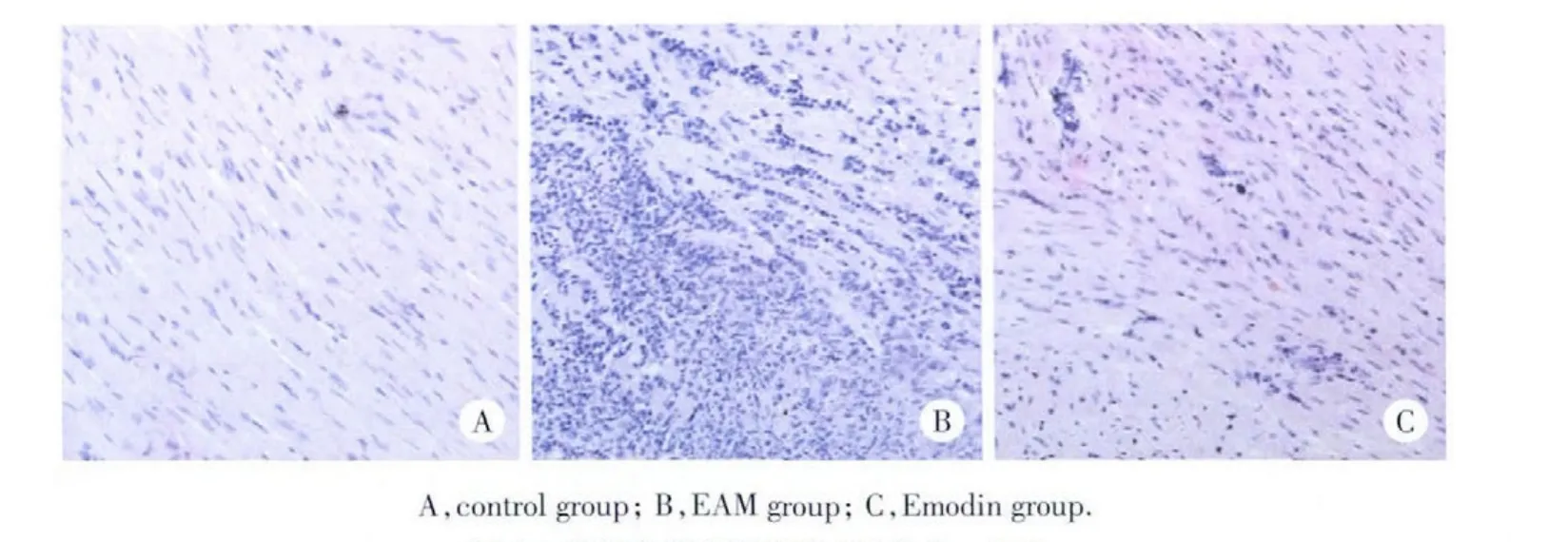
图1 各组大鼠心肌组织HE染色×200Fig.1 HEstainingofMyocardialtissueineachgroupofrats×200
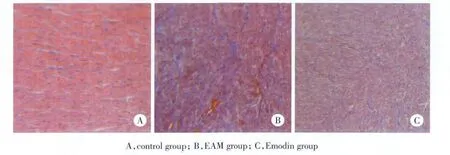
图2 各组大鼠心肌组织Masson染色×200Fig.2 Masson′s trichrome of myocardial tissue in each group×200
2.3 各组大鼠血清中IFN-γ和IL-17的水平
EAM组与Control相比,IFN-γ的浓度明显升高[(168.83± 21.53)pg/mL vs(54.62 ±7.34)pg/mL,P <0.05)],与 EAM 组相比,Emodin 组的 IFN-γ 的浓度明显下降[(92.92± 7.36)pg/mL,P < 0.05)];EAM 组与Control相比,IL-17的也浓度也明显升高[(69.50±7.57)pg/mL vs(20.72 ±4.36)pg/mL,P < 0.05)],与EAM组相比,Emodin组的IL-17的浓度也明显下降[(34.44± 4.42)pg/mL,P < 0.05)],见图3。
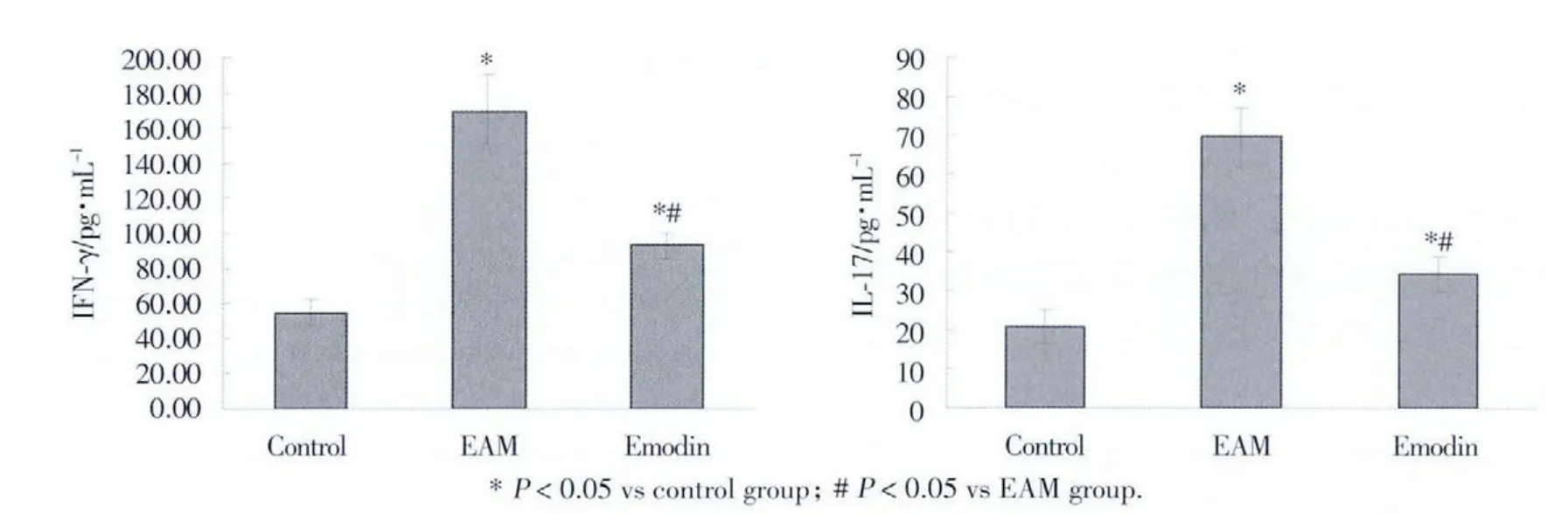
图3 各组大鼠血清中IFN-γ和IL-17的水平Fig.3 Serum levels of IFN-γand IL-17 in each group
2.4 各组大鼠心肌组织中IFN-γ和IL-17蛋白的表达水平
为检测大黄素能否影响心肌组织中IFN-γ和IL-17的蛋白表达,我们使用Western blot法检测心肌组织中IFN-γ和IL-17的蛋白表达水平。以GAPDH为内参,目的蛋白/GAPDH代表条带强弱的相对值。结果示:IFN-γ和IL-17在Control组呈现低表达,而EAM组的表达水平显著增高,两者之间有显著性差异(P<0.05);与EAM组相比较,Emodin组大鼠的心肌中的IFN-γ和IL-17蛋白表达水平显著降低,组间比较有统计学差异(P<0.05)。结果说明在EAM组的心肌中IFN-γ和IL-17蛋白的表达水平明显升高,大黄素的干预抑制了它们的过度表达(图4)。
3 讨论
众多研究证实,自身免疫反应在心肌炎的发生发展中起着至关重要的作用,因此建立自身免疫性心肌炎的实验模型对心肌炎发病机制的研究及药物治疗的评估等有着重要的意义。EAM的鼠模型可以作为代表人类心肌炎疾病的模型[6,7],因其组织形态学与人类的心肌炎的急慢性期都很相似。EAM是T细胞介导的疾病,其心脏炎症的高峰期在免疫后的21 d[8],既往研究表明,EAM 主要是由 Thl细胞介导的免疫反应[9],调节Thl/Th2的平衡可以减轻EAM[10,11]。然而近几年的研究发现,Th17 是一种新的以分泌IL-17为特征的CD4+T细胞的新亚群。且有学者证实Th17和其产生的炎性介质IL-17在EAM的发生发展中也起到了至关重要的作用[12,13]。
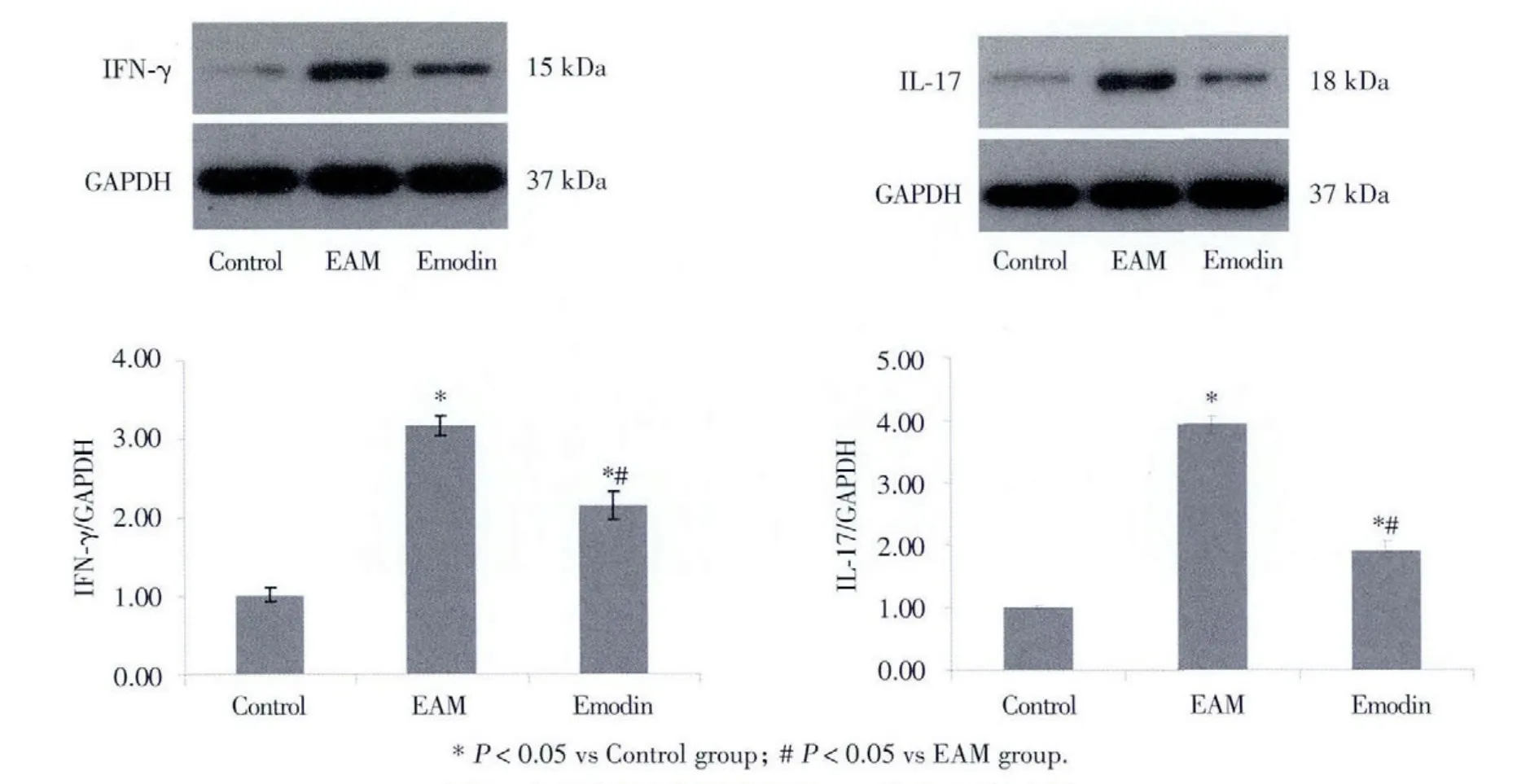
图4 各组大鼠心肌组织中IFN-γ和IL-17的水平Fig.4 Myocardial tissue levels of IFN-γand IL-17 in each group
大黄素是一种羟基蒽醌类的衍生物。大黄素的分子式为C15H10O5,分子量是270.23。大黄素长期以来一直被用于炎症性疾病的治疗。目前多项研究表明,大黄素具有抗炎、抗氧化、抗肿瘤、免疫调节等作用,在临床上具有广阔的研究价值及应用前景。并且,大黄素还能够抑制T细胞增殖,并可以调节Th1/Th2 平衡[3,4]。
本研究发现,EAM组大鼠初次免疫后21 d,心肌HE及Masson′s染色结果提示心肌细胞排列紊乱,心肌组织炎性细胞浸润及纤维化明显,EAM组的这些改变与既往研究建立EAM模型的报道相似[14],而大黄素的干预,明显改善EAM大鼠心肌炎症及纤维化程度。在本实验我们还应用ELISA和Western blot技术,探讨大黄素对EAM大鼠心脏的保护作用是否与其对Th17型细胞因子IL-17及Th1型细胞因子IFN-γ的抑制作用有关。结果显示,EAM大鼠心肌组织及血清中细胞因子IFN-γ和IL-17的浓度均显著升高,而Emodin的干预明显降低了IL-17和IFN-γ的水平。这些研究结果表明,EAM的发病机制可能与Th1及Th17细胞亚群相关,这与既往的研究结果相似[13]。而大黄素可能是通过抑制IFN-γ、IL-17的水平而缓解了EAM大鼠的心脏炎症改变。我们的研究表明大黄素可能对Th1及Th17细胞亚群具有一定的免疫调节作用,进而对EAM大鼠的心脏起到一定的保护作用,为炎症相关性心血管疾病的临床防治提供了新的药物治疗前景。
[1]Cihakova D,Rose NR.Pathogenesis of myocarditis and dilated cardiomyopathy[J].Adv Immunol,2008,99:95-114.
[2]Caforio AL,Mahon NJ,Tona F,et al.Circulating cardiac autoantibodies in dilated cardiomyopathy and myocarditis:pathogenetic and clinical significance[J].Eur J Heart Fail,2002,4(4):411-417.
[3]Kuo YC,Meng HC,Tsai WJ.Regulation of cell proliferation,inflammatory cytokine production and calcium mobilization in primary human T lymphocytes by emodin from Polygonum hypoleucum Ohwi[J].Inflamm Res,2001,50(2):73-82.
[4]Lin SZ,Chen KJ,Tong HF,et al.Emodin attenuates acute rejection of liver allografts by inhibiting hepatocellular apoptosis and modulatingtheTh1/Th2balanceinrats[J].ClinExpPharmacolPhysiol,2010,37(8):790-794.
[5]Kodama M,Matsumoto Y,Fujiwara M,et al.A novel experimental model of giant cell myocarditis induced in rats by immunization with cardiacmyosinfraction[J].ClinImmunolImmunopathol,1990,57(2):250-262.
[6]Li Y,Heuser JS,Kosanke SD,et al.Cryptic epitope identified in rat and human cardiac myosin S2 region induces myocarditis in the Lewis rat[J].J Immunol,2004,172(5):3225-3234.
[7]Ciháková D,Sharma RB,Fairweather D,et al.Animal models for autoimmune myocardits and autoimmune thyroiditis[J].J Methods Mol Med,2004,102:175-193.
[8]Fuse K,Kodama M,Ito M,et al.Polarity of helper T cell subsets represents disease nature and clinical course of experimental autoimmune myocarditis in rats[J].Clin Exp Immunol,2003,134(3):403-408.
[9]Maier R,Miller S,Kurrer M,et al.Quantification and Characterization of myosin peptide-specific CD4+T cells in autoimmune myocarditis[J].J Immunol Methods,2005,304(1-2):117-125.
[10]Futamatsu H,Suzuki J,Mizuno S,et al.Hepatocyte growth factor ameliorates the progression of experimental autoimmune myocarditis:a potential role for induction of the helper 2 cytokines[J].Circ Res,2005,96(8):823-830.
[11]李为民,刘巍,张瑞宏,等.腺病毒载体介导的ICOSIg融合基因对实验性自身免疫性心肌炎作用的研究腺病毒载体介导的共刺激分子融合蛋白对实验性自身免疫性心肌炎的作用[J].中华心血管病杂志,2007,35(1):28-32.
[12]Chang H,Hanawa H,Yoshida T,et al.Alteration of IL-17 related protein expressions in experimental autoimmune myocarditis and inhibition of IL-17 by IL-10-Ig fusion gene transfer[J].Circ J,2008,72(5):813-819.
[13]Daniels MD,Hyland KV,Wang K,et al.Recombinant cardiac myosin fragment induces experimental autoimmune myocarditis via activation of Th1 and Th17 immunity[J].Autoimmunity,2008,41(6):490-499.
[14]Yoshida Y,Shioi T,Izumi T.Resveratrol ameliorates experimental autoimmune myocarditis[J].Circ J,2007,71(3):397-404.
