格列吡嗪和格列奇特对MIN6细胞的影响
2013-12-01刘继红
刘继红,苏 青
(1.复旦大学附属上海市第五人民医院 老年科,上海 200240;2.上海交通大学医学院附属新华医院 内分泌科,上海200240)
全世界糖尿病尤其是2型糖尿病患病率以惊人的速度在流行,全世界糖尿病患者人数将从2000年的1.5亿上升到2025年的3亿[1]。糖尿病通常伴随着长期的微血管、神经、大血管并发症,严格的糖尿病治疗获得理想的血糖控制能减少这些并发症的发生。口服降糖药是必须的,其中50年前问世的磺脲类抗糖尿病药物通过刺激胰岛β细胞分泌胰岛素调节血糖,至今仍是2型糖尿病的一线口服降糖药。然而大量的研究表明这类药物(氯磺丙脲、格列本脲)在改善糖尿病的血糖控制,积极影响微血管并发症发展的同时,随着治疗时间的延长,胰岛β细胞数量逐渐减少,功能逐渐出现衰竭。Tsubouchi等[2]报道治疗浓度的格列本脲同高糖一样通过依赖蛋白激酶C(PKC)激活NAD(P)H,使β细胞产生氧化应激,生成活性氧(ROS)。格列吡嗪和格列奇特同格列本脲一样属于第二代磺脲类药物,临床治疗糖尿病后都出现药物继发性失效,可能是磺脲类药物对胰岛剩余β细胞的有害作用导致β细胞最终耗竭[3],也可能是高血糖对胰岛β细胞的葡萄糖毒性作用致胰岛素分泌日益减少[4]。是否都是因为氧化应激产生的ROS进一步造成细胞凋亡呢?我们以格列吡嗪和格列奇特作用于MIN6细胞,同样通过观察细胞活力、细胞内活性氧的变化情况、细胞凋亡情况,探讨第二代磺脲类药物对胰岛β细胞的影响,进一步明确不同磺脲类药物对β细胞影响的机制。
1 材料与方法
1.1 实验材料 MIN6细胞株(上海交通大学医学院附属瑞金医院李小英教授馈赠)、格列吡嗪(上海集团信宜制药总厂提供)、格列奇特(上海汇仁制药有限公司提供),其余试剂为国产分析纯。
1.2 方法 MIN6细胞培养于高糖DMEM培养基中。每2天换液,每4~5天传代1次。分别取0、1 μmol/L、10 μmol/L、50 μmol/L 格列吡嗪和格列奇特干预MIN6细胞24 h后,用MTT法检测细胞活力变化,运用ROS捕获剂双氢溴乙啶(HE)、双氢-乙酰乙酸二氯荧光黄(DCFH-DA)和双氢罗丹明123(DHR123)孵育细胞,通过荧光显微镜观察细胞内荧光、流式细胞仪检测MIN6细胞的MFI而测得细胞内ROS水平。用Annexin-vFITC和PI双标记细胞凋亡检测法通过流式细胞仪测定药物诱导细胞凋亡情况。取10 μmol/L格列吡嗪和格列奇特分别干预MIN6细胞24 h、48 h、72 h后,运用上述同样方法进行实验。
1.3 统计学处理 采用SPSS 11.5统计软件包进行统计学分析。实验数据以均数±标准差表示,分别行F检验。P<0.05表明差异有统计学意义。
2 结果
2.1 格列吡嗪及格列奇特对MIN6细胞活力的影响 与正常对照组比较,格列吡嗪组细胞活力下降,差异显著,说明格列吡嗪影响β细胞功能,且随作用时间延长,细胞活力影响越大,见表1。格列奇特处理组各时间和浓度点活力均无明显下降,见表2。
表1 MTT法检测格列吡嗪对MIN6细胞活力影响(OD,±s)
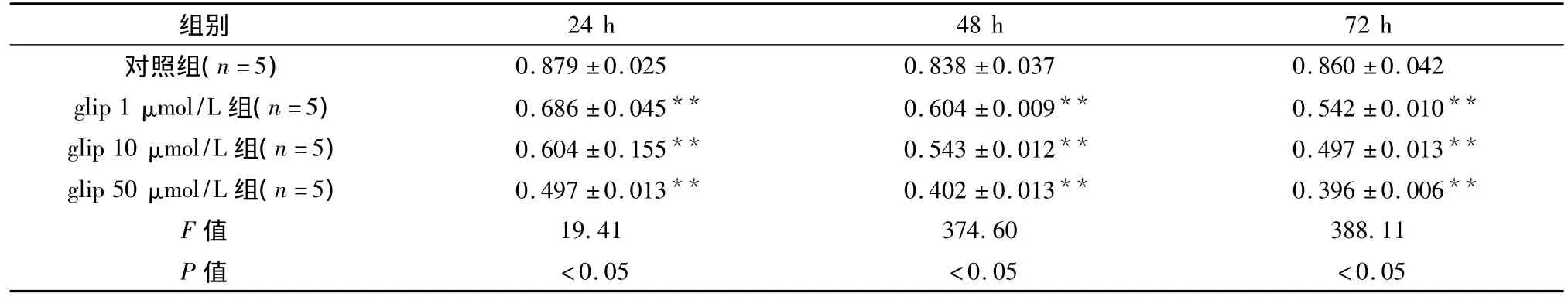
表1 MTT法检测格列吡嗪对MIN6细胞活力影响(OD,±s)
与对照组相比**P<0.01
24 h 48 h 72 h对照组(n=5)组别<0.05 <0.05 <0.05 0.879 ±0.025 0.838 ±0.037 0.860 ±0.042 glip 1 μmol/L 组(n=5)0.686 ±0.045** 0.604 ±0.009** 0.542 ±0.010**glip 10 μmol/L 组(n=5)0.604 ±0.155** 0.543 ±0.012** 0.497 ±0.013**glip 50 μmol/L 组(n=5)0.497 ±0.013** 0.402 ±0.013** 0.396 ±0.006**F 值 19.41 374.60 388.11 P值
表2 MTT法检测格列奇特对MIN6细胞活力影响(OD,±s)
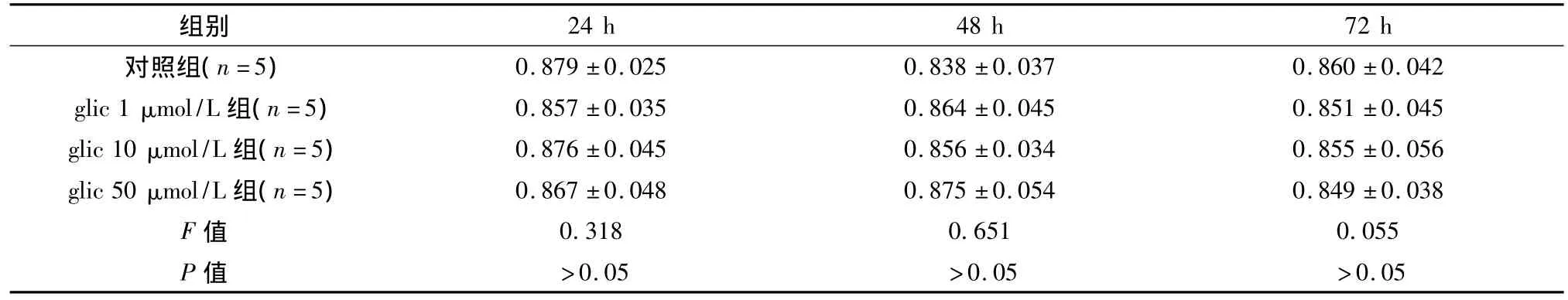
表2 MTT法检测格列奇特对MIN6细胞活力影响(OD,±s)
24 h 48 h 72 h对照组(n=5)组别0.879 ±0.025 0.838 ±0.037 0.860 ±0.042 glic 1 μmol/L 组(n=5)0.857 ±0.035 0.864 ±0.045 0.851 ±0.045 glic 10 μmol/L 组(n=5)0.876 ±0.045 0.856 ±0.034 0.855 ±0.056 glic 50 μmol/L 组(n=5)0.867 ±0.048 0.875 ±0.054 0.849 ±0.038 F 值 0.318 0.651 0.055 P值 >0.05 >0.05 >0.05
2.2 活性氧(ROS)捕获及检测
2.2.1 荧光显微镜 用10 μmol/L HE孵育各组格列吡嗪培养基MIN6细胞1 h后,荧光显微镜下结果显示与正常组相比,作用48 h下细胞内的荧光增强,而格列奇特组作用48 h下细胞内的荧光无明显增强,见图1。
2.2.2 流式细胞仪
2.2.2.1 格列吡嗪药物对MIN6 ROS产生的影响
2.2.2.1.1 48 h 正常 MIN6 细胞内 Rh123 的 MFI为50.8 ±8.5,格列吡嗪药物浓度分别为 1 μmol/L、10 μmol/L、50 μmol/L 培养基培养 MIN6 细胞 MFI分别为 78.5 ± 7.3、110.6 ±9.9、156.4 ±14.5,结果显示:与正常对照组比较差异显著,且随着浓度的增加,药物作用下的细胞内ROS生成明显增加(F=94.86,P <0.01)。
2.2.2.1.2 正常 MIN6 内 Rh123 的 MFI在 24 h、48 h、72 h 分别为48.9 ±5.9、55.3 ±6.1、50.8 ±6.5,含格列吡嗪10 μmol/L药物的DMEM培养相同时间后,MFI分别为 90.8 ± 10.2、125.8 ±11.8、162.8 ±15.2,与正常对照组比较差异显著,结果显示,在一定范围内随着时间的延长,格列吡嗪作用下的细胞内ROS 生成明显增多(F=22.32,P < 0.01),见图2。
2.2.2.2 格列奇特对MIN6细胞ROS产生的影响格列奇特药物浓度分别为 1 μmol/L、10 μmol/L、50 μmol/L培养基培养MIN6细胞MFI分别为50.5±6.4、59.6 ±7.1、55.7 ±6.9。结果显示:与正常对照组比较无明显差异,并予10 μmol/L格列奇特同时孵育24 h、48 h、72 h,细胞内MFI无明显降低,差异无统计学意义(F=2.18,P >0.05),见图3。
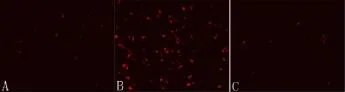
图1 荧光显微镜下HE探针染色MIN6细胞荧光×200A:对照组荧光强度;B:10 μmol/L格列吡嗪培养MIN6的荧光强度;C:10 μmol/L格列奇特培养MIN6的荧光强度

图2 格列吡嗪不同时间培养细胞Rh123的MFI
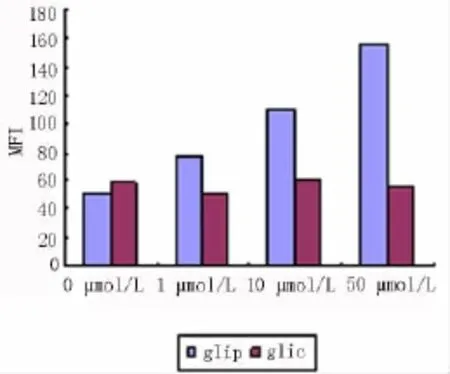
图3 不同浓度格列吡嗪和格列奇特培养细胞Rh123的MFI
2.3 细胞凋亡的检测
2.3.1 荧光显微镜 用 10 μmol/L Hoechst 33258孵育各组格列吡嗪培养基MIN6细胞1 h后,荧光显微镜下结果显示与正常组相比,作用48 h下细胞内的荧光明显增强,而格列奇特培养基MIN6细胞1 h后,荧光显微镜下结果显示与正常组相比,作用48 h下细胞内的荧光无明显增加,见图4。

图4 荧光显微镜下Hoechst 33258染色MIN6荧光×200
2.3.2 流式细胞仪
2.3.2.1 格列吡嗪药物浓度对MIN6凋亡的影响48 h正常MIN6细胞内Annexin-V的凋亡率为2.4±0.021,格列吡嗪药物浓度分别为 1 μmol/L、10 μmol/L、50 μmol/L培养基培养MIN6细胞凋亡率分别为 14.74 ±0.501、21.95 ±1.25、42.6 ±5.85。结果显示:与正常对照组比较差异显著,且随着浓度的增加药物,作用下的细胞内凋亡率生成明显增加(F=157.50,P <0.01),见图5。
2.3.2.2 格列吡嗪药物刺激下作用时间对MIN6凋亡率产生的影响 正常MIN6 24 h、48 h、72 h凋亡率分别为 2.18 ±0.8、1.4 ±0.58、3.0 ±0.95,含格列吡嗪10 μmol/L药物的DMEM培养相同时间后,凋亡率分别为 10.2 ± 1.54、20.35 ± 1.69、46.9 ±2.89,结果显示:与正常对照组比较差异显著。且在一定范围内随着时间的延长,格列吡嗪作用下的细胞内凋亡率生成明显增多(F=25.42,P <0.01),见图6。
2.3.2.3 格列奇特对MIN6细胞凋亡产生的影响48 h正常MIN6细胞内正常凋亡率为4.9±0.021,格列奇特药物浓度分别为 1 μmol/L、10 μmol/L、50 μmol/L培养基培养MIN6细胞凋亡率分别为10.2±1.21、10.47 ±1.05、14.75 ±2.08,与正常对照组无显著意义(F=2.25,P >0.05),见图 7。
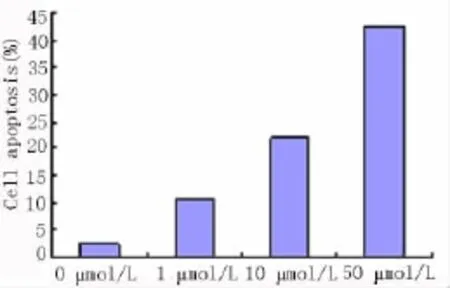
图5 不同浓度格列吡嗪培养的细胞凋亡率

图6 格列吡嗪不同时间干预细胞凋亡率
3 讨论
实验显示,格列吡嗪在治疗浓度范围刺激β细胞,细胞活力受到抑制,且与药物的浓度和药物作用时间呈依赖关系,浓度越高,作用时间越长,细胞活力抑制越明显。说明格列吡嗪在治疗浓度范围内可诱导MIN6细胞的氧化应激,产生 ROS,导致细胞凋亡。

图7 不同浓度格列吡嗪及格列奇特干预细胞凋亡率
格列奇特刺激MIN6细胞,实验组与对照组无明显差异。说明格列奇特不能诱导MIN6细胞氧化应激,不产生ROS,不影响细胞凋亡。格列奇特是第二代磺脲类降糖药,研究表明[5-7],它拥有一个特异氮杂环,在体内具有广泛的自由基清除剂的作用,抑制低密度脂蛋白的氧化,降低血小板的活性,减少自由基的产量。能全面增加血浆抗氧化能力,是有用的水溶性抗氧化剂,服用格列奇特10个月2型糖尿病患者能明显改善氧化应激状态,而服用格列吡嗪、格列本脲的2型糖尿病患者没有这种作用。最近学者研究发现[8-9],治疗浓度的格列奇特能够直接地保护因间接性高血糖诱发的人胰岛β细胞凋亡。它还可以部分抑制因过氧化氢诱导的MIN6死亡。格列奇特孵育的细胞硝基氨酸产量减少,而线粒体的形态学得到改善。而格列本脲没有这种作用,虽然格列奇特和格列本脲孵育的细胞胰岛素的分泌相似。本实验结果也符合以上结论,说明格列奇特具有抗氧化作用。
糖尿病是一种氧化应激增加的状态,许多证据表明氧化性损伤在糖尿病血管微血管并发症发展中起到重要作用。K Tetsushi[10]建立氧诱导的缺血性视网膜病变的糖尿病动物模型,结果发现格列奇特通过抑制氧化应激反应来抑制视网膜新生血管形成,从而防止糖尿病视网膜病变的发生。M Monami[11]回顾性观察了在568名2型糖尿病的门诊病人中抽取378名连续用格列本脲治疗,190名患者连续用格列奇特治疗,结果发现格列本脲治疗组心血管疾病病死率远远高于格列奇特治疗组。本实验结果显示格列奇特不诱导MIN6细胞发生氧化应激产生ROS,不引起MIN6凋亡,可以部分地解释以上现象。UKPDS[12]研究248名2型糖尿病患者随机口服格列本脲、格列吡嗪、格列奇特5年,结果发现药物继发性失效率分别是格列奇特7%,格列本脲17.9%(P<0.1),格列吡嗪 25.6%(P <0.005),说明了不同磺脲类药物继发性失效率是不同的,其他的一些临床实验也证实了氯磺丙脲比格列本脲有较高的失效率,格列奇特比格列本脲和格列吡嗪有明显的低的失效率。本实验结果可以说明部分的磺脲类药物诱发胰岛β细胞发生氧化应激产生活性氧,损害β细胞功能,激活细胞.凋亡途径,引起细胞凋亡,最终导致β细胞耗竭。而格列奇特对β细胞不直接产生氧化应激反应。临床上磺脲类药物出现继发性失效现象与药物刺激β细胞发生氧化应激可能有一定的关系,还需要进一步的探讨。
[1]ZIMMET P,ALBERTI KG,SHAW J.Global and societal implications of the diabetes epidemic[J].Nature,2001,414(6865):782-787.
[2]MANDRUP-POULSEN T:Apoptotic signal transduction pathways in diabetes[J].Biochem Pharmacol,2003,66(8):1433 -1440.
[3]TAVERNA MJ,PACHER N,BRUZZO F,et al.Beta-cell function evaluated by HOMA as a predictor of secondary sulphonylurea failure in type 2 diabetes[J].Diabet Med,2001,18(7):584 -588.
[4]KAISER N,LEIBOWITZ G,NESHER R.Glucotoxicity and betacell failure in type 2 diabetes mellitus[J].J Pediatr Endocrinol Metab,2003,16(1):5 -22.
[5]O'BRIEN RC,LUO M,BALAZS N,et al.In vitro and in vivo antioxidant properties of gliclazide[J].J Diabetes Complications,2000,14(14):201 -206.
[6]JENNINGS PE,BELCH JJ.Free radical scavenging activity of sulfonylureas:a clinical assessment of the effect of gliclazide[J].Metabolism,2000,49(2 Suppl 1):23 -26.
[7]FAVA D,CASSONE-FALDETTA M,LAURENTI O,et al.Gliclazide improves anti-oxidant status and nitric oxide-mediated vasodilation in type 2 diabetes[J].Diabet Med,2002,19(9):752 -757.
[8]DEL GUERRA S,GRUPILLO M,MASINI M,et al.Gliclazide protects human islet beta-cell from apoptosis induced by intermittent high glucose[J].Diabetes Metab Res Rev,2007,23(3):234 -238.
[9]KIMOTO K,KIZAKI T,SUZUKI K,et al.Gliclazide protects pancreatic beta-cells from damage by hydrogen peroxide[J].Biochem Biophys Res Commun,2003,303(1):112 -119.
[10]KIMURA T,TAKAGI H,SUZUMA K,et al.Comparisons between the beneficial effects of different sulphonylurea treatments on ischemia-induced retinal neovascularization.Free Radical Biology &Medicine[J].2007,43(3):454 - 461.
[11]MONAMI M,BALZI D,LAMANNA,et al.Are sulphonylureas all the same?A cohort study on cardiovascular and cancer-related mortality[J].Diabetes Metab Res Rev,2007,23(6):479 -484.
[12]HOLMAN R.Long term efficacy of sulphonylureas[J].Metab Clin Exp,2006,55:S2 -5.
