PRRS流行毒株与减毒活疫苗TJM-F92株qPCR区分方法的建立与应用
2013-11-30刘月月陶海英杜以军王兴东于江赵鹏伟刘思当王金宝吴家强
刘月月,陶海英,杜以军,2,王兴东,于江,2,赵鹏伟,2,刘思当,王金宝*,吴家强,2*
(1.山东省农业科学院畜牧兽医研究所,山东 济南 250100;2.山东省畜禽疫病防治与繁育重点实验室,山东 济南 250100;3. 山东农业大学 动物科技学院,山东 泰安 271018;4.山东省寿光圣城街道畜牧兽医管理站,山东 潍坊 262700)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)俗称猪蓝耳病,自2006年发生由变异毒株引起的高致病性蓝耳病以来,高致病性蓝耳病病毒已经成为我国猪场流行的优势毒株,对我国养猪业造成了巨大的经济损失[1]。近年来,人们一直致力于猪蓝耳病的免疫学研究,由于最早研发的猪蓝耳病灭活苗不能有效遏制该病的发生流行,猪蓝耳病经典毒株弱毒苗、变异毒株致弱苗被广泛使用[2]。但是,活疫苗的返强、变异、免疫抑制、对其它疫苗的干扰等问题正逐渐显现。
虽然如此,武华等[3]发现的猪繁殖与呼吸综合征TJM-F92减毒活疫苗,经大量临床验证该疫苗能够提升机体的细胞免疫,对防治PRRSV的感染具有良好的效果。目前,实验室检测PRRSV常用的ELISA方法不能有效的区别流行毒株与疫苗毒株[4]。梅林等[5]设计的普通PCR能够很好的区分野毒株与疫苗株,但比较费时,且不能对病毒含量进行定量检测。而荧光定量PCR不仅具有操作简便、敏感性高、特异性强、重复性好等优点,而且能够对高致病性毒株的含量进行定量分析,可以在疾病早期对PRRSV做出诊断[6-7]。
本研究根据TJM-F92减毒活疫苗与流行毒株Nsp2基因的缺失部位不同,选取Nsp2作为目的片段,旨在建立一步法SYBR Green I qPCR,以期实现对PRRSV流行毒与疫苗毒的鉴别,并为PRRSV隐形感染或者早期诊断提供技术支持。
1 材料与方法
1.1 毒 株
PRRSV SX-1分离株、猪乙脑病毒(JEV)、猪瘟病毒(CSFV)、猪流行性腹泻病毒(PEDV)、猪传染性胃肠炎病毒(TGEV)等均由本实验室保存,PRRSV TJM-92株减毒活疫苗购自青岛易邦生物工程有限公司。
1.2 引物设计
根据GenBank中发表的PRRSV SX-1(GQ857656)和PRRSV TJM-F92[8]中Nsp2缺失碱基部位的不同,利用Premier 5.0软件设计引物,扩增产物长度为131 bp,由上海生物工程技术服务有限公司合成。PRRSV(F1):5'- ACCAGGCGTTTCGCATCT-3';PRRSV(R1): 5'-ACTCTCTGCACTCACGGAAGG-3';PRRSV(F1 T7): 5'-TAATACGACTCACTATAGGGCGAACCAGGCGTTTCGCATCT-3'。
1.3 病毒RNA 的提取和体外转录模板的制备
用TRIzol(Invitrogen公司)法提取PRRSV SX-1的RNA。以提取的RNA 为模板, 选用引物F1 T7、R1 经一步法RT-PCR(大连宝生物工程有限公司) 扩增得到的目的条带作为体外转录模板。RT-PCR 扩增体系为50 μL:PrimenScript 1 Step Enzyme Mix 2 μL;2×1 Step Buffer 25 μL;引物F1T7、R1(10 μM)各1 μL;模板3 μL;RNase Free dH2O 18μL。反应条件为:50 ℃ 反转录30 min; 95 ℃ 预变性2 min; 94 ℃变性1 min, 55 ℃退火30 s, 72 ℃ 延伸1 min, 共32个循环; 72 ℃ 延伸10 min。取10 μL PCR产物经1% 的琼脂糖凝胶电泳检测, 凝胶成像系统(美国Alphalmager EC型)观察结果,并用紫外分光光度计(Thermo公司)测其浓度,同时将PCR产物送至上海生物工程技术服务有限公司测序,以确认T7启动子序列是否成功连入目的片段中。
1.4 RNA 标准品的合成
按体外转录试剂盒(大连宝生物工程有限公司)说明书要求,取1 μL PCR 产物用T7 RNA 聚合酶进行体外转录, 产物最终溶解于DEPC 水中, 并用紫外分光光度计测其浓度。通过公式将得到的RNA 换算为拷贝/μL, 用RNase Free Water 进行10 倍稀释, 作为标准品, -80 ℃保存。
1.5 荧光定量PCR检测PRRSV
对荧光定量PCR的引物浓度、退火温度、反应时间等条件探索,以得到最佳的qPCR反应条件。
1.6 标准曲线的建立
按上述优化的条件,选择109、 108、107、106、105、104拷贝/μL 6个浓度梯度的RNA标准品作为模板,每个共做3个重复进行扩增,得到各自的动力学曲线,仪器软件自动生成标准曲线(Roche480Ⅱ荧光定量PCR仪购自德国罗氏公司)。
1.7 敏感性试验
本试验分别以109、 108、107、106、105、104、103、102、101拷贝/μL的标准品作为模板,进行qPCR和常规RT-PCR检测,比较两种检测方法的敏感性。
1.8 特异性试验
以PRRSV TJM-F92株弱毒疫苗、猪乙脑病毒(JEV)、猪瘟病毒(CSFV)、猪流行性腹泻病毒(PEDV)、猪传染性胃肠炎病毒(TGEV)提取的RNA为模板进行荧光定量RT-PCR检测,以确定该方法的特异性。
1.9 RNA标准品的稳定性试验
取不同稀释度的RNA标准品,分别在第1、15、30 d进行qPCR检测,每个稀释度3个重复,以Ct值的变化作为评价其稳定性的指标。
1.10 临床样品检测
对送检的218份病料和血清(其中86份免疫过PRRSV TJM-F92株弱毒疫苗)进行常规RT-PCR和qPCR检测并比较。
2 结果与分析
2.1 扩增片段大小的鉴定
用引物F1T7、R1对提取的RNA模板进行qPCR扩增,取10 μL产物于1%琼脂糖凝胶上进行电泳,扩增出的带T7启动子的目的片段约131 bp, 与预期片段大小相符(图1)。测序结果显示T7启动子已成功连入扩增产物,可以在T7聚合酶的作用下进行体外转录,得到单链RNA。
2.2 RNA标准品的制备
体外转录所得的RNA经紫外分光光度计测定其浓度为384.5 ng/μL。根据公式将标准品浓度换算为拷贝/μL,并按比例稀释成1010~101拷贝/μL,- 80℃保存。
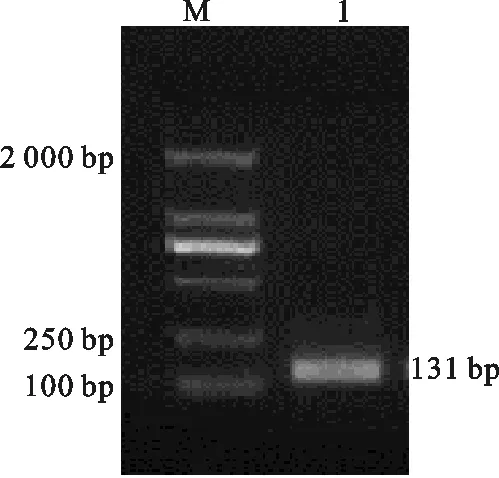
图1 qPCR扩增目的条带 Fig.1 qPCR amplification of target gene M.DL 2 000 DNA Marker ;1.qPCR扩增产物M. DL 2 000 DNA Marker;1. amplification product of qPCR
2.3 荧光定量PCR检测PRRSV方法优化
优化后的PCR反应体系为25 μL,其中2×One Step SYBR qPCR Buffer 12.5 μL;PrimScript 1 Step Enzyme Mix 1 μL;F1、R1引物(10 μM)各1 μL;Rnase Free dH2O 7.5 μL;总RNA 2 μL。荧光定量PCR反应条件为:42 ℃反转录5 min;95 ℃ 预变性3 min; 94 ℃10 s,55 ℃ 10 s, 进行40 个循环的扩增, 每个循环收集荧光信号。
2.4 标准曲线的建立
按上述优化条件,选择109、 108、107、106、105、104拷贝/μL 共6个梯度浓度的RNA标准品作为模板进行扩增,荧光定量PCR仪自动生成制作动力学曲线(图2)和标准曲线(图3)。结果显示各个稀释度之间具有良好的重复性,且标准曲线的线性方程为Y=-3.259X+38.55,决定系数R2=0.998。

循环数Cycle numbers

图3 荧光定量RT-PCR标准曲线Fig.3 Standard curve of fluorescent quantitative RT-PCR
2.5 敏感性试验
荧光定量PCR能检测出的模板最低浓度为1.0×101拷贝/μL (图4),而常规PCR能检出最低模板浓度为1.0×103拷贝/μL (图5),表明荧光定量PCR的敏感性比常规PCR高100倍。

循环数Cycle numbers
2.6 特异性试验
采用1.0×107拷贝/μL的RNA标准品作为阳性对照,同时以提取的PRRSV TJM-92、JEV、CSFV、PEDV、TGEV的RNA作为检测对象,进行一步法SYBR GreenI qPCR,结果表明35个循环内除阳性对照外,其余样品这些病毒的扩增曲线基本为水平线未出现有效的扩增信号。表明该方法有很好的特异性(图6),并能够准确的区分PRRSV 弱毒疫苗和野毒感染。
2.7 RNA标准品稳定性试验
RNA标准品在-80 ℃下有较好稳定性,不同浓度RNA标准品在不同时间测得的Ct值见表1。

由表1可知,不同浓度的RNA标准品变异系数均小于2%,说明该方法具有较好的稳定性。

表1 稳定性试验结果Table 1 Results of stability tests
2.8 临床样品的检测
对送检疑似蓝耳病的218份病料和血清(其中86份免疫过PRRSV减毒活疫苗 TJM-F92株)进行常规RT-PCR和qPCR检测并对比。试验结果如表2所示,免疫过TJM-F92株弱毒疫苗的猪群发病率明显低于未免疫或者免疫其他毒株疫苗的猪群,且qPCR检出率高于常规RT-PCR。

表2 临床样品检测结果Table 2 Results of clinical samples detection
3 讨 论
目前,高致病猪蓝耳病病毒已成为优势流行毒株。PRRSV的基因组全长约15 kb,含有九个开放阅读框(ORFs),其中以Nsp2的变异最大[9]。不同PRRSV间存在着长度不一的缺失,因而对Nsp2的分析在一定程度上可以反映病毒基因组序列的变异情况[10]。而我国流行的高致病性蓝耳病病毒在Nsp2基因的482和534~562位缺失了1个和29个氨基酸,TJM-F92减毒活疫苗又在原缺失的基础上缺失了120个氨基酸,这为鉴别诊断提供依据。
本研究在缺失序列处设计了一对引物,特异性试验也证实了该引物的高度特异性,可满足PRRS流行毒株检测要求。标准品是荧光定量 PCR 分析方法中最为重要的因素[11]。在研究PRRSV的荧光定量PCR试验时将目的片段克隆至T载体, 以鉴定正确的质粒为模板进行转录[12-13],而本试验选用RNA为模板制作标准曲线,通过在上游引物的5,端加入T7启动子序列,扩增的目的片段可以直接用T7 RNA聚合酶进行体外转录而获得,避免了以质粒为模板制备标准品过程中的连接转化、鉴定等步骤,大大简化了试验步骤。试验结果表明RNA标准品稳定性好, -80 ℃保存30 d无显著变化。
针对国内流行的高致病性PRRSV变异株基因组的特点,国内学者建立了高致病性PRRSV RT-PCR检测技术[14-15]。本研究采用的一步法SYBR Green I qPCR可在同一反应管中连续进行扩增和检测,只需要1 h的时间即可完成检测,较普通PCR反应时间缩短2 h,并且不需要普通PCR后的电泳处理,能有效防止污染,避免了假阳性结果的出现[16-17],另外荧光PCR仪能够在整个过程中自动记录读数并对扩增产物进行精确定量。灵敏性也比普通RT-PCR高出100倍;对临床送检样品的检测结果也显示qPCR的检出率比常规RT-PCR高出12.9个百分点。同时该方法实现了对流行毒株含量的定量检测。通过上述结果均显示了本试验方法可以很好地用于猪繁殖与呼吸综合征高致病性流行毒株与弱毒疫苗TJM-F92株的鉴别诊断,从而对PRRS做出及时的诊断。
参考文献:
[1] Tian K,Yu X,Zhao T,et al.Emergence of fatal PRRSV variants: unparalleled outbreaks of atypical PRRS in China and molecular dissection of the unique hallmark[J]. PLoS One,2007,2(6):e526.
[2] Zhou L, Zhang J, Zeng J,et al. The 30-amino-acid deletion in the Nsp2 of highly pathogenic porcine reproductive and respiratory syndrome virus emerging in China is not related to its virulence[J]. J Virol,2009,83(10):5 156-5 167.
[3] 武 华,冷 雪,李真光,等.预防猪感染猪繁殖与呼吸综合征的减毒活疫苗:中国,CN101633909[P].2010-01-27.
[4] 范忠军,柴 虹,王永明,等.猪繁殖与呼吸综合征诊断技术研究[J]. 上海畜牧兽医通讯,2007(3):62-63.
[5] 梅 林,赵建增,高英杰,等.猪繁殖与呼吸综合征病毒野毒株与基因缺失弱毒疫苗株 TJM-F92一步法RT-PCR鉴别方法的建立[J].中国生物制品学杂志,2012,25(4):492-494.
[6] Walker M J. Real time and quantitative PCR applications to mechanism based toxicology [J]. J Biochem Mol Toxicol, 2001, 15(3): 121-127.
[7] Spackman E, Senne D A, Myerst J, et al. Development of a real-time reverse transcriptase PCR assay for type A influenza virus and the avian H5 and H7 hemagglutinin subtypes[J]. Journal of Clinical Microbiology, 2002, 40(9): 3 256-3 260.
[8] 王凤雪,温永俊,武 华,等.高致病性PRRSV TJ株和致弱毒TJM株Nsp2测序及结构分析[J].河南农业大学学报,2011,45(1):86-91.
[9] Yoshii M,Okinaga T,Miyazaki A,et al.Genetic polymorphismof the nsp2 gene in North American type porcine reproductiveand respiratory syndrome virus[J].Arch Virol, 2008, 153 (7) ;1 323-1 334.
[10] 童光志,周艳君,赫晓芳,等.高致病性猪繁殖与呼吸综合征病毒的分离鉴定及其分子流行病学分析[J].中国预防兽医学报,2007,29(5):323-327.
[11] 孙军峰,刘华雷,王志亮,等.体外转录法制备新城疫病毒荧光定量RT-PCR标准阳性模板[J].中国畜牧兽医,2010,37(4):43-46.
[12] 刘园园,肖性龙,吴 晖,等. 高致病性猪繁殖与呼吸系统综合症病毒荧光定量PCR检测方法的建立[J]. 现代食品科技,2008(24):731-734.
[13] 王秋泉,邓中平. 高致病性猪繁殖与呼吸综合征病毒变异株荧光定量PCR检测方法的建立[J]. 分子诊断与治疗杂志, 2009,5(1):14-17.
[14] Tian K G, Yu X L, Zhao T Z, et al. Emergence of fatal PRRSV variants: unparalleled outbreaks of atypical PRRS in China and molecular dissection of the unique hallmark[J].PLos One,2007,2(6):526.
[15] 童光志, 周 君, 都 芳, 等. 高致病性猪繁殖与呼吸综合征病毒的分离鉴定及其分子流行病学分析[J].中国预防兽医学报,2007,29(5):323-327.
[16] 曹军平,赵 国,顾 敏,等.实时荧光定量RT-PCR方法检测禽流感病毒[J].中国兽医学报,2010,30(1):47-50.
[17] 史利军,孙 宇,尹惠琼,等.牛病毒性腹泻病病毒荧光定量PCR检测体系的建立与评价[J].中国兽医学报,2009,29(1):1 544-1 546.
