蓄电池废渣铅回收的铁置换处理法
2013-11-30王伟洲
王伟洲
(泉州幼儿师范高等专科学校,福建 泉州362000)
0 引言
随着科学技术的提高,社会经济的发展以及人民生活水平的不断提高,蓄电池的使用已经越来越多地融入到人们的日常生活之中。目前,世界精铅消费中约70%的铅用于蓄电池的生产,且全球蓄电池在铅的应用结构中占有的份额持续增加。废铅蓄电池,尤其是铅膏和硫酸,若不加以回收,都将成为环境的污染源。另外,人类对铅不断增长的需求,已使铅的矿产资源濒临枯竭的边缘,回收再生铅已成为实现铅工业可持续发展战略不可缺少的重要组成部分 。
回收铅的生产能耗比原生铅的生产能耗约低1/3左右;同时还可以减轻采、选、冶铅矿对环境和人体的危害,消除了废电池到处弃置对环境的影响。因此,发展高效、清洁的废铅蓄电池综合回收技术具有非常重要的意义。目前国内外采用的处理工艺主要为火法、湿法及湿法火法联合工艺。
火法处理时熔炼温度较高,常产生大量铅蒸汽和二氧化硫,严重污染环境,能源消耗大,铅回收率不高,炉渣、烟尘需专门处理。
湿法处理回收率高,但其流程长,设备投入大,技术要求高,操作复杂,同时电耗高达 500~800kWh/(t铅),难以取得经济效益,排出的废水含硫酸量较高,容易产生硫二次污染。
湿法—火法联合工艺需要增加脱硫系统的投资,且转化率不足90%,脱硫不彻底,硫得不到充分利用,也会造成下一步熔炼的环境污染和铅回收率的降低。
本文提出在100℃(近似温度)、一定PH值下,用Fe还原铅膏里的铅化合物得到铅固体。探讨最佳反应条件:PH值、反应时间,希望能高效置换铅并尽量降低铁的消耗量,减少二次污染。
1 实验部分
1.1 主要仪器
电热恒温鼓风干燥箱、数显酸度计、管式电阻炉、电子天平、台式离心机。
1.2 试剂
盐酸(AR)、铁粉(AR)、铅膏(废蓄电池)、蒸馏水
1.3 反应原理

反应产生的氢气可以把反应产生的铅从铁的表面剥落下来,有利于下一步分离。把得到的固体混合物碾碎后磁选可实现铁跟铅的分离。
1.4 实验方法
1.4.1 含铅废渣的清洗
从废蓄电池取得铅膏,经多次水洗、沉淀,用分液法去掉固体颗粒,把每次水洗得到的悬浊液混合摇匀,即得含铅的混合液体样本。
1.4.2 含铅量的测定
用量筒量取17ml的样品溶液与100ml的烧杯中,称得重量76.1124g。100ml干燥烧杯重是55.3520g。在100℃电热炉上加热沸腾,直到基本没有液体时拿到干燥箱里80℃慢慢烘干。烘干取出后称量58.2881g,减去烧杯重量得干燥固体重量为2.9357g。即得17ml样品中含有2.9357g含铅固体。
由反应式:
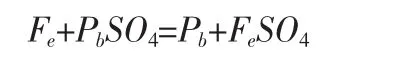
得:反应2.9357gPbSO4理论上需要消耗0.57g铁。计算可得反应100ml的样品溶液需要3.352g的铁,又由于反应中存在铁跟酸的副反应等会消耗部分铁,所以用2倍于理论量的铁,即 7.704g 左右。
1.4.3 铁浓度—时间关系曲线、铅浓度—时间关系曲线的绘制
某一PH值,量取145ml的样品于500ml的烧杯中,称取9.6010g的铁粉。把烧杯放在电热炉上,当加热到沸腾时调节PH值使之不变,加入称好的铁粉,并开始计时。取样时间分别是 0min,2min,4min,6 min,8min,10min,15min。 此过程中还必须时时观察酸度计,注意溶液PH的变化,要及时滴加盐酸,保持PH不变。
将得到的7个样品的上层清液转移到离心管,在5000转的情况下离心十分钟,结束后用移用管吸取1ml移到干燥的试管,再稀释到5ml。用火焰原子吸收分光光度计测吸光度,比对铁标准、铅标准曲线测定铁含量、铅含量,画出对应浓度—时间曲线图。
2 实验结果与讨论
2.1 实验结果
PH为1~6的铁浓度、铅浓度—时间关系曲线如图1、图2所示。
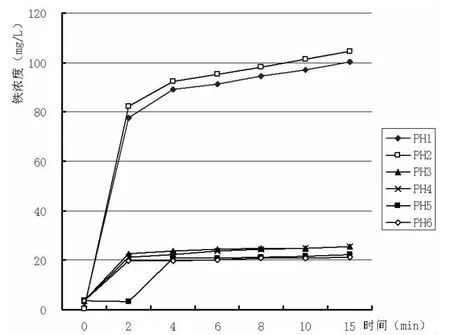
图1 PH:1~6的铁浓度—时间关系曲线
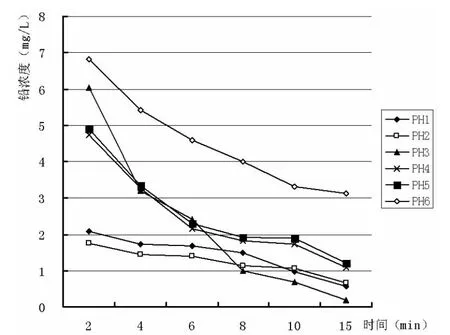
图2 PH:1~6的铅浓度—时间关系曲线
2.2 反应条件的分析
2.2.1 当 PH=1 的时候
温度是100℃,反应进行到2min的时候,溶液呈强酸性,铁还原性强,反应速度非常快,铁离子浓度一下子达到了77.692mg/L。但由于铁过量,这个过程中它还会跟铅剧烈反应,把铅离子还原为铅固体,使铅含量在2min内从45.876mg/L降到了2.077mg/L。这2min内铁离子的量变化是最大的,整个实验在这个过程基本已经完成。接下来的时间由于反应产生的铅会包裹在未反应的铁粉上,使一部分的铁未能参加反应,但是这个时候会有很多氢气产生,使包裹的混合体很疏松,易剥落。这也是为什么反应过程中不断有黑色疏松固体产生的原因,这也为后续的铅的分离过程起到了很大的作用,在2—15min内铁由于被铅包裹导致反应速度很慢。最后的出水含铅量降到了0.573mg/L,达到了国家污水排放标准(国家污水排放标准:<1.0mg/L)。
2.2.2 当 PH=2 的时候
这个过程铁,铅的反应情况基本和PH=1的时候一样,前两分钟反应剧烈,后段时间反应趋于平稳。这段时间铅含量降到了0.665mg/L,没有PH=1的时候效果好。不过都达到了国家污水排放标准。
2.2.3 当 PH=3 的时候
反应过程还是在前两分钟反应剧烈,由于酸性没有前两次强,铁的消耗量减小,15min的时候含量也只有25.398mg/L。在这个条件下,铅反应效果较前两次都是最好的,最后可以达到0.195mg/L。反应在2min后还有比较大的变化量,反应在第10min的时候铅含量降到了0.676mg/L,综合实际经济效益考虑,反应时间在10min的时候就可以了。
2.2.4 当 PH=4 的时候
这个条件下铁消耗也不多,基本也是在前两分钟内反应最剧烈。到实验结束时含量达到25.398mg/L。不过这个条件下铅反应不完全,开始在前两分钟的时候反应也是剧烈,后面 2-15min的时候也只是从 4.736mg/L到1.086min/L, 没有达到国家污水排放标准。
2.2.5 当 PH=5,PH=6 的时候
这两个情况跟PH=4的情况基本一样,随着酸性的降低,铅还原效果越不理想,到15min的时候到尚未达到国家标准。
3 结论
考虑实际生产效益,确定反应时间在10分钟,PH=3,反应温度为100℃。在这个条件下,反应后溶液铅含量可以降到0.676mg/L,符合国家污水排放标准。反应后的固体混合物通过粉碎磁选的方法分离得到铅单质,产生的废水可以通过加入石灰来中和。
本次探讨了利用铁粉在酸性条件下的还原,设备、工艺简单,操作简便,金属回收率高,生产费用低,规模大小皆宜,效果较为理想,具有一定工业应用价值。
[1]徐惠忠,王德义,赵呜.固体废弃物资源化技术[M].北京:化学工业出版社,2004.
[2]唐艳芬,高虹.国外废旧电池回收处理研究现状[J].有色矿冶,2007,23(4):50-52.
[3]傅欣,贡佩芸,傅毅诚.废铅蓄电池的综合回收利用研究[J].再生资源研究,2007(4):25-26.
[4]杨景良,裴东,曲晓红.废旧回收利用技术及对策[J].环境卫生工程,2009,17(4):40-42.
[5]Lyakov NK,Atanasova D A,Vassilev VS.Desulphurization of damped battery paste by sodiumcarbonate and sodium hy droxide.[J].Journal of Power Sources.2007,171:960-965.
[6]Karami H,Karimi M A,Haghdar S,et al.Synthesis of lead oxidenano particles bysonochemical method andits applicationas cathode andanode of lead-acid batteries[J].Materials Chemistryand Physics.2008,108:337-344.
[7]郭翠香,赵由才.从废铅蓄电池中湿法回收铅的技术进展[J].东莞理工学院学报,2006(01):81-86.
[8]胡红云,朱新锋,杨家宽.湿法回收废旧铅酸蓄电池中铅的研究进展[J].化工进展,2009(09):1662-1666.
[9]唱鹤鸣,任德章.废铅酸电池铅膏处理新工艺[J].南通大学学报:自然科学版,2011(02):37-40.
[10]郭蕴.报废铅酸蓄电池的回收利用研究[J].云南民族学院学报:自然科学版,2003(03):184-185.
[11]李敏,刘毅,朱东方,薄新党,王宏力.废旧蓄电池中再生铅资源的回收利用[J].河南化工,2012(07):25-27.
