H9N2亚型猪流感病毒的增殖及毒力测定
2013-11-29魏东
魏 东
(河北北方学院动物科技学院,河北 张家口075000)
0 前 言
病毒缺乏增殖所需要的酶系统,只能在有感受性的活的宿主细胞内增殖,即以病毒基因为模板,进行自我复制。试验所使用的猪流感病毒株经过-70℃低温贮存,其毒力有较大差别,病毒有必要进行进一步培养,和增殖。鸡胚接种法、动物接种法和组织培养法是目前常用的病毒培养方法。鸡胚是正在发育的活体,病毒在鸡胚中易于生长和增殖,多种病毒都能在鸡胚中进行传代[1];而且SPF鸡胚来源容易、无病毒的隐性感染、对培养条件无特殊要求,接种途径和时间的可选性强、操作简单,胚胎的组织分化程度低,没有明显的自身组织特征,病毒在鸡胚中易于增殖,部分病毒感染鸡胚以后可以产生痘斑,引起充血、出血、坏死灶和死亡等特异性感染指征。对于大多数病毒来说,鸡胚接种法是最为常用的病毒培养方法,其中鸡胚尿囊腔接种法是目前最常用的病毒增殖方式。本研究采用鸡胚尿囊腔增殖法对试验用H9N2-SIV毒株进行增殖,在病毒增殖后进一步测定其对鸡胚和小鼠的毒力。
1 材料和方法
1.1 材料
1.1.1 病毒和主要试剂
H9N2亚型猪流感病毒A/swine/HeBei/012/2008 (H9N2) (H9N2-SIV)由本课题组分离,经中国农业科学院哈尔滨兽医研究所鉴定,河北北方学院动物科技学院预防兽医学实验室保存。
其他试验药品均为分析纯,试剂由课题组自配。
1.1.2 主要仪器设备
GRUMBACH孵蛋器,德国Grumbach公司;Heraeus Fresco 17离心机、超低温冰箱、Thermo 1300series A2生物安全柜、微量加样器,美国Thermo Scientific公司;电子天平,赛多利斯科学仪器(北京)有限公司;新型电热恒温鼓风干燥箱,宁波江南仪器厂;照蛋器,青岛兴仪电子设备有限公司;V形血凝板,上海基星生物科技有限公司。
1.1.3 实验动物
6~8日龄SPF鸡胚 (北京梅里亚维通实验动物技术有限公司)[SCXK (京)2009-0003],于接种前进行孵化至10日龄;
8周龄SPF级BALB/c雌性小鼠 (北京华阜康生物科技股份有限公司)[SCXK (京)2009-0004];
动物试验在中国人民解放军251医院三级生物安全实验室 (BSL-3,P3)进行 [SYXK (军)2007-018],并按实验动物使用的3R原则给予人道关怀。
1.2 方法
1.2.1 H9N2-SIV的增殖及血凝效价测定
将病毒原液作10倍稀释,采用鸡胚尿囊腔接种法[2]将H9N2-SIV病毒接种于10日龄鸡胚,收取尿囊液进行血凝试验。
1.2.1.1 H9N2-SIV的增殖-鸡胚尿囊腔接种法
(1)验蛋,判断活胚或死胚。取10日龄的SPF鸡胚30只,先检查鸡胚外观,有裂痕、发育不全或有其它问题的鸡胚应弃掉不用。然后用照蛋器检测,根据正常鸡胚标准对鸡胚进行判别,对于不符合要求的死胚、无受精胚等弃掉不用。对于可用鸡胚,标记鸡胚的尿囊与气室的界限和胚胎位置,并在气室端、鸡头方的鸡胚尿囊膜边缘上方0.5cm处避开血管作一标记 (注射点)。

表1 鸡胚标准
(2)消毒。取干净已消毒蛋盘,将鸡胚气室朝上竖放于蛋盘上,在气室部和标记处先后用碘酊和酒精消毒蛋壳表面,用打孔器在标记处钻一小孔。
(3)接种。取l mL注射器吸取病毒液,由钻孔处垂直进针,经绒毛尿囊膜注入0.1mL病毒液到尿囊腔中。
(4)封孔。接种前先将石蜡融化,待接种后立即用石蜡将蛋壳上的针孔完全封闭,并做标记。
(5)孵育。将接种后的鸡胚放入37℃温箱中孵育48~72h(相对湿度为45%~60%),接种后24h照胚,将24h内死亡的鸡胚弃去 (因机械操作、细菌或霉菌污染等非特性因素所引起,认为是非特异死亡),以后每4~6h照胚检查1次,随时取出死亡鸡胚,放入2~8℃冷胚。
(6)冷胚。鸡胚在收获前置4℃冰箱6h或过夜 (使血液凝固,以免收获时流出红细胞,并同尿囊液的病毒发生凝集,造成病毒滴度下降,但不能放置时间过长;如急于收胚也可将鸡胚置于-20℃、1h左右)。
(7)收胚。把冷却好的鸡胚气室向上放在蛋盘上置于无菌室,将鸡胚气室部表面先后用碘酊和酒精消毒。先用无菌镊子击破气室部卵壳并轻轻将蛋壳剥除,然后小心将气室部壳膜从绒毛尿囊膜撕去,并将其翻开到卵壳边上 (不要损伤绒毛尿囊膜),另换两把无菌眼科镊子在绒毛尿囊膜上撕开一小口,用一把眼科镊子斜插入绒毛尿囊膜轻轻压住胚胎,用灭菌注射器或移液器吸取尿囊液 (病毒液)于无菌EP管中(如操作时损伤了血管或胚胎,尿囊液混浊,则弃去不用),将尿囊收获液 (病毒液)于3 000r·min-1离心5min去除里面的杂质[3],标记后置低温冰箱中保存待检。
1.2.1.2 血凝 (HA)试验测定病毒液效价
为使下一步的试验顺利进行,需要测定病毒与红细胞的凝集价,以确定试验所用病毒的稀释倍数 (抗原单位)。本试验采用微量法,在V形血凝板上进行。
(1)取50μL的生理盐水加入96孔V型血凝板A-H行的1~12孔;
(2)被检病毒液50μL分别加入A-H行的第1孔,然后抽取50μL倍比稀释至第11孔,弃去50μL,12孔不加作为阴性对照;
(3)从低浓度至高浓度,每孔加入50μL 1%鸡红细胞悬液 (采健康雄鸡血液5~10mL于提前已加入4%枸椽酸钠抗凝剂的大试管中,生理盐水将血浆、白细胞等充分洗去,2 000r·min-1离心5~10min,共洗涤3~5次,最后将洗后的红细胞用生理盐水稀释成1%的悬浮液,置4℃保存备用);
(4)轻轻振荡混匀、37℃静置20min;
(5)观察结果,根据发生凝集反应病毒的稀释倍数确定HA滴度。
结果判定:将V形血凝板倾斜至45°,如果红细胞沿着倾斜面向下呈线状流动者,表明红细胞与病毒没有或不完全凝集;如果红细胞平铺于孔底,凝成均匀薄层,倾斜后也不流动,说明红细胞被病毒凝集。
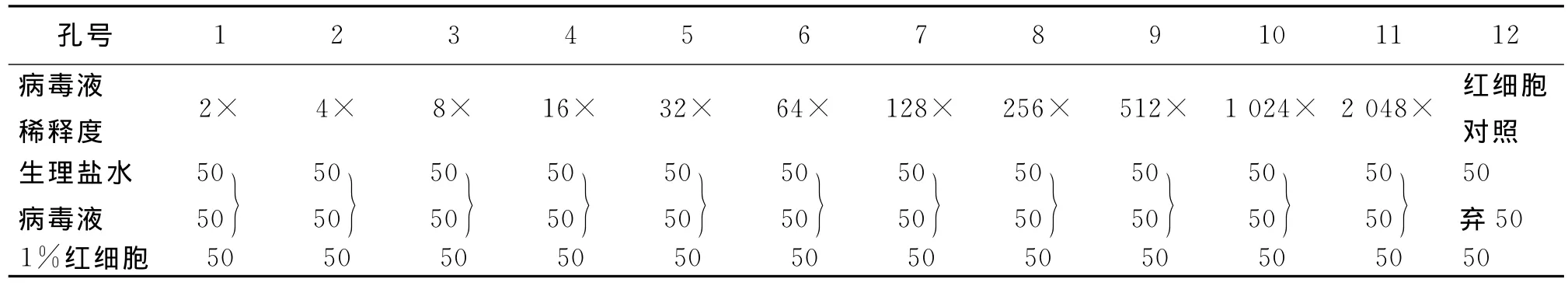
表2 血凝试验方法 (μL)
1.2.2 鸡胚半数感染量 (EID50)的测定
用灭菌生理盐水将1.2.1所选择的病毒液用灭菌生理盐水作10倍梯度稀释至10-10。然后通过尿囊腔途径分别接种于10日龄鸡胚尿囊腔,0.1mL/胚,每个稀释度接种5枚鸡胚,石蜡封口,置37℃温箱中孵育,具体操作方法同1.2.1,每12h观察一次,24h之内死亡的鸡胚弃掉,24h之后死亡的鸡胚置4℃保存,连续观察72h,收集尿囊液作血球凝集试验,出现血凝者判阳性,采用Reed-Muench法[4]计算EID50。
1.2.3 小鼠半数致死量 (MLD50)测定
取8周龄SPF级BALB/c雌性小鼠30只,随机分成6组作为H9N2-SIV感染组 (感染组),用灭菌生理盐水将病毒液从100开始作10倍梯度稀释至10-5,每个稀释度分别经鼻腔滴鼻接种一组小鼠,接种剂量为0.1mL/只。另外取5只小鼠作为对照组,滴鼻接种0.1mL的经灭菌生理盐水5倍稀释的正常鸡胚尿囊液。接种后于ABSL-3实验室中正常饲养,连续观察14d,记录各组小鼠的发病和死亡情况,按照Reed-Muench法[4]计算 MLD50。
Reed-Muench计算方法:

2 结果与分析
2.1 H9N2-SIV增殖及血凝效价测定
每枚鸡胚可以收集约5mL左右尿囊液,大部分鸡胚尿囊液血凝效价在1∶128~1∶1 024之间。为了避免实验误差和合理运用病毒液且不造成病毒液的浪费,取血凝效价在1∶128~1∶1 024之间的鸡胚尿囊液混合,混合后测定鸡胚尿囊液的血凝效价为1∶256,该病毒液 (混合鸡胚尿囊液)确定为下一步试验用病毒原液,分装后贮存于-70℃备用。
2.2 H9N2-SIV感染鸡胚EID50测定
将血凝效价为1∶256的病毒液用灭菌生理盐水作10倍梯度稀释至10-10,分别接种鸡胚,结果见表3,病毒的 EID50=10-6.5·0.1mL-1。
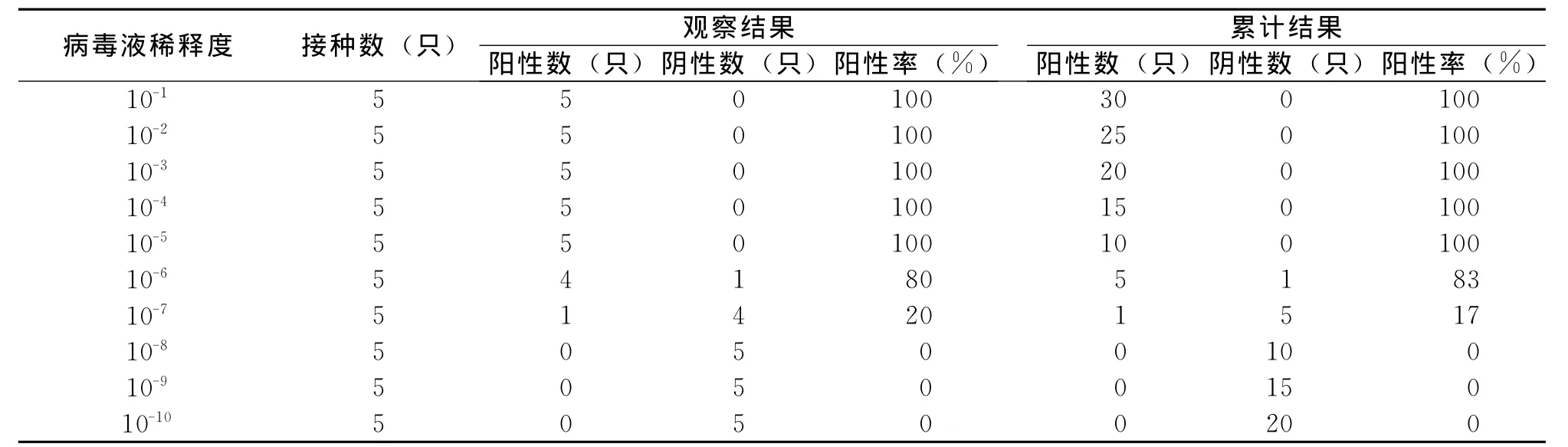
表3 H9N2-SIV感染鸡胚EID50测定结果
2.3 H9N2-SIV感染小鼠 MLD50测定
将血凝效价为1∶256的病毒液用灭菌生理盐水作10倍梯度稀释,经鼻腔滴鼻接种BALB/c小鼠,小鼠存活与死亡数目见表4。结果表明含病毒高的剂量 (低稀释度)引起小鼠出现明显的发病以及100%的死亡,随着稀释度的增加 (病毒含量降低),小鼠死亡相对减少,存活率增加,试验小鼠50%出现死亡的病毒稀释度在10-2~10-3之间,按照Reed-Muench法计算 MLD50,MLD50=10-2.32·0.l mL-1,即能使50%小鼠死亡的病毒稀释度为10-2.32。
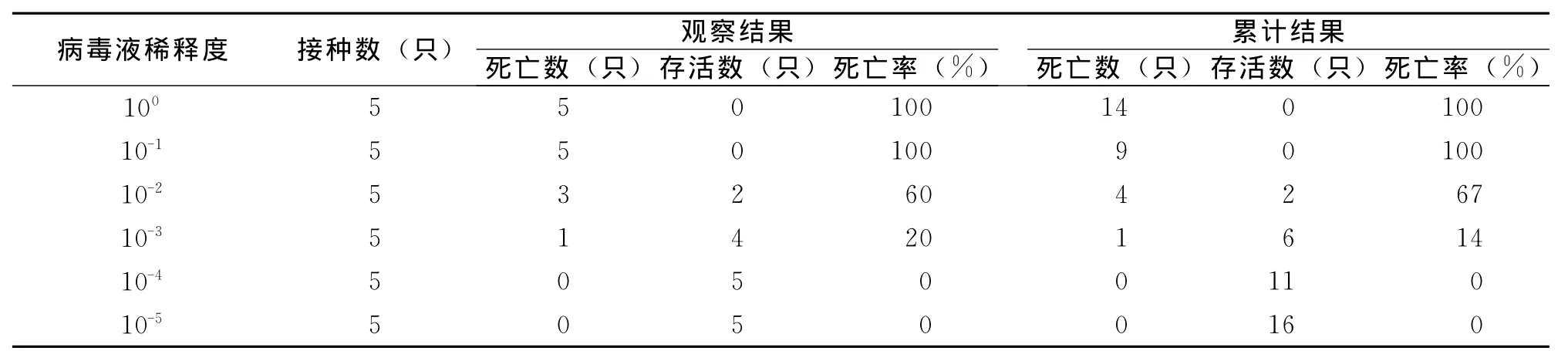
表4 H9N2-SIV感染小鼠MLD50测定
3 讨论和结论
为保证病毒在使用时效价最高、最稳定,且不造成浪费,应确定病毒滴度,即病毒的毒力,也称为毒价。衡量毒价的单位有最小致死量 (MLD)、最小感染量 (MID)和半数致死量 (LD50)等,但由于剂量的递增与死亡率递增不呈线性关系,在越接近100%死亡时,对剂量的递增越不敏感。而一般在死亡率越接近50%时,对剂量的变化越敏感,所以现多改用半数致死量 (LD50)作为毒价测定单位,即经规定的途径,以不同的剂量接种试验动物,在一定时间内能致半数试验动物死亡的病毒量。应用半数致死量的方法有助于减少量度极端情况所带来的问题和减少试验的次数,节省时间和经费。然而,病毒对试验动物的致病作用不一定都以死亡为标志,例如以感染发病作指标,则可以测定半数感染量 (ID50);此外,当试验材料是鸡胚时则用鸡胚半数致死量 (ELD50)或鸡胚半数感染量 (EID50)表示;试验材料是鼠类时则用鼠半数致死量 (MLD50)表示;试验材料是细胞时则用组织细胞培养半数感染量 (TCID50)表示。
Reed-Muench法在病毒学研究中使用较多,适用于整体及离体实验数据,但该方法报告的信息较少,结果不如正规概率单位计算法严谨,由于是用累积法计算,计算结果有一定的缺陷,误差也较大。尽管如此,由于该方法计算简单、使用方便,仍是目前计算LD50、ID50等数据最常用的方法。在实际操作中一般选择10~100个 LD50作为病毒的接种浓度[5-9]。
试验测定 H9N2-SIV经鸡胚增殖后病毒液的血凝效价为1∶256,病毒的EID50为10-6.5·0.1mL-1,MLD50为10-2.32·0.1mL-1,该病毒可用于进一步的试验。
[1]邵攀峰,何叶峰,余彬辉,等.鸡胚增殖病毒技术操作要点[J].养禽与禽病防治,2011,(02):29-30.
[2]陈声明,刘丽丽.微生物学研究法[M].北京:中国农业科技出版社,1996:127-128.
[3]孙惠惠.H1N1小鼠模型的建立及板蓝根颗粒对H1N1模型小鼠的作用的研究[D].北京:北京协和医学院,2010.
[4]殷震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997.
[5]蒲秀瑛.贯叶连翘提取物对甲型流感病毒的作用及免疫调节机制的研究[D].甘肃:甘肃农业大学,2009.
[6]杨子峰,刘妮,黄碧松,等.牛蒡子甙元体内抗甲Ⅰ型流感病毒作用的研究[J].中药材,2005,28(11):1012-1014.
[7]张烜榕,王涛,申元英,等.甲型流感病毒感染BALB/c鼠动物模型的建立[J].大理学院学报,2007,6(10):25-27.
[8]杜淑娟,程树军,袁美凤.副流感病毒小鼠动物模型的建立及病理学研究[J].中国比较医学杂志,2006,16(07):387-389.
[9]张瑞莉,刘明,张卓.鹅源H5N1亚型禽流感病毒感染雏鸡免疫器官细胞凋亡的研究[J].中国预防兽医学报,2011,33(03):177-180.
