miR-150缺失增强小鼠NKT细胞IFN-γ产生并促进小鼠Ⅰ型糖尿病的发生①
2013-11-28郑全辉张爱红郑爱华陈淑媛侯志宏高金明郑建兴
郑全辉 张爱红 郑爱华 陈淑媛 侯志宏 高金明 郑建兴 李 娟
(河北联合大学基础医学院,唐山063000)
NKT细胞是CD1d依赖的自然杀伤性T细胞(CD1d dependent natural killer T cells),因其细胞表面既表达 TCRα 链(小鼠:Vα14-Jα18,人:Vα24-Jα18)和 Vβ 链 (小鼠:Vβ8.2,Vβ7,Vβ2,人:Vβ11),同时又表达 NK 细胞受体如 NK1.1、IL-2/15受体β(CD122)等而命名[1]。在外周免疫器官,NKT细胞特异识别由CD1d分子提呈的糖脂类抗原α-半乳糖苷神经酰胺(α-Galcer)而活化,活化NKT细胞能在短时间内产生大量Th1和Th2型细胞因子如IL-4和IFN-γ,从而在抗感染、自身免疫性疾病及肿瘤治疗中发挥重要的作用[2]。
microRNAs(miRNAs)属于短链非编码RNAs,长度为20~23nt,通过与靶mRNA 3'端非翻译区结合,导致靶mRNA降解或抑制其翻译,负向调节靶基因的表达[3]。miR-150是淋巴细胞特异表达的microRNA,Zhou等[4]最早发现 miR-150缺失导致 B细胞异常扩增,体液免疫应答显著增强,但对CD4和CD8传统T细胞的发育和功能没有影响,表明miR-150在不同淋巴细胞发育和功能中发挥不同的作用。然而,miR-150在NKT细胞发育和功能中的作用目前还不清楚。在此研究中,我们采用miR-150基因敲除(miR-150KO)小鼠,发现miR-150基因缺失不影响外周NKT细胞的数量,但导致NKT细胞IFN-γ产生增加。在STZ处理糖尿病小鼠模型中,发现α-Galcer处理miR-150敲除小鼠与对照WT小鼠相比,糖尿病的发生显著提前。以上研究结果为探索microRNA对NKT细胞功能的影响及其在自身免疫性疾病中的作用提供了新的线索。
1 材料与方法
1.1 实验材料
1.1.1 小鼠 C57BL/6背景的miR-150基因敲除小鼠(miR-150KO)和野生型对照 C57BL/6小鼠(WT)由Qing-Sheng Mi博士(美国密歇根亨利·福特医院)惠赠,并在河北联合大学SPF级小鼠房繁殖、饲养。实验选取4~6周龄、性别匹配小鼠进行研究。小鼠实验操作按河北联合大学实验动物管理委员会规定进行。miR-150敲除小鼠基因型鉴定采用下列引物:上游:5-CAAGGACAGGAACCCTTCAGCA-3;下游 5-CCATGATGCCTGGAAGACATTTC-3;miR-150KO小鼠产生262 bp片段,WT小鼠产生866 bp片段。
1.1.2 试剂 MirVana miRNA提取试剂盒和Taq-Man MicroRNA检测试剂盒购自美国Ambion公司。α-半乳糖神经鞘氨醇(α-Galcer)及荧光素标记的CD1d-α-Galcer四聚体购自日本麒麟公司,荧光素标记的抗小鼠 TCR-β(H57-597)、抗 B220(RA3-6B2)、抗 IL-4(11B11)、抗 IFN-γ (XMG1.2)抗体和细胞内染色试剂盒购自BD公司,大鼠抗小鼠FcR单克隆抗体(2.4G2)取自 2.4G2杂交瘤细胞培养上清,IFN-γ和IL-4 ELISA检测试剂盒购自北京达科为生物技术公司,链脲佐菌素(STZ)购自Sigma,引物由上海生物工程服务公司合成。
1.2 实验方法
1.2.1 流式细胞仪分析 分别分离小鼠胸腺、脾、肝脏、骨髓和淋巴结并制成单细胞悬液,用含2%小牛血清的PBS染色缓冲液洗涤两次,加入2.4G2封闭,4℃ 30分钟,然后直接加入适当浓度荧光素标记的单克隆抗体,4℃ 30分钟。染色缓冲液洗涤两次,采用BD-LSRⅡ流式细胞仪收集标本,CellQuest Pro(BD Biosciences)软件进行数据分析。
1.2.2 NKT细胞活化及细胞内染色分析 将α-Galcer首先溶于二甲基亚砜(DMSO),终浓度为100 μg/ml。取 2 μg α-Galcer 于 100 μl磷酸盐缓冲液(PBS)中,经尾静脉注入小鼠体内,溶剂对照采用相同剂量DMSO。4小时后分离小鼠脾细胞,1×红细胞裂解液处理去除红细胞,取2×106细胞/样品重悬于RPMI1640培养液(含10%胎牛血清,2 mmol/L谷氨酰胺,10 mmol/L HEPES,50 mmol/L 2-巯基乙醇),同时加入 GolgiStop,37℃培养2小时。细胞(1×106/100 μl)首先经细胞表面染色,冷PBS洗涤后加入新鲜配置固定/透膜液(1∶3稀释)0.5 ml,4℃避光孵育30~60分钟。加入2 ml 1×固定/透膜液洗涤一次,加入2.4G2 4℃封闭15分钟,直接加入抗小鼠IFN-γ和IL-4抗体进行细胞内染色,4℃避光孵育30分钟,2 ml 1×固定/透膜液洗涤两次,流式细胞仪分析。
1.2.3 酶联免疫吸附实验(ELISA) 采用结合缓冲液(0.1 mol/L Na2HPO4,pH9.0)稀释抗小鼠 IL-4和 IFN-γ 抗体至 2 μg/ml,100 μl/孔 加 入相 应ELISA板,4℃包被过夜。移除包被液,加入封闭缓冲液(1%BSA),200 μl/每孔,室温 2小时。PBS/Tween20洗涤3次后加入1∶50稀释的α-Galcer处理小鼠血清和倍比稀释标准血清,100 μl/每孔,室温4小时。PBS/Tween20洗涤3次后加入底物显色,450 nm处测量吸光度(OD)。
1.2.4 小鼠糖尿病模型制作及α-Galcer处理 链脲佐菌素(STZ)溶于0.1 mol/L pH4.4的枸橼酸盐缓冲液,选择雄性野生型C57BL/6和miR-150KO小鼠,STZ 65 mg/kg腹腔注射,连续注射5日,STZ注射当天分别注射α-Galcer,100 μg/kg,每3天注射1次,连续注射3次。STZ注射2周后,取鼠尾血检测血糖,每周测量1次,连续测量6周。小鼠糖尿病判断标准为血糖浓度大于12 mmol/L。
1.2.5 实时定量 RT-PCR 采用 Ambion mirVana miRNA提取试剂盒分别提取WT和miR-150KO小鼠胸腺及脾脏细胞总RNA,采用TaqMan MicroRNA检测试剂盒进行反转录和PCR扩增,以snoRNU202作为内参照。PCR扩增产物检测采用ABI 7900 Real-time PCR system进行。结果分析采用^CT值,并计算相对表达。
1.3 统计学分析 数据分析采用GraphPad Prism 5或Microsoft Excel统计软件,结果采用±s表示,组间差异采用双尾Student's t检验,P<0.05为组间有统计学差异。
2 结果
2.1 MiR-150敲除不影响小鼠外周NKT细胞的数量 基因鉴定结果表明,miR-150KO小鼠基因型正确(图1A);Real-time PCR结果显示 miR-150在miR-150KO小鼠中的表达显著降低(图1B)。采用抗-B220 抗体、抗-TCR-β 抗体和 CD1d-α-Galcer三染色,流式分析NKT细胞在miR-150KO小鼠外周免疫器官的数量变化,发现miR-150KO小鼠除在淋巴结NKT细胞的百分率和细胞数量显示增加的趋势,在NKT细胞分布的主要免疫器官如脾脏、骨髓和肝脏,miR-150KO小鼠与WT小鼠相比,NKT细胞的百分率和细胞数量没有显著变化(图1C、D)。
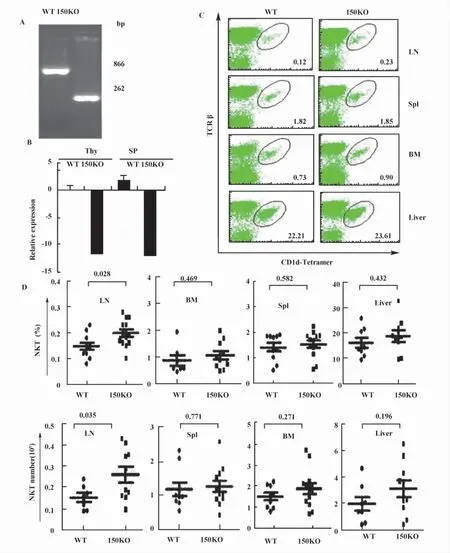
图1 miR-150敲除小鼠外周免疫器官NKT细胞数量变化Fig.1 NKT cell number changes in the peripheral lymph organs in miR-150KO mice
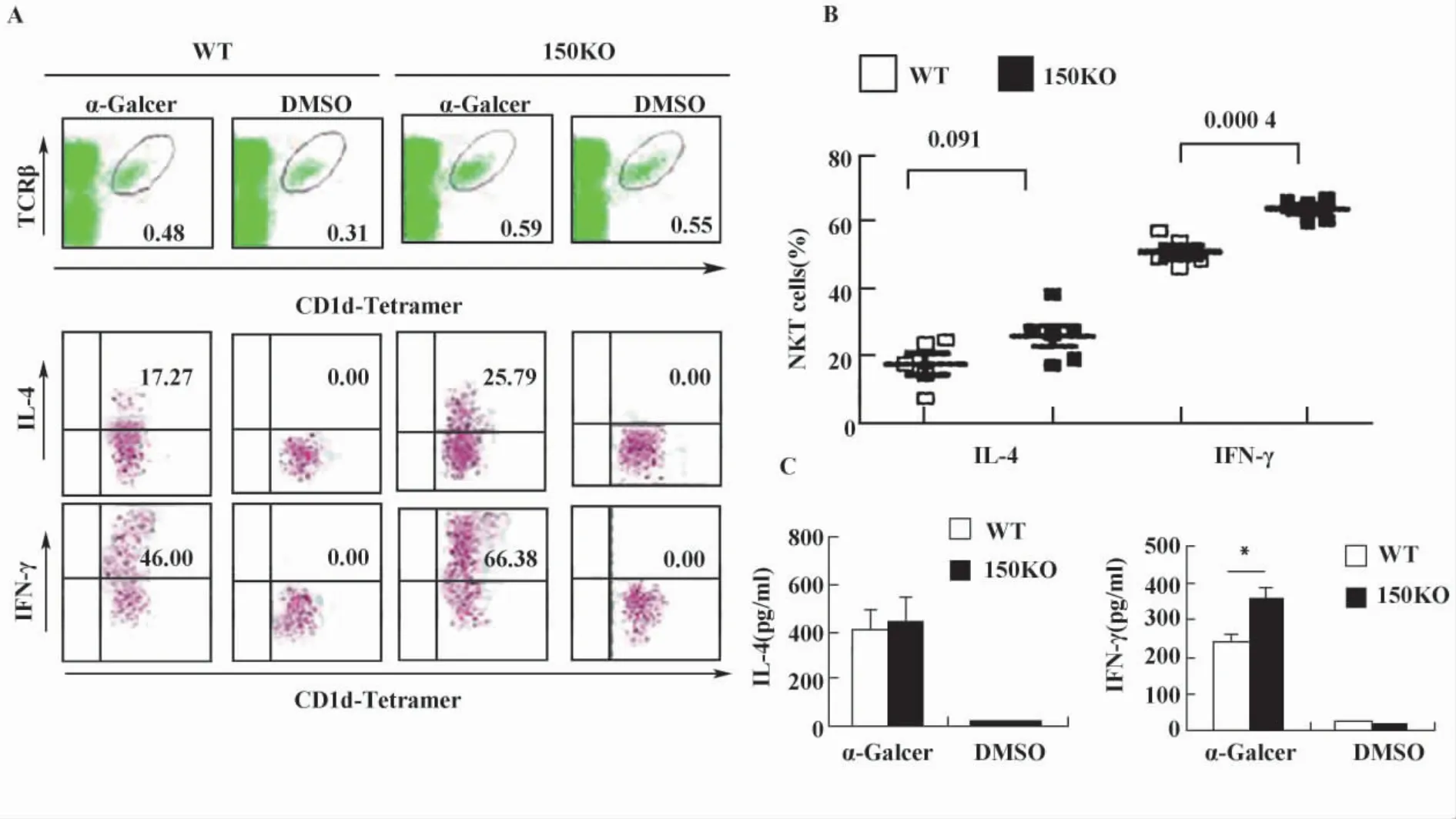
图2 miR-150KO小鼠NKT细胞IFN-γ产生增加Fig.2 Increased IFN-γ production in the α-Galcer activated NKT cells in miR-150 KO mice
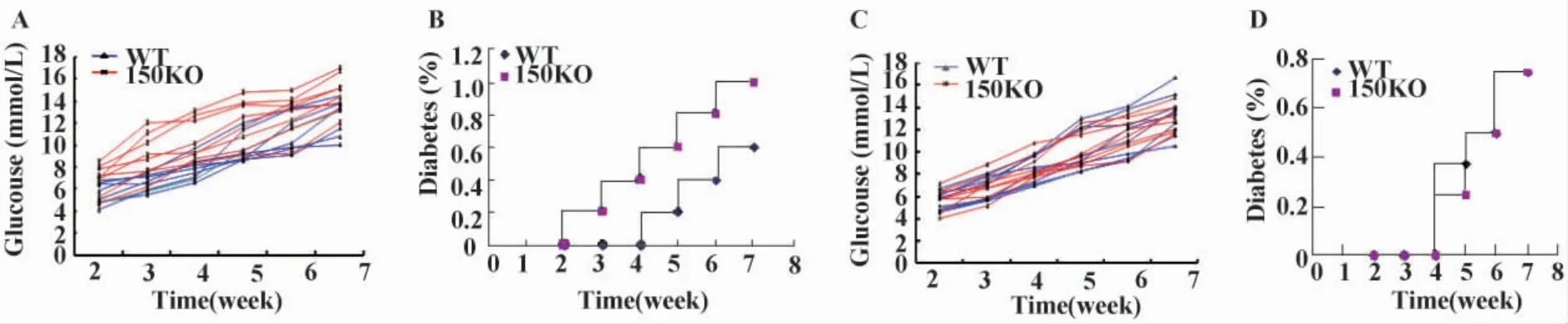
图3 miR-150敲除促进α-Galcer处理小鼠糖尿病的发生Fig.3 miR-150 deletion significantly accelerates the occurrence of diabetes in α-Galcer treated mice
2.2 miR-150KO小鼠NKT细胞IFN-γ产生增加分别给miR-150KO和WT小鼠注射NKT细胞特异激活剂α-Galcer,采用细胞内染色和ELISA检测脾脏NKT细胞和血清中IFN-γ和IL-4的产生和分泌。细胞内染色结果表明,α-Galcer体内刺激4小时后,与WT小鼠相比,miR-150KO小鼠IFN-γ和IL-4产生NKT细胞均有增加,其中IFN-γ产生NKT细胞的增加尤为显著(P<0.01,图2A、B)。与细胞内染色结果一致,ELISA结果显示,miR-150KO小鼠血清中IFN-γ的量显著增加(图2C)。
2.3 miR-150敲除促进α-Galcer处理小鼠糖尿病的发生 为观察miR-150敲除NKT细胞对胰岛素依赖性糖尿病发生和发展的影响,miR-150KO和WT小鼠分别注射STZ,制备Ⅰ型糖尿病小鼠模型,同时给予α-Galcer处理活化NKT细胞,试剂对照采用等量DMSO注射。结果发现,α-Galcer处理miR-150KO小鼠在STZ注射3周后出现糖尿病,发病率为12.5%,第5周时糖尿病的发病率达50%,至第7周时,所有miR-150KO小鼠均发生糖尿病。而α-Galcer处理WT小鼠在STZ注射4周时仍无糖尿病发生,到第5周时糖尿病发生率仅为12.5%,至第7周时,α-Galcer处理 WT小鼠糖尿病发生率为62.5%(图3A、B)。与α-Galcer处理组相比,DMSO处理组miR-150KO和WT小鼠糖尿病的发病时间及发病率没有显著性差异(图3C、D)。
3 讨论
NKT细胞是近年来新发现的一个保守的T细胞亚群,起源于胸腺CD4+CD8+双阳性T细胞。大部分NKT前体细胞在经历 CD44-NK1.1-,CD44+NK1.1-和 CD44+NK1.1+三个发育阶段后成为成熟NKT细胞,然后进入肝脏、脾脏、骨髓和淋巴结等外周免疫器官,其中,脾脏和肝脏NKT细胞的分布最为丰富。另外,在CD44+NK1.1-发育阶段,一部分非成熟NKT细胞离开胸腺直接进入外周免疫器官并进一步发育成熟[5]。我们以往的研究结果发现,miR-150缺失引起小鼠胸腺NKT细胞数量减少,细胞发育受阻于 CD44+NK1.1-阶段[6]。在此研究中,我们发现miR-150KO与对照WT小鼠相比,外周NKT细胞的数量并没有显著变化,提示miR-150KO小鼠可能有更多的CD44+NK1.1-发育阶段NKT细胞自胸腺进入外周发育。与Savage等研究结果一致[7],非成熟 CD44+NK1.1-NKT 细胞趋于进入淋巴结,与WT小鼠相比,miR-150KO小鼠淋巴结NKT细胞数量增加明显(图1C、D)。
NKT细胞的一个显著特征是在受到TCR信号刺激时,能在短时间内产生大量Th1和Th2型细胞因子,进而发挥强大的免疫调节功能。在此实验中,我们发现miR-150实际上有负向调控NKT细胞的功能,细胞内染色结果表明,TCR活化miR-150敲除小鼠NKT细胞IFN-γ产生显著增加,同时IL-4的产生也显示增加的趋势;ELISA结果显示,α-Galcer处理miR-150KO小鼠与相应处理WT小鼠相比,血清IFN-γ的量也显著增加,进一步证实miR-150主要负向调控NKT细胞IFN-γ的产生和分泌。不容否认的是,活化NKT细胞可能进一步通过调节其它细胞的细胞因子产生和分泌,从而间接改变血清中IL-4和IFN-γ的含量,如IFN-γ可进一步活化NK和Th1 细胞,从而产生更多的 IFN-γ[8]。
TCR活化NKT细胞既能通过其产生和分泌的Th1细胞因子如IFN-γ和TNF-α增强细胞介导的免疫应答,也能通过Th2细胞因子发挥免疫抑制细胞的作用。尽管多数研究表明,NKT细胞特异激活剂α-Galcer抑制多种自身免疫性疾病的发生和发展,但也有相反的报道[9,10]。链脲佐菌素(STZ)是诱导糖尿病动物模型的常用药物之一,多次、小剂量STZ注射通过逐步对胰岛β细胞产生损伤而最终导致Ⅰ型糖尿病,与临床Ⅰ型糖尿病的发病过程相似。在此研究中,我们发现与WT小鼠相比,miR-150敲除不但显著增强了小鼠NKT细胞IFN-γ的产生,而且加速了α-Galcer处理小鼠糖尿病的发生。研究表明,IFN-γ作为一种重要的免疫调节因子,单独或与其它细胞因子相互作用,在Ⅰ型糖尿病的发生、发展过程中发挥重要作用。文芳等[11]体外分离培养SD大鼠胰岛细胞,分别或共同加入IL-1β和IFN-γ处理,发现IFN-γ能显著抑制胰岛素分泌,促进胰岛细胞凋亡;Gysemans等[12]发现IFN-γ 与IL-1β 和TNF-α相互作用,通过活化JAK激酶-STAT1信号通路诱导胰岛 β 细胞凋亡;另外,McKenzie等[13]观察到IFN-γ激活细胞毒性T细胞(CTL),通过释放颗粒酶或Fas/FasL信号,促进胰岛β细胞凋亡,加速Ⅰ型糖尿病的发生。因此,在miR-150KO糖尿病小鼠模型中,α-Galcer处理加速小鼠糖尿病的发生与其IFN-γ产生和分泌增加密切相关。然而,miR-150如何调控NKT细胞IFN-γ的产生和分泌,以及在miR-150KO小鼠中,IFN-γ通过何种分子机制加速STZ处理小鼠糖尿病的发生或发展目前仍不清楚,有待进一步深入研究。
1 Bendelac A,Savage P B,Teyton L.The biology of NKT cells[J].Annu Rev Immunol,2007;25(1):297-236.
2 Subleski J J,Jiang Q,Weiss J M et al.The split personality of NKT cells in malignancy,autoimmune and allergic disorders[J].Immunotherapy,2011;3(10):1167-1184.
3 Winter J,Jung S,Keller S et al.Many roads to maturity:microRNA biogenesis pathways and their regulation[J].Nat Cell Biol,2009;11(3):228-234.
4 Zhou B,Wang S,Mayr C et al.miR-150,a microRNA expressed in mature B and T cells,blocks early B cell development when expressed prematurely[J].Proc Natl Acad Sci USA,2007;104(17):7080-7085.
5 Matsuda J L,Zhang Q,Ndonye R et al.T-bet concomitantly controls migration,survival,and effector functions during the development of Valpha14i NKT cells[J].Blood,2006;107(7):2797-2805.
6 Zheng Q,Zhou L,Mi Q S.MicroRNA miR-150 is involved in Vα14 invariant NKT cell development and function[J].J Immunol,2012;188(5):2118-2126.
7 Savage A K,Constantinides M G,Han J et al.The transcription factor PLZF directs the effector program of the NKT cell lineage[J].Immunity,2008;29(3):391-403.
8 Hazlett L D,Li Q,Liu J et al.NKT cells are critical to initiate an inflammatory response after Pseudomonas aeruginosa ocular infection in susceptible mice[J].J Immunol,2007;179(2):1138-1146.
9 Wallace K L,Marshall M A,Ramos S I et al.NKT cells mediate pulmonary inflammation and dysfunction in murine sickle cell disease through production of IFN-gamma and CXCR3 chemokines[J].Blood,2009;114(3):667-676.
10 Olson C M ,Bates T C,Izadi H et al.Local production of IFN-gamma by invariant NKT cells modulates acute Lyme carditis[J].J Immunol,2009;182(6):3728-3734.
11 文 芳,曹仁贤,马志敏 et al.IL-1β、IFN-γ对胰岛β细胞凋亡及胰岛素释放的影响[J].实用糖尿病杂志,2006;6(3):32-36.
12 Gysemans C,Callewaert H,Overbergh L et al.Cytokine signalling in the beta-cell:a dual role for IFNgamma[J].Biochem Soc Trans,2008;36(Pt 3):328-333.
13 McKenzie M D,Dudek N L,Mariana L et al.Perforin and Fas induced by IFNgamma and TNFalpha mediate beta cell death by OT-I CTL[J].Int Immunol,2006;18(6):837-846.