不同类型HBV感染者外周血Treg/Th17细胞的变化及意义
2013-11-28张丽君
王 萍 胥 冰 张丽君
(陕西中医学院免疫教研室,咸阳712046)
乙型肝炎是一种由乙型肝炎病毒(Hepatitis B virus,HBV)感染机体后所引起的疾病,严重危害我国人民身体健康。乙型肝炎特别是慢性乙型肝炎的发病机制十分复杂,近年来研究证实宿主免疫功能紊乱是其发病的重要原因,但确切机制尚未完全清楚[1]。Treg/Th17细胞是新近发现的具有特异细胞膜表面分子和核转录因子的两类细胞亚群[2,3],国内外研究表明Treg/Th17细胞在自身免疫性疾病、肿瘤及感染性疾病中发挥重要作用[4,5],有研究资料显示Treg/Th17细胞在HBV感染疾病中也发挥一定作用[6-9],但研究结果并不一致,且大多数研究只针对一种类型HBV感染的Treg或Th17细胞进行分析,缺乏同时对不同类型HBV感染类型Treg/Th17细胞的系统研究。为进一步研究Treg/Th17细胞在不同类型HBV感染中的作用,本研究拟通过对不同类型HBV感染者外周血Treg/Th17细胞、核转录因子及相关细胞因子的分析,初步探讨Treg/Th17细胞在HBV感染过程中的变化及其临床意义。
1 资料与方法
1.1 研究对象 入选2011年10月至2012年6月在陕西中医学院附属医院住院和门诊治疗的不同类型乙型肝炎患者95例,其中急性乙型肝炎(acute hepatitis B,AHB)患者15例、慢性乙型肝炎(chronic hepatitis B,CHB)患者40例、无症状携带者(asymptomatic HBV carriers,AsC)40例,其中男性59例,女性36例,年龄21~64岁,平均年龄(38.75±16.57)岁。所有病例诊断符合2000年中华医学会传染病与寄生虫学分会、肝病学分会联合修订的《病毒性肝炎防治方案》[10],所有病例均排除HAV、HCV、HDV、HEV等其他病毒性疾病、自身免疫性和药物及酒精性肝炎等,在进行采集样本前未进行抗病毒治疗和免疫调节治疗。另外选择同期健康体检者30例作为对照组,其中男性17例,女性13例,年龄20~62岁,平均年龄(36.87 ±15.37)岁,两组研究对象性别、年龄的比较差异均无统计学意义(P<0.05)。本研究得到我院伦理委员会批准并取得所有受试者的知情同意。
1.2 主要仪器和试剂 美国贝克曼公司生产的FACS Calibur流式细胞仪;美国Bio-Rad公司生产的荧光定量PCR扩增仪;芬兰 Thermo公司生产的DENLEY DRAGON Wellscan MK 3酶标仪;鼠抗人FITC-CD4、Alexa Fluor®647-IL-17、PE-Foxp3、PE 标记IgG同型对照、Alexa Fluor®647标记IgG同型对照购自美国 eBioscience公司;佛波酯、离子霉素(Ionomycin)购自Calbiochem公司;TRIzol液购自美国Invitrogen公司;cDNA第一链合成试剂盒购自立陶宛Fermentas公司;SYBR®Premix Ex TaqTMⅡ试剂购自TaKaRa生物科技有限公司;人 TGF-β1、IL-17 ELISA试剂盒购自美国R&D公司。
1.3 方法
1.3.1 Th17细胞检测 取外周血单个核细胞悬液250 μl,加入 PMA(50 ng/ml)、离子霉素(500 ng/ml)培养2小时后加入BD GolgiPlugTM蛋白转运抑制剂(1 μl/ml),混匀后37℃、5%CO2条件下孵育4 小时。加入20 μl FITC-CD4抗体,温和混匀,常温下避光孵育20分钟;依次加入2 ml预先准备的预冷(4℃)1×固定液、2 ml预先准备的温(37℃)1×破膜液,37℃避光孵育30分钟;加入20 μl Alexa Fluor®647-IL-17抗体,室温避光孵育20分钟,洗涤细胞后应用FACS Calibur型流式细胞仪检测,通过Cellquest软件进行收集分析数据。
1.3.2 CD4+Foxp3+Treg 细胞检测 在 250 μl外周血单个核细胞悬液中加入20 μl FITC-CD4抗体常温下避光孵育20分钟,加入Foxp3 buffer工作液孵育30分钟后加入20 μl PE-Foxp3,室温避光孵育20分钟,洗涤细胞后上流式细胞仪检测。
1.3.3 实时定量逆转录聚合酶链反应(RT-PCR)测定Foxp3/RORγt mRNA的表达 利用TRIzol液提取细胞总RNA,利用Fermentas试剂盒进行cDNA第一链合成,实验操作严格按照试剂盒说明书进行。参照 Genbank cDNA序列设计 Foxp3、RORγt及GAPDH引物,具体序列如下:Foxp3 5'-TTCCTTGAACCCCATGCCAC-3',5'-TGAAATGTGGCCTGTCCTGG-3',产物大小 131 bp;RORγt 5'-GAGCCAAGGCTCAGTCATGAGAA-3',5'-GTCCCTCTGCTTCTTGGACAT-3',产物大小289 bp;GAPDH 5'-GAGAAGGCTGGGGCTCATTT-3',5'-AGTGATGGCATGGACTGTGG-3',产物大小231 bp。用20 μl SYBR®Premix Ex TaqTMⅡ反应体系进行PCR扩增,扩增反应条件为:95℃ 30秒预变性,95℃ 5秒、60℃ 30秒40个循环。扩增结束后采用Bio-Rad iQ520 Standard Edition Optical System Software V2.0进行数据分析。
1.3.4 ELISA 检测血浆 TGF-β1、IL-17 水平 利用ELISA试剂盒检测TGF-β1、IL-17水平,实验操作严格按照试剂盒说明书进行,每个样本做3个复孔。
1.4 统计学分析 利用SPSS 16.0软件进行统计学处理,计量资料采用±s表示,两组比较采用t检验,多组比较采用单因素方差分析,当P值有统计学意义时再进行组间比较,以P<0.05认为差异有统计学意义。
2 结果
2.1 各组患者外周血CD4+Foxp3+Treg/Th17细胞百分率变化 流式细胞检测结果显示CHB组患者外周血CD4+Foxp3+Treg/CD4+T细胞百分率为(11.27 ±3.17)%,与正常对照组(8.95 ±2.87)%相比明显升高,差异有统计学意义(P<0.05);但AHB组、AsC组患者外周血CD4+Foxp3+Treg/CD4+T细胞百分率分别为(9.68±2.98)%、(10.25±2.98)%,与正常对照组相比无统计学意义(P >0.05),见图1A。与正常对照组(0.94±0.28)%相比,AHB组、CHB组患者外周血中CD4+IL-17+/CD4+T细胞百分率(1.34±0.36)%、(1.26±0.32)%显著升高,差异有统计学意义(P<0.05);而AsC组患者外周血中CD4+IL-17+/CD4+T细胞百分率为(1.07±0.31)%,与正常对照组相比无统计学意义(P>0.05),结果见图1B。
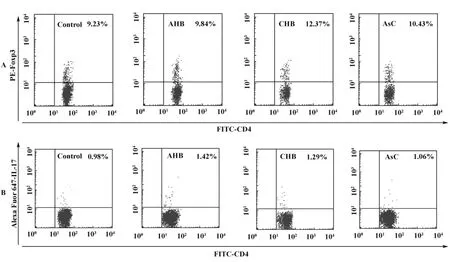
图1 各组患者外周血CD4+Foxp3+Treg/Th17细胞百分率变化Fig.1 The changes of the percentage of CD4+Foxp3+Treg/Th17 cells in the peripheral blood of different groups
2.2 各组患者Foxp3/RORγt mRNA表达水平比较Foxp3/RORγt是Treg/Th17细胞分化过程中关键的转录因子,本实验同时检测了各组患者外周血Foxp3/RORγt mRNA的表达水平,结果见图2。与正常对照组(0.42±0.11)相比,CHB组患者外周血Foxp3 mRNA 表达水平(0.56±0.21)明显升高,差异有统计学意义(P<0.05);但 AHB组(0.46±0.15)、AsC 组(0.48 ±0.17)患者外周血 Foxp3 mRNA表达水平与正常对照组相比无统计学意义(P>0.05)。AHB 组(0.57 ±0.23)、CHB 组(0.51 ±0.16)患者外周血中RORγt mRNA表达水平与正常对照组(0.39±0.12)相比显著升高,差异有统计学意义(P <0.05);而 AsC 组(0.43 ±0.11)患者外周血中RORγt mRNA表达水平与正常对照组相比无统计学意义(P >0.05)。
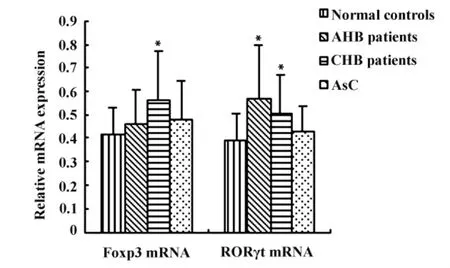
图2 各组患者Foxp3/RORγt mRNA表达水平比较Fig.2 The comparison of the mRNA expression of Foxp3/RORγt in different groups
2.3 各组患者血浆中 TGF-β1、IL-17水平变化CHB组患者外周血TGF-β1水平明显升高于正常对照组,差异有统计学意义(P<0.05);但AHB组、AsC组患者外周血TGF-β1水平与正常对照组相比无统计学意义(P>0.05),见表2。与正常对照组相比,AHB组、CHB组患者外周血中IL-17水平显著升高,差异有统计学意义(P<0.05);而AsC组患者外周血中IL-17水平与正常对照组相比无统计学意义(P >0.05),结果见表1。
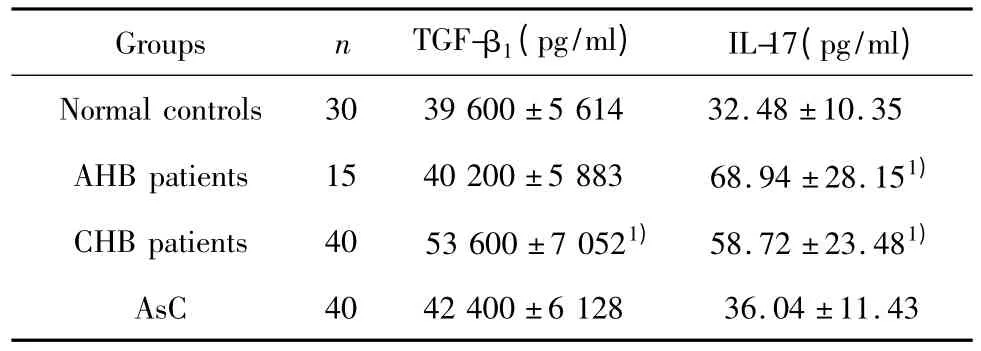
表1 各组患者血浆中TGF-β1、IL-17水平变化Tab.1 Changes of the plasma levels of TGF-β1/IL-17 in different groups
3 讨论
随着对乙型肝炎发病机制研究的不断深入,目前大多数学者认为乙型肝炎病毒造成的肝脏损伤及转归与机体细胞免疫功能及免疫耐受密切相关[1]。CD4+T淋巴细胞是机体免疫应答中的重要部分,在机体免疫调节中发挥关键作用,Treg/Th17细胞是新近发现的具有特异细胞膜表面分子和核转录因子的两类CD4+T细胞亚群,Foxp3是Treg细胞的特异性标志,而RORγt是Th17细胞分化过程中关键的转录激活因子[2,3]。动物实验和临床研究均发现在Ⅰ型糖尿病、实验性自身免疫性脑脊髓炎、多发性硬化症、银屑病和重症肌无力等自身免疫性疾病中Treg细胞数量减少,免疫抑制功能受损,而Th17细胞在类风湿性关节炎、多发性硬化症、炎性肠病、系统性红斑狼疮、原发性胆汁性肝硬化等自身免疫性疾病中数量增多[4,5]。
最近研究发现 Treg/Th17细胞在 HBV、HCV、HIV、巨细胞病毒等感染过程也发挥一定作用[11,12],国内外学者研究发现Treg/Th17细胞在HBV感染疾病中也发挥一定作用[6-9],但研究结果并不完全一致,可能与每个研究的病例选择、采样时间、Treg/Th17细胞检测分选手段不同及流式细胞仪检测灵敏度等因素有关。为了进一步研究Treg/Th17细胞在HBV发病中的具体作用,我们对不同类型HBV感染者外周血中Treg/Th17细胞、核转录因子及相关细胞因子进行了分析。研究证实Foxp3是Treg细胞的特异性标志,因此我们利用CD4+Foxp3+作为检测Treg细胞的标记;目前对Th17细胞的检测大多采用CD4+IL-17+标记,本实验也利用CD4+IL-17+作为检测Th17细胞的标记。本实验结果发现在不同类型 HBV感染中,CD4+Foxp3+Treg/Th17细胞数量发生不同变化。在AHB中,主要是Th17细胞明显增多,其转录因子RORγt mRNA及效应分子IL-17的水平也明显升高,这与国内外的研究结果一致[7,13,14],而 CD4+Foxp3+Treg/细胞、Foxp3 mRNA及TGF-β1水平无明显变化,但有研究结果显示AHB患者Treg细胞减少,这可能与采集样本的时间及流式细胞术标记方法不一致有关[15]。在HIV的研究中发现,病毒感染早期IL-17的水平及Th17细胞数量有所增加,提示Th17细胞可能在病毒感染急性期发挥作用[16]。而在 CHB患者体内 CD4+Foxp3+Treg//Th17细胞数量均升高,但以CD4+Foxp3+Treg细胞升高为主,这与国内外研究结果基本一致[6-8]。AsC患者虽然CD4+Foxp3+Treg细胞虽然与正常对照组相比没有统计学意义(P>0.05),但数量还是高于正常对照组,而Th17细胞数量与正常对照组相比没有统计学意义。研究证实在一定的条件特别是在不同细胞因子作用下,Treg细胞、Th17细胞之间可以相互转化保持机体的免疫平衡状态,不同类型HBV感染者体内Treg细胞、Th17细胞之间可能互相转化,进而发挥不同的作用。
综合目前国内外研究及我们的实验结果认为在AHB中Th17细胞发挥主导作用,Th17细胞在HBV感染的急性期可能发挥了促进炎症、引起病理损伤的效应,导致肝脏炎症和免疫损伤;在CHB中以Treg细胞升高为主,主要发挥免疫抑制作用,病毒无法清除,同时Th17细胞数量也增高,导致一定程度的免疫损伤;在AsC患者体内,Treg细胞在一定程度上增高,发挥了一定的免疫抑制作用,而Th17细胞数量无变化,此时病毒长期存在,但不表现肝细胞损伤。总之,Treg/Th17细胞在不同类型的HBV感染中可能发生转化,从而发挥不同的作用,但Treg/Th17细胞失衡的原因及其在HBV发病中的具体作用机制尚待进一步深入研究。
1 Liaw Y F,Chu C M.Hepatitis B virus infection[J].Lancet,2009;373(9663):582-592.
2 Gavin M A,Rasmussen J P,Fontenot J D et al.Foxp3-dependent programme of regulatory T-cell differentiation[J].Nature,2007;445(7129):771-775.
3 Crome S Q,Wang A Y,Kang C Y et al.The role of retinoic acid-related orphan receptor variant 2 and IL-17 in the development and function of human CD4+T cells[J].Eur J Immunol,2009;39(6):1480-1493.
4 Shevach E M.Biological functions of regulatory T cells[J].Adv Immunol,2011;112:137-176.
5 Wilke C M,Bishop K,Fox D et al.Deciphering the role of Th17 cells in human disease [J].Trends Immunol,2011;32(12):603-611.
6 Xue-Song L,Cheng-Zhong L,Ying Z et al.Changes of Treg and Th17 cells balance in the development of acute and chronic hepatitis B virus infection[J].BMC Gastroenterol,2012;12:43.
7 Wu W,Li J,Chen F et al.Circulating Th17 cells frequency is associated with the disease progression in HBV infected patients[J].J Gastroenterol Hepatol,2010;25(4):750-757.
8 Stross L,Günther J,Gasteiger G et al.Foxp3+regulatory T cells protect the liver from immune damage and compromise virus control during acute,experimental hepatitis B virus infection[J].Hepatology,2012;56(3):873-883.
9 巫翠萍,覃 西,王华民et al.慢性乙型肝炎患者外周血CD4+CD25+Treg与CD4+和CD8+T淋巴细胞亚群的相关研究[J].中国免疫学杂志,2010;26(3):273-277.
10 中华医学会传染病与寄生虫学会、肝病学分会.病毒性肝炎防治方案[J].中华内科杂志,2001;41(4):62-68.
11 Rouse B T,Sarangi P P,Suvas S.Regulatory T cells in virus infections[J].Immunol Rev,2006;212:272-286.
12 Hartigan-O'Connor D J,Hirao L A,McCune J M et al.Th17 cells and regulatory T cells in elite control over HIV and SIV[J].Curr Opin HIV AIDS,2011;6(3):221-227.
13 Zhang J Y,Zhang Z,Lin F et al.Interleukin-17-producing CD4(+)T cells increase with severity of liver damage in patients with chronic hepatitis B [J].Hepatology,2010;51(1):81-91.
14 朱华芳,王秀丽,张建琴.慢性乙型肝炎患者外周血Th17细胞检测及意义[J].山东医药,2010;50(51):81-82.
15 Xu D,Fu J,Jin L et al.Circulating and liver resident CD4+CD25+regulatory T cells actively influence the antiviral immune response and disease progression in patients with hepatitis B[J].J Immunol,2006;177(1):739-747.
16 Yue F Y,Merchant A,Kovacs C M et al.Virus-specific interleukin-17-producing CD4+T cells are detectable in early human immunodeficiency virus type 1 infection [J].J Virol,2008;82(13):6767-6771.