建立结核分枝杆菌抗原K6 IFN-γ ELISPOT用于结核病辅助诊断①
2013-11-28蒋丽气黄香玉陈红兵邵进士张春青何秀云
蒋丽气 黄香玉 陈红兵 李 静 何 珂 邵进士 张春青 何秀云
(西南大学生命科学学院,重庆400715)
虽然近几年结核病得到一定控制,但全球结核病疫情仍然十分严重。据WHO统计,全世界约有880万新增结核病患者[1]。WHO提出全球结核病控制目标为2050年发病率低于百万分之一,为了实现该目标,结核病疫苗、结核病诊断和治疗均需获得重大突破[2]。目前结核病诊断主要依据临床表现、影像学检查、实验室检测(血清结核抗体检测、分子生物学检测(PCR、核酸杂交)、细菌学检查(涂片抗酸染色、结核分枝杆菌培养、噬菌体、化学发光)等[3],这些方法有的敏感度低、有的检测周期长、有的需技术含量高[3,4]。我国规定结核分枝杆菌培养阳性为诊断金标准[3]。结核分枝杆菌培养需时太长、不能满足临床。血清抗体检测、结核菌素皮肤试验(TST)、涂片抗酸染色等均可做到快速检测,但WHO于2011年7月提出结核病血清抗体作为结核病诊断可能存在误诊(www.who.org)、TST特异度低、涂片抗酸染色敏感度低。
结核分枝杆菌致敏的T淋巴细胞,再次受到相关抗原刺激后能迅速活化增殖并释放γ-干扰素(IFN-γ)。IFN-γ 释放试验(Interferon gamma release assay,IGRA)是目前特异度高、快速、且可取代TST试验最有效方法,IGRA包括酶联免疫斑点法(ELISPOT)或酶联免疫吸附剂测定法(ELISA)。澳大利亚生产的QFT试剂盒(ELISA)和英国生产的TSPOT.TB试剂盒(ELISPOT)已批准用于临床检测结核分枝杆菌感染。QFT试剂盒刺激抗原有3个,即6 kD早期分泌抗原靶(ESAT-6)、培养滤过蛋白10(CFP-10)和RD11区TB7.7,3个抗原加入同一管共同刺激[4]。T-SPOT.TB试剂盒刺激抗原为抗原A(ESAT-6多肽)和抗原B(CFP-10多肽),抗原A 和抗原 B 单独刺激[2,4,5]。国外生产试剂盒在中国销售价格昂贵,为了降低检测费用,国内多家科研单位或(和)生物公司进行结核IGRA试剂盒研发。从去年开始,我国研制的结核IGRA检测试剂盒陆续获得国家食品药品监督管理局批准的注册证书。因此,IGRA用于结核病细胞免疫学诊断逐渐得到重视和认可。但是,国内外获批准的结核IGRA试剂盒所用刺激抗原均包含ESAT-6和 CFP-10抗原或其多肽、且不能区分活动性结核病和结核分枝杆菌潜伏感染。因此筛选新刺激抗原,研制具有自主知识产权的结核IGRA试剂盒用于活动性结核病诊断具有重要意义。
基因工程技术获得了一种结核分枝杆菌融合蛋白(K6),前期研究发现K6与佐剂联合免疫小鼠可产生较高水平IFN-γ,本文建立K6作为刺激原的IFN-γ ELISPOT检测方法,并初步评价该方法用于结核病辅助诊断价值。
1 材料与方法
1.1 材料
1.1.1 仪器设备 BSC-1360 A2二级生物安全柜(北京东联哈尔仪器制造有限公司),CO2培养箱(日本三洋),台式低速离心机(L-530,湖南湘仪离心机有限公司),荧光显微镜(Olympus cx31,日本),酶联免疫斑点读板仪[Cellular Technology Limited(CTL),美国]。
1.1.2 试剂 结核感染T细胞斑点检测试剂盒[TSPOT.TB(Oxford Immunotec,UK)]购自上海复星长征医学科学有限公司,RPMI1640培养液(Thermo)购自北京索莱宝科技有限公司,结核分枝杆菌重组融合抗原K6(本室研制),人全血淋巴细胞分离液购自天津市灏洋生物制品科技有限责任公司,AIM培养基购自上海复星长征医学科学有限公司。
1.2 方法
1.2.1 对象 解放军第三O九医院结核病研究所2012年3~6月新入院且临床最终确诊的结核病患者85例,其中单一肺结核病患者29例、肺结核病合并其它部位结核病患者43例、肺外结核病患13例。男59例、女26例,平均年龄36.6岁(11~79岁)。56例非结核性肺部相关疾病(肺炎和肺癌)患者来自解放军第三O九医院呼吸科和肿瘤科,男35例、女21例,平均年龄58.3岁(20~89岁)。肺结核病诊断标准:(1)典型肺结核临床症状和胸部X射线表现;(2)痰或支气管灌洗液涂片抗酸染色阳性;(3)痰或支气管灌洗液结核分枝杆菌培养阳性;(4)痰结核分枝杆菌PCR阳性;(5)PPD(5 TU)强阳性,血清抗结核抗体阳性;(6)临床可排除其它非结核性肺部疾患;(7)抗结核治疗有效。符合(1)和(7)及(2)~(6)中至少2项者诊断为肺结核。肺外结核和肺炎为临床综合诊断,肺癌经病理确诊。
1.2.2 外周血单个核细胞分离 新入院结核病患者(抗结核药物治疗前)和非结核性肺部相关疾病患者静脉抽取4 ml外周血于肝素锂抗凝管中,外周血与等体积无菌生理盐水上下颠倒混匀,无菌吸管吸取上述稀释外周血缓慢加入到与外周血等体积的人单个核细胞分离液上面,1 700 r/min常温离心20分钟;用无菌吸管吸起环状乳白色PBMC层,10 ml RPMI1640培养基洗涤两次,2 000 r/min离心10分钟;0.5 ml AIM悬浮细胞沉淀,取10 μl细胞稀释50倍,台盼蓝染色,计数,细胞活率均在90%以上,调整细胞浓度2.5×106个/ml。
1.2.3 ELISPOT检测分泌IFN-γ的斑点形成细胞数(Spot forming cells,SFC) 按T-SPOT.TB试剂盒说明书稍加改进。具体为:依次加入50 μl AIM(阴性对照)、阳性质控、抗原A、B和1~4个不同浓度抗原K6(根据细胞数)于对应的检测孔,每孔加入100 μl细胞悬液,于 5%CO2、37℃ 孵育过夜(20 ~24小时)。取出微孔板弃去细胞悬液,每孔加200 μl PBS(0.22 μm过滤)洗板至少6次,每孔依次加入50 μl碱性磷酸酶标记抗体,4℃孵育60分钟;弃去酶溶液,同上洗板至少6次,每孔加入50 μl BCIP/NBT底物溶液,室温放置7分钟,蒸馏水洗涤各孔,将微孔板置通风处避光干燥。酶联免疫斑点读板仪自动检测SFC数。当阳性质控孔中SFC遍布整个反应孔为有效,阴性对照孔SFC数为0~5个时且(抗原A、B或K6孔的SFC数)-(阴性对照孔SFC数)≥6或阴性对照孔SFC数≥6时且(抗原A、B或K6孔的SFC数)≥2×(阴性对照孔SFC数)为相应抗原刺激反应阳性;反之判为阴性。若阳性质控孔SFC数量小于20,则判定试验无效。
1.3 结果分析 SPSS17.0统计软件进行统计学分析,敏感度和特异度采用卡方(χ2)检验,SFC数量平均值比较采用一元方差分析,抗原K6、抗原A和抗原B诊断一致性采用非参数Kappa检验,抗原K6、抗原A和抗原B刺激PBMC分泌IFN-γ的SFC数量相关分析采用Bivariate Correlations;P<0.05为差异有统计学意义。GraphPad Prim 5软件绘制散点图。
2 结果
2.1 抗原K6 IFN-γ ELISPOT用于结核病辅助诊断
2.1.1 统计病例 新入院高度怀疑结核病的患者纳入,出院时临床明确诊断不是结核病病例剔除。肺癌为病理确诊、肺炎为临床诊断,两类患者均未进行结核分枝杆菌感染筛查。因为采用进口结核病临床诊断试剂盒、一份标本同时进行自研制抗原K6与试剂盒抗原A和抗原B比较;另一方面,针对新入结核病患者是排除不同化疗或免疫治疗对IFN-γ ELISPOT检测的影响。结核分枝杆菌培养阳性较低,获得具有统计意义的培阳肺结核需要基数大,试剂盒价格昂贵。基于以上考虑,结核病患者未按金标准选择病例、而是综合诊断。统计时只分为结核病组(包括肺结核患者29例、肺结核合并其它肺外结核43例和肺外结核13例)和非结核性肺部相关疾病组(肺癌17例、肺炎39例)。
2.1.2 抗原K6刺激PBMC分泌IFN-γ 预试验比较了2.5、5、10和20 μg/ml K6对 SFC数量和敏感度影响,2.5 μg/ml抗原获得SFC数量与其它3个浓度抗原刺激SFC比较,差异无统计学意义(P>0.05,图1);但敏感度显著低于5 μg/ml(71.9%vs 87.7%,χ2=3.7,P <0.05)。5 μg/ml与 10 μg/ml和20 μg/ml比较,SFC数量和敏感度均无统计学差异(P>0.05),因此确定抗原 K6刺激浓度为5 μg/ml。
2.1.3 抗原K6诊断敏感度和特异度 抗原K6诊断敏感度为80.0%(68/85)。T-SPOT.TB试剂盒敏感度是抗原A或抗原B诊断阳性(抗原A/B敏感度),抗原A/B诊断敏感度为85.9%(73/85,表1);抗原K6与抗原A/B敏感度比较差异无统计学意义(χ2=1.04,P=0.31)。抗原A和抗原B敏感度分别为78.8%(67/85)和72.9%(62/85),两者比较差异无统计学意义(χ2=0.88,P=0.35)。抗原K6特异度为83.9%(47/56),抗原 A/B特异度为73.2%(41/56,表2)。抗原K6与抗原A/B特异度比较差异无统计学意义(χ2=1.93,P=0.17)。抗原A和抗原B特异度分别为82.1%(46/56)和73.2%(41/56),两者比较差异无统计学意义(χ2=1.29,P=0.26)。
抗原K6、抗原A/B作为刺激原的IFN-γ ELISPOT诊断结核病的阳性预示值分别为88.3%(68/77)和82.9%(73/88),阴性预示值分别为73.4%(47/64)和77.3%(41/53)。
2.1.4 抗原K6与T-SPOT.TB诊断相关性分析结核病组,抗原K6与抗原 A诊断一致性较高(94.2%,Kappa=0.82),与抗原A/B诊断一致性较高(91.7%,Kappa=0.711),但与抗原B诊断一致性较低(81.4%,Kappa=0.481)。非结核性肺部相关疾病组,抗原 K6与抗原 A诊断一致性较高(96.4%,Kappa=0.867),与抗原A/B诊断一致性较高(89.3%,Kappa=0.682),而与抗原B诊断一致性稍低(85.7%,Kappa=0.593)。
2.2 抗原K6刺激PBMC分泌IFN-γ的SFC数量
结核病组,20个患者PBMC经抗原B刺激分泌IFN-γ的SFC数量超过100个,而只有7个患者PBMC经抗原A或抗原K6刺激分泌IFN-γ的SFC数量超过100个(图2)。同一抗原刺激PBMC分泌IFN-γ的SFC数量,结核病组普遍高于非结核性肺部相关疾病组(图2)。
结核病组,抗原 B刺激 PBMC分泌 IFN-γ的SFC数量(平均为77个)分别高于抗原A和抗原K6刺激PBMC分泌IFN-γ的SFC数量(平均为46个和43个),差异有统计学意义(P=0.011和P=0.004);抗原A和抗原K6刺激PBMC分泌 IFN-γ的SFC数量比较,差异无统计学意义(P=0.732)。非结核性肺部相关疾病组,抗原B刺激PBMC分泌IFN-γ的SFC数量(平均为9个)分别与抗原A和抗原K6刺激PBMC分泌IFN-γ的SFC数量(平均数为14个和13个)比较,差异无统计学意义(P=0.592和P=0.609);抗原A和抗原K6刺激PBMC分泌IFN-γ的SFC数量比较,差异无统计学意义
(P=0.983)。
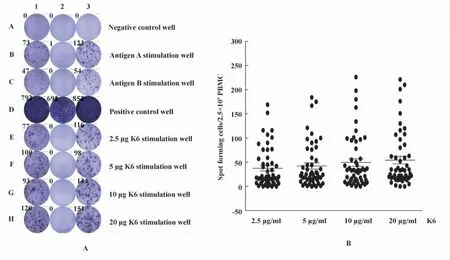
图1 ELISPOT检测特异抗原刺激PBMC分泌IFN-γ的SFCFig.1 Spot forming cells secreting IFN-γ of peripheral blood mononuclear cell stimulated by specific antigen
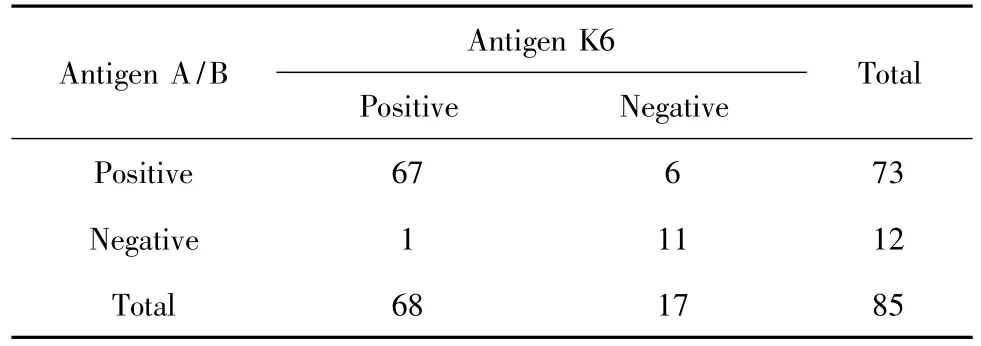
表1 结核病患者IFN-γ ELISPOT检测结果Tab.1 The results of IFN-γ ELISPOT for tuberculosis patients
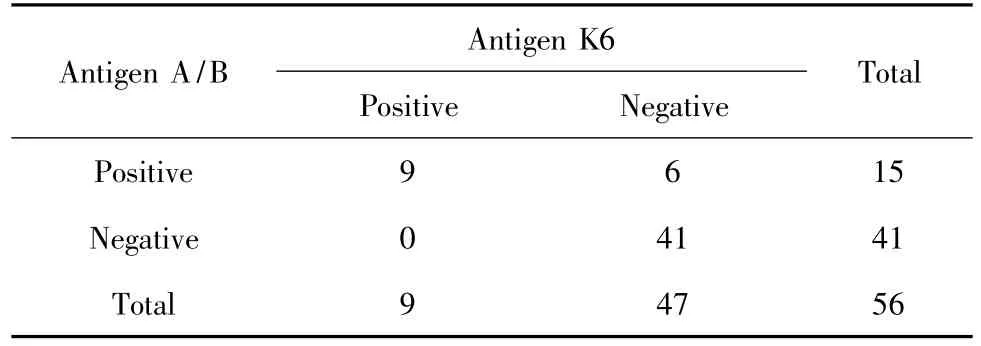
表2 非结核肺部相关疾病患者ELISPOT检测结果Tab.2 The results of IFN-γ ELISPOT for nontuberculous pulmonary disease
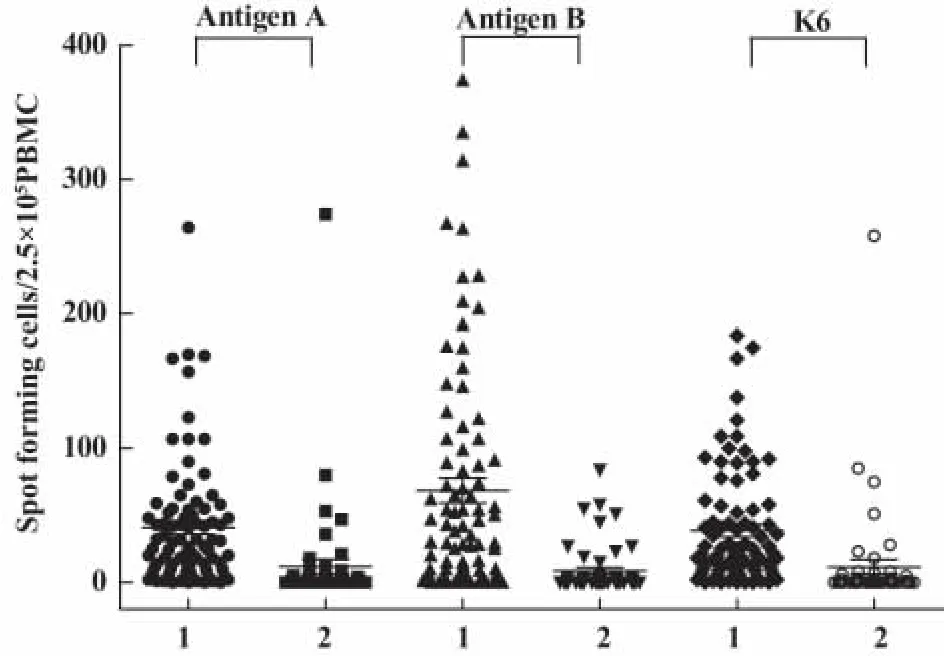
图2 不同抗原刺激分泌IFN-γ的SFC数量散点图Fig.2 Scatter plots of spot forming cells secreting IFN-γ stimulated by specific antigen of Mycobacterium tuberculosis
结核组,抗原K6和抗原A刺激PBMC分泌IFN-γ的SFC数量呈正相关(r=0.856,P=0.000),抗原K6和抗原B刺激PBMC分泌IFN-γ的SFC数量呈正相关(r=0.234,P=0.024),抗原A和抗原B刺激PBMC分泌IFN-γ的SFC数量呈正相关(r=0.304,P=0.003)。非结核性肺部相关疾病组,抗原K6和抗原A刺激PBMC分泌IFN-γ的SFC数量呈正相关(r=0.982,P=0.000),抗原K6和抗原B刺激PBMC分泌IFN-γ的SFC数量呈正相关(r=0.611,P=0.000),抗原A和抗原B刺激PBMC分泌IFN-γ的SFC数量呈正相关(r=0.586,P=0.000)。
3 讨论
IGA是目前公认用于结核分枝杆菌感染筛查优于TST的一种细胞学诊断方法。本文采用T-SPOT.TB试剂盒中预包被板和显色试剂及自研制的抗原K6作为刺激原建立IFN-γ ELISPOT,该方法用于新入院结核病患者诊断敏感度和特异度分别为80.0%和 83.9%,与 T-SPOT.TB诊断敏感度(85.9%)和特异度(73.2%)相当;也与文献报道TSPOT.TB与自研制RD1区抗原ELISPOT诊断初治肺结核敏感度(分别为89.7%和79.3%)相当,肺结核化疗未影响T-SPOT.TB诊断敏感度(87.5%),但显著降低自研制RD1区抗原ELISPOT诊断敏感度(25%)[6]。K6 刺激PBMC分泌IFN-γ是否受化疗影响需进一步验证。结核IGA还可用于肺外结核辅助诊断,如结核性胸膜炎、骨结核等[7,8];同时还可用于结核病疫苗评价[9,10]。K6 抗原 IFN-γ ELISPOT也可用于肺外结核诊断,但本研究纳入的肺外结核病例较少,因此与肺结核合并进行统计学分析。
T-SPOT.TB与QFT-IT检测一般采用外周血,但也可采用感染部位细胞。结核性胸膜炎患者,外周血和胸水QFT-IT诊断敏感度和特异度均相当[7]。另报道结核性胸膜炎患者胸水单核细胞ELISPOT检测获得满意结果,敏感度达到92.5%、特异度为80.0%[11]。但是除了胸水、脑积液等,其他感染部位单核细胞很难获得,因此,外周血是结核IGA检测最主要的标本来源。
结核IGA和TST均反映机体细胞免疫状态,研究发现HIV、系统红斑狼疮(SLE)等原因引起机体免疫功能降低到一定限度才影响结核IGA检测。结核病合并HIV感染不影响结核IGA检测,因为TSPOT.TB分别用于HIV感染者和HIV非感染者检测结核分枝杆菌感染诊断,其一致性很高[12]。但HIV感染者CD4数量小于200时,T-SPOT.TB和QFT-IT检测结核分枝杆菌感染敏感度低于5%;但当HIV感染者CD4数量大于200时,T-SPOT.TB和QFT-IT检测敏感度恢复正常,分别为10.9%和9.1%;此时TST检测敏感度为16.4%[13]。TST反映大于10 mm的SLE患者,TST与QFT-IT诊断一致性很高[14]。
T-SPOT.TB和QFT-IT均不能区分活动性结核病与结核分枝杆菌感染,研制诊断活动性结核病的试剂盒显得十分必要。一方面筛选新刺激抗原、一方面寻找新细胞因子标识[15]。研究发现Rv1985c可区分结核病患者、结核分枝杆菌潜伏感染者同BCG接种者,Rv1985c与ESAT-6、CFP-10联合可提高诊断敏感度、不降低特异度[16,17]。Rv2629、Rv1009和 Rv2389c是IFN-γ分泌的强免疫刺激原,而Rv0574c、Rv2630、Rv1998 和 Rv054c是 IL-8、IL-6和IL-17分泌的强免疫刺激原[18]。比较ESAT-6、CFP10、Rv2031c、Rv2654c和 Rv1038c的重叠肽体外刺激效果发现CFP10最好,其次是ESAT-6、Rv2031c和 Rv1038c 居中,Rv2654c 无刺激活性[19]。IFN-γ ELISA 表明 Rv0867c、Rv2389c、Rv2450c、Rv1009 和Rv1884c 可诊断活动性结核病[20]。IFN-γ ELISPOT表明Rv3873、Rv3878和Rv3879c可用于潜伏感染向活动性结核进展的检测[21]。肺结核患者支气管灌洗液分泌Rv2628特异的IFN-γ CD4+T细胞显著高于PBMC,但其反应强度低于RD1抗原[22]。ESAT-6的三个肽刺激效果好于CFP-10的C14多肽(52~65氨基酸)[23]。我们结果表明 K6刺激 PBMC分泌IFN-γ的强度低于抗原B(CFP-10多肽)、与抗原A相当,但三种抗原诊断敏感度比较差异无统计学意义。
抗原K6可作为IFN-γ ELISPOT候选抗原之一,将进一步评价抗原K6区分活动性结核与结核分枝杆菌潜伏感染、结核分枝杆菌感染与BCG接种的应用价值。
1 孙 勇,洪 峰,许绍发et al.结核分枝杆菌thy A基因突变与对氨基酸水杨酸钠耐药关系的研究[J].中国防痨杂志,2012;34(6):350-353.
2 Lienhardt C,Glaziou P,Uplekar M et al.Global tuberculosis control:lessons learnt and future prospects[J].Nat Rev Microbiol,2012;10(6):407-416.
3 中华医学会结核分学会.肺结核诊断和治疗指南[J].中华结核和呼吸杂志,2001;24(2):70-74.
4 Santín Cerezales M,Benítez J D.Diagnosis of tuberculosis infection using interferon-γ-based assays[J].Enferm Infecc Microbiol Clin,2011;29(Suppl 1):26-33.
5 Abramo C,Meijgaarden K E,Garcia D et al.Monokine induced by interferon gamma and IFN-γ response to a fusion protein of Mycobacterium tuberculosis ESAT-6 and CFP-10 in Brazilian tuberculosis patients[J].Microbes Infect,2006;8(1):45-51.
6 Latorre I,Altet N,de Souza-Galvaõ M et al.Specific Mycobacterium tuberculosis T cell responses to RD1-selected peptides for the monitoring of anti-tuberculosis therapy[J].Scand J Infect Dis,2012;44(3):161-167.
7 Losi M,Bocchino M,Matarese A et al.Role of the quantiferon-TB test in ruling out pleural tuberculosis:a multi-centre study[J].Int J Immunopathol Pharmacol,2011;24(1):159-165.
8 Cho O H,Park S J,Park K H et al.Diagnostic usefulness of a T-cell-based assay for osteoarticular tuberculosis[J].J Infect,2010;61(3):228-234.
9 王 鹏,徐 苗,陈保文et al.结核复合抗原疫苗不同抗原组合对小鼠免疫功能的影响[J].中华结核和呼吸杂志,2011;34(4):269-273.
10 Scriba T J,Tameris M,Mansoor N et al.Dose-finding study of the novel tuberculosis vaccine,MVA85A,in healthy BCG-vaccinated infants[J].J Infect Dis,2011;203(12):1832-1843.
11 杜凤娇,戈启萍,韦攀健et al.酶联免疫斑点术和流式细胞术检测γ干扰素对结核性胸膜炎的辅助诊断价值[J].中华检验医学杂志,2011;34(7):617-622.
12 Zhang M,Wang H,Liao M et al.Diagnosis of latent tuberculosis infection in bacille Calmette-Guérin vaccinated subjects in China by interferon-gamma ELISpot assay[J].Int J Tuberc Lung Dis,2010;14(12):1556-1563.
13 Latorre I,Martínez-Lacasa X,Font R et al.IFN-γ response on T-cell based assays in HIV-infected patients for detection of tuberculosis infection[J].BMC Infect Dis,2010;10(10):348-354.
14 Yilmaz N,Zehra Aydin S,Inanc N et al.Comparison of QuantiFERON-TB Gold test and tuberculin skin test for the identification of latent Mycobacterium tuberculosis infection in lupus patients[J].Lupus,2012;21(5):491-495.
15 Kellar K L,Gehrke J,Weis S E et al.Multiple cytokines are released when blood from patients with tuberculosis is stimulated with Mycobacterium tuberculosis antigens[J].PLoS One,2011;6(11):e26545.
16 Chen J,Wang S,Zhang Y et al.Rv1985c,a promising novel antigen for diagnosis of tuberculosis infection from BCG-vaccinated controls[J].BMC Infect Dis,2010;17(10):273-282.
17 Wang S,Chen J,Zhang Y et al.Mycobacterium tuberculosis RD2 and RD11 antigens Rv1985c and Rv3425 have the promising potential to distinguish active tuberculosis patients from BCG vaccinated individuals[J].Clin Vaccine Immunol,2013;20(1):69-76.
18 Kassa D,Ran L,Geberemeskel W et al.Analysis of immune responses against a wide range of Mycobacterium tuberculosis antigens in active pulmonary tuberculosis patients[J].Clin Vaccine Immunol,2012;19(12):1907-1915.
19 Arlehamn C S,Sidney J,Henderson R et al.Dissecting mechanisms of immunodominance to the common tuberculosis antigens ESAT-6,CFP10,Rv2031c(hspX),Rv2654c(TB7.7),and Rv1038c(EsxJ)[J].J Immunol,2012;188(10):5020-5031.
20 Chegou N N,Black G F,Loxton A G et al.Potential of novel Mycobacterium tuberculosis infection phase-dependent antigens in the diagnosis of TB disease in a high burden setting[J].BMC Infect Dis,2012;doi:10.1186/1471-2334-12-10.
21 Dosanjh D P,Bakir M,Millington K A et al.Novel M tuberculosis antigen-specific T-cells are early markers of infection and disease progression[J].PLoS One,2011;6(12):e28754.
22 Chiacchio T,Petruccioli E,Vanini V et al.Higher frequency of T-cell response to M.tuberculosis latency antigen Rv2628 at the site of active tuberculosis disease than in peripheral blood[J].PLoS One,2011;6(11):e27539.
23 Yang F F,Tu Z Q,Fang Y M et al.Monitoring of peptide-specific and gamma interferon-productive T cells in patients with active and convalescent tuberculosis using an enzyme-linked immunosorbent spot assay[J].Clin Vaccine Immunol,2012;19(3):401-410.
