DEN2对鼠源性 DC TLR7、MyD88、NF-κB的表达与细胞因子分泌的影响①
2013-11-28张海燕
曾 雯 左 丽 尹 科 张海燕
(贵阳医学院免疫学教研室,贵阳550004)
登革病毒(Dengue virus,DEN)主要由埃及伊蚊及白纹伊蚊传播,其感染已成为全球性重要的公共卫生问题,其中以登革2型病毒(Dengue virus type 2,DEN2)感染最为常见和严重[1]。目前认为登革病毒的致病机制主要与机体的免疫功能和病毒毒力有关,由此提出的发病机制包括抗体依赖的增强作用、细胞免疫和细胞因子的作用等,但仍未完全阐明。DEN为被覆包膜的单股、正链RNA病毒,基因组全长约11 kb,可编码3种结构蛋白(C、M、E)和7种非结构蛋白(NS1、NS2a、NS2b、NS3、NS4a、NS4b、NS5)。其中NS5蛋白是病毒基因组编码的最大的蛋白,分子量104×103。近年来的研究表明,NS5蛋白具有RNA依赖的RNA聚合酶(RdRP)功能,即可以识别具有相对特异性的模板RNA并与之结合,合成与模板互补的RNA链,在病毒基因组复制过程中起关键作用,NS5可以成为阻断或抑制病毒复制的靶标。树突状细胞(Dendritic cells,DCs)具有强大的捕获、加工、递呈抗原的能力,在对病原微生物的监测与应答中发挥着至关重要的作用,通过表达的Toll样受体(Toll like receptors,TLRs)胞外区参与病原体相关分子模式(Pathogen-associated molecular pattern,PAMP)的识别[2],诱导初始 T 细胞活化和增殖,胞内段的髓样分化因子88(Myeloid differentiation primary response protein 88,MyD88)作为重要的转接蛋白参与细胞内信号传递,导致炎症介质的释放,在固有免疫及适应性免疫中发挥重要作用[3,4],因此认为TLR是连接固有免疫与适应性免疫的桥梁[5]。不同的TLR利用不同或相同的接头蛋白向下转导信号,其中与病毒识别相关的TLRs(TLR3、TLR7/8、TLR9),只有TLR3介导的是TRIF依赖型信号通路,而TLR7/8、TLR9介导的是MyD88依赖型信号通路。TLR与相应配体结合后在MyD88依赖方式中会产生核内因子κB(Nucleus factor kappa B,NF-κB)依赖细胞因子,IFN-γ诱导蛋白10(Gamma interferon inducible protein 10,IP-10)可诱导IL-12的聚集而使Th0向Th1方向极化[6],进而发挥相应作用。此外,还可产生IFN-α直接干扰病毒的复制,或活化NK细胞及CD8+T细胞从而在抗病毒感染中发挥作用。
本研究利用DEN2感染小鼠BMDC后,通过检测树突状细胞中TLR7、MyD88、NF-κB的表达变化,观察IFN-α、IP-10的分泌动态,探讨 DEN对 TLR7-MyD88依赖型信号通路的影响,及其该信号通路介导IFN-α、IP-10的分泌对被感染 BMDC内 DEN2 NS5核酸水平的影响,以期探讨MyD88依赖型信号通路在DEN2感染中的作用。
1 材料与方法
1.1 实验动物及病毒株 6~8周龄C57BL/6小鼠,雌雄随机,体重(16±2)g,购于重庆腾鑫比尔有限公司,许可证号:SCXK(渝)2007-0003编号:000031。登革2型病毒NGC株(DEN2 NGC株):购于中国预防科学院流行病研究所,本室常规液氮保存。
1.2 主要试剂 重组小鼠白细胞介素4(rmIL-4)、重组小鼠粒细胞-巨噬细胞集落刺激因子(rmGMCSF)均购自美国Peprotech公司。RPMI1640培养基、H-DMEM培养液、青链霉素购自美国Hyclone公司。流式抗体 Hamster Anti-mouse CD11c APC(IgG1)、Rat Anti-mouse I-A/I-E FITC(IgG2a)、Rat Anti-mouse CD86 PE(IgG2a)均购自美国BD公司。Western blot抗体 Rabbit polyclonal anti-TLR7、Rabbit polyclonal anti-MyD88、Rabbit polyclonal anti-NF-κB p65、Rabbit polyclonal anti-GAPDH均购自美国 Abcam公司。TRIzol、M-MLV逆转录试剂盒、PCR试剂均购自美国Invitrogen公司。IP-10、IFN-α ELISA检测试剂盒均购自美国eBioscience公司。DEN2 NS5基因区(上游5'-ACAAGTCGAACAACCTGGTCCAT-3',下游 5'-GCCGCACCATTGGTCTTCTC-3')及 GAPDH(上游 5'-CATCACTGCCACCCAGAAGA-3',下游5'-TGAAGTCGCAGGAGACAACC-3')引物由上海捷瑞生物有限公司合成。FITC标记兔抗DEN2 E蛋白抗体购自上海亿欣公司。
1.3 方法
1.3.1 C57BL/6小鼠 BMDC的制备 6~8周龄C57BL/6小鼠,雌雄随机,颈椎脱臼处死,75%酒精浸泡消毒,无菌取股骨、胫骨,注射器冲出骨髓细胞,1 000 r/min,5分钟,弃上清,加入红细胞裂解液室温作用2~3分钟,D-Hanks洗涤2次,用含10%胎牛血清、100 U 双抗、10 ng/ml rmGM-CSF、1 ng/ml rmIL-4的RPMI1640培养液配成1×106ml-1细胞悬液,2 ml/孔接种于12孔板,37℃ 5%CO2培养2~3天,弃非贴壁细胞,全量换液后继续培养[7],培养5天收集细胞,流式细胞术检测其纯度及成熟情况。
1.3.2 DEN2 吸附鼠源性 BMDC 10-5.8TCID50 的DEN2 100 μl感染1.1 ×106个 C57BL/6 小鼠髓源性DC,感染MOI=0.4,37℃孵育4 小时,D-Hanks洗涤2次,补充含10%胎牛血清、100 U双抗、10 ng/ml rmGM-CSF,1 ng/ml rmIL-4的RPMI1640培养液培养24小时;取DEN2感染组及正常组BMDC,37℃甲醛熏蒸30分钟固定于载玻片上,PBS洗涤3次,10 μl兔血清封闭30分钟,PBS洗涤同前,滴加FITC标记抗DEN2抗体(1∶100稀释;含0.02%伊文斯蓝),37℃避光 1小时,PBS洗涤3~5次,荧光显微镜观察。
1.3.3 Western blot动态检测 DEN2感染鼠源性BMDC 后 TLR7、MyD88、NF-κB、GAPDH 蛋白的变化DEN2(MOI=0.4)感染鼠源性 BMDC,同时设正常对照,于感染后24、48、72小时收集细胞,TRIzol法提取细胞总蛋白,Western blot动态检测感染组及正常对照组 TLR7、MyD88、NF-κB、GAPDH 蛋白的变化。利用BCA法进行蛋白定量,分别取各组不同时间点100 μg蛋白上样;SDS-PAGE分离总蛋白,0.8 mA/cm2膜面积恒流半干转膜1小时,5%脱脂牛奶室温封闭1小时,PBST洗膜3次,5~10分钟/次;一抗 4℃ 孵育过夜;(TLR7、MyD88、NF-κB 稀释比例为 1∶1 000、GAPDH 稀释比例为1∶3 000)。次日,PBST充分洗膜,加入标记 HRP的羊抗兔 IgG(1∶1 000稀释),常温孵育1~2小时,PBST洗膜4次,5~10分钟/次,ECL孵育5分钟后曝光显影。Quantity one软件分析蛋白曝光条带灰度值,与同组GAPDH灰度相比得到相对灰度比值,以24小时正常对照组蛋白表达为参照,做统计学分析。
1.3.4 ELISA检测鼠源性 BMDC培养上清 IFN-α、IP-10的水平 DEN2(MOI=0.4)感染鼠源性BMDC,同时设正常对照,于感染后24、48、72小时收集细胞培养上清,双抗体夹心ELISA法动态检测感染组及正常对照组IFN-α、IP-10的水平,按试剂盒说明书操作,具体操作如下:96孔酶标板分设标准孔、空白孔、待测样品孔,各孔均设复孔。(1)Wash buffer润湿酶标板,分别加标准品、样本稀释液、待测样本50 μl/孔,并在各孔中加入生物素化抗小鼠IFN-α/IP-10 50 μl,18 ~25℃孵育2 小时,Wash buffer洗板4次,甩干;(2)加HRP标记的亲和素100 μl/孔,18~25℃孵育1小时,洗板同前;(3)底物工作液(TMB)100 μl/孔,18~25℃避光孵育30分钟,加终止液100 μl/孔,酶标仪在测量波长450 nm,参考波长630 nm,读取各孔吸光值及浓度。为排除细胞数目对上清中待检蛋白含量的影响,按每孔细胞数为1×106个校正所得数据。
1.3.5 RT-PCR动态检测鼠源性 BMDC中 DEN2载量 TRIzol法提取DEN2感染组及对照组不同时间点BMDC总RNA,按Invitrogen M-MLV逆转录试剂盒说明书操作,定量逆转录5 μg cDNA,利用500 ng cDNA进行PCR扩增内参GAPDH及DEN2 NS5核酸,反应体系为 50 μl,依次加入 dddH2O 34.3 μl,cDNA 5.0 μl,10 × PCR buffer 5.0 μl,dNTP 1.0 μl,MgCl21.5 μl,上游引物(10 μmol/L)1.5 μl,下游引物(10 μmol/L)1.5 μl,ExTaq 0.2 μl。PCR 扩增条件:94℃ 4分钟;94℃ 30秒;64℃ 45秒;72℃ 1分钟;72℃ 7分钟进行34个循环,1%琼脂糖凝胶电泳分析5 μl PCR产物。
1.4 统计学处理 采用SPSS17.0统计软件进行数据分析,所有计量数据均采用±s表示,使用独立样本t检验处理数据,P<0.05具有统计学意义。
2 结果
2.1 C57BL/6小鼠 BMDC的获得 rmGM-CSF、rmIL-4联合诱导C57BL/6小鼠骨髓前体细胞,培养至第5天流式细胞术检测其纯度及成熟情况;CD11c为小鼠BMDC的特异性标志,其表达情况可反映小鼠BMDC纯度;CD86、I-A/I-E等共刺激信号分子是DC成熟的重要标志,LPS可刺激DC成熟,高表达CD86、I-A/I-E等共刺激分子。诱导得到的BMDC经流式细胞术检测纯度达70%(图1);且未成熟情况与LPS刺激组相比具统计学意义(P<0.05),结果见表1。
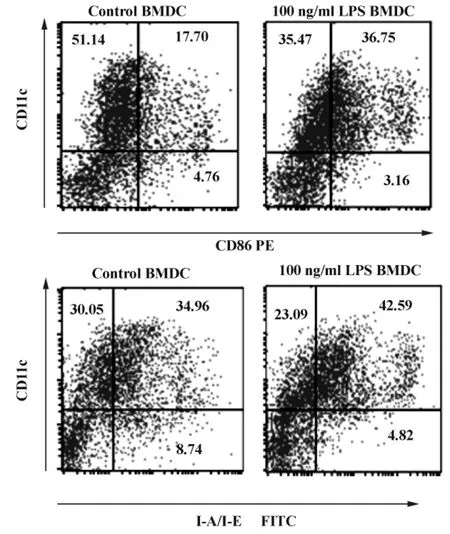
图1 流式细胞术鉴定C57BL/6小鼠BMDC的纯度及成熟情况Fig.1 The purification and maturity of bone marrow dendritic cells from C57BL/6 was identificated by Flow cytometry
2.2 DEN2吸附鼠源性BMDC情况 DEN2(MOI=0.4)感染鼠源性BMDC 24小时后,通过直接免疫荧光检测DEN2吸附BMDC的情况,暗场中观察到正常对照组细胞膜被伊文斯兰衬染为红色(图2A、B);DEN2感染组,暗场中可观察到FITC标记的抗DEN2 E蛋白抗体可与被感染BMDC上的DEN2抗原相结合(图2C、D)。
2.3 DEN2 对鼠源性 BMDC 中 TLR7、MyD88、NF-κB表达的影响 采用Western blot动态检测DEN2感染组及正常对照组 TLR7、MyD88、NF-κB、GAPDH的表达(图3);通过对不同时间目的蛋白条带进行灰度扫描,24小时正常对照组蛋白表达为参照,半定量分析各蛋白表达。观察到病毒感染组TLR7蛋白的表达24小时高于正常对照组,48、72小时均低于正常对照组(图4A);病毒感染组MyD88蛋白的表达24、48小时高于正常对照组,72小时时表达明显降低,低于72小时正常对照组(图4B);病毒感染组NF-κB蛋白的表达各时间点均高于正常对照组,在48小时表达最高,72小时有所下降,结果见图4C。
表1 树突状细胞膜表面分子的表达(±s,n=3)Tab.1 The expression of membrane surface molecules of dendritic cells(±s,n=3)

表1 树突状细胞膜表面分子的表达(±s,n=3)Tab.1 The expression of membrane surface molecules of dendritic cells(±s,n=3)
Note:Compare with Non LPS stimulation group,1)P <0.05.
Membrane surface molecules The percent of membrance surface molecules(%)Non LPS stimulation LPS stimulation CD11c 71.36 ±3.44 73.29 ±1.25 CD86 29.2 ±4.55 48.82 ±7.221)I-A/I-E 43.55 ±4.01 51.06 ±6.411)
2.4 DEN2促进鼠源性BMDC分泌IFN-α、IP-10采用ELISA法动态检测DEN2感染组及正常对照组BMDC培养上清IFN-α、IP-10的水平,观察到DEN2感染组IFN-α、IP-10水平均高于正常对照组,且具统计学意义(P<0.05);DEN2感染组IFN-α随着时间延长分泌量逐渐增加,72小时分泌量达(933.94±29.02)ρg/ml也具有统计学意义(P <0.05)。DEN2感染组IP-10呈现先升高,48小时达高峰,分泌量为(834.44 ±43.60)ρg/ml,72 小时有所降低,具有统计学意义(P<0.05),结果见图5。
2.5 C57BL/6小鼠 BMDC中 DEN2动态变化DEN2(MOI=0.4)感染培养5天的C57BL/6小鼠BMDC,24、48、72小时收集感染组及正常对照组细胞,通过 RT-PCR、1%琼脂糖凝胶电泳分析 DEN2 NS5 PCR产物,观察到感染组及正常对照组GAPDH(图6A)表达一致,感染组在177 bp处得到特异性DEN2目的条带,DEN2核酸水平(图6B)24小时较高,48小时达高峰,72小时有所减弱。

图2 DEN2 NGC株吸附BMDC(×200)Fig.2 Characterization of DEN2 NGC strain adhered to BMDC(×200)

图3 DEN2 NGC株感染BMDC后TLR7、MyD88、NF-κB、GAPDH蛋白表达Fig.3 The protein expression of TLR7,MyD88,NF-κB,GAPDH in BMDCs infected with DEN2 NGC
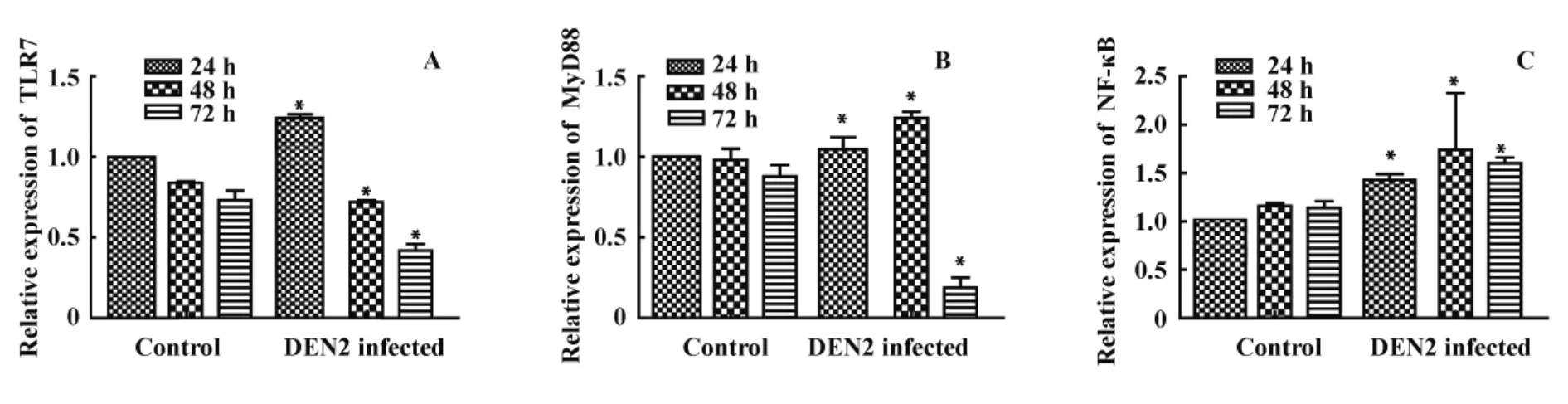
图4 DEN2 对BMDC TLR7、MyD88、NF-κB蛋白表达的影响Fig.4 Effects of DEN2 on expression of TLR7,MyD88,NF-κB in BMDC
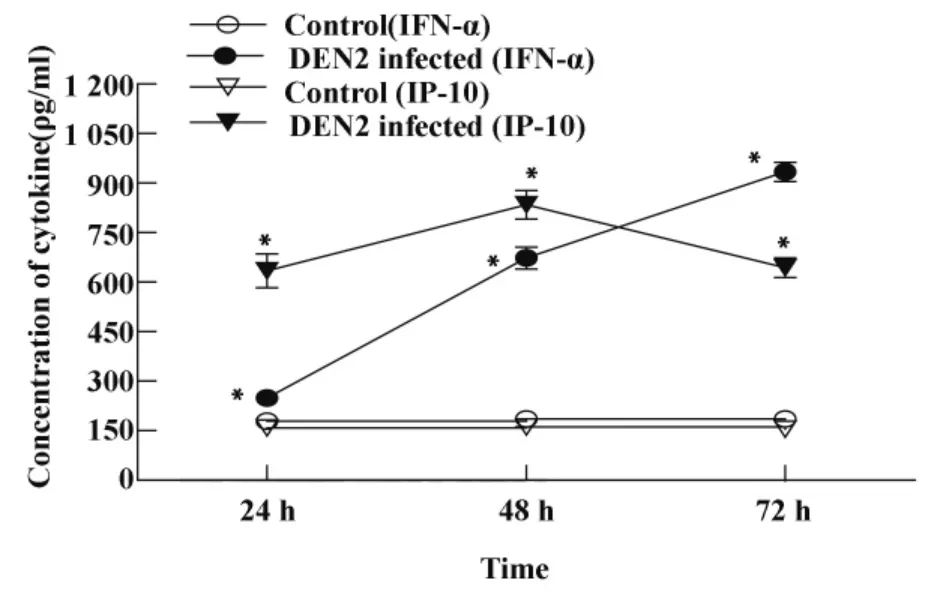
图5 DEN2对小鼠BMDC分泌IFN-α、IP-10的影响Fig.5 Effects of DEN2 infection on secretion of cytokines(IFN-α,IP-10)in BMDCs
3 讨论
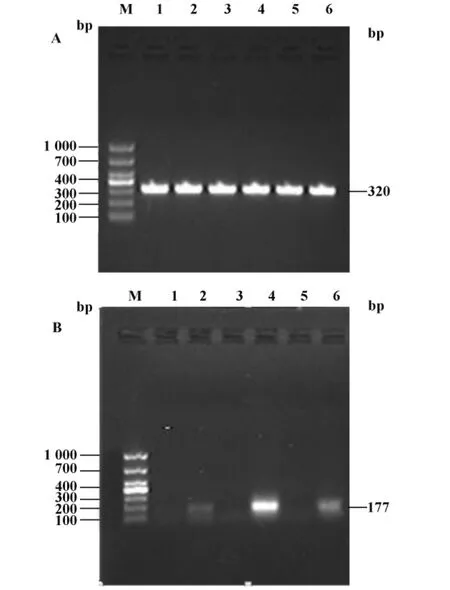
图6 RT-PCR检测DC中DEN2 RNAFig.6 Detection of DEN2 RNA in BMDCs by RT-PCR
DC作为目前已知功能最强大的抗原提呈细胞,近年来受到越来越多的关注,其中骨髓来源的DC可识别多种RNA病毒,包括麻疹病毒、HIV病毒、汉坦病毒、黄病毒及流感病毒[8,9]。分布在 DC上的TLRs可识别危险信号,在启动抗细菌和病毒感染的固有免疫应答发挥关键作用[10]。BMDC被DEN2感染后,主要通过TLR3、TLR4、TLR7和TLR8识别及介导抗 DEN免疫反应[11],其中 TLR7及TLR8主要通过识别ssRNA介导抗DEN2免疫反应,为MyD88依赖途径。TLR7广泛分布于小鼠和人类的抗原提呈细胞(DCs、B细胞、单核巨噬细胞),此外自然杀伤细胞和T细胞中也有表达[12]。静息状态下,TLR7主要定位于内质网,是哺乳动物单链RNA的受体,在受到病原体刺激后,可与内质网跨膜蛋白UNC93B1相互作用,并转移至胞内体膜上以识别相应的 PAMPs[13],在整个信号转录过程中,TLR7对配体的识别及转录控制方面起到了非常重要的作用[14],有研究提示TLR7缺陷的小鼠产生Ⅰ型干扰素的能力要弱于野生型小鼠,从而不利于病毒的清除,TLR7或MyD88的缺乏将减弱固有免疫并促进病毒在组织中的扩增[15]。TLR7与相应配体结合后可招募下游接头蛋白分子启动信号转导途径;MyD88是除TLR3外所有TLR下游信号所必须的,MyD88通过产生大量趋化因子使单核巨噬细胞及T细胞聚集发挥免疫应答作用,从而限制病毒的复制及扩散[16]。MyD88依赖途径主要活化下游分子NF-κB、p38 MAPK及JNK,使其泛素化后转位入核,可协同DC增加炎性细胞因子的分泌,其中NF-κB的活化,可促进 DC分化成熟及 TNF-α的分泌[17],在 TLR信号调节中起到积极作用。此外TLR7/MyD88途径可活化 IRF-3、IRF7引起 IFN-α、IP-10的大量分泌,从而抑制DEN复制和感染扩散。
本研究利用DEN2感染小鼠髓源性DC,动态检测 TLR7、MyD88、NF-κB 蛋白表达变化,在病毒感染后24 小时,TLR7、MyD88、NF-κB 的蛋白表达均较正常对照组增高,提示表达于DC内的TLR7识别单链DEN,从而表达明显增高,并启动MyD88信号途径将识别信息向下传递,最终使NF-κB活化而引起一系列细胞因子的产生;而随着感染时间的延长,TLR7的表达较24小时降低,此时病毒的核酸水平较24小时增高。有文献报道,肝癌细胞中TLR7 RNA及蛋白的表达受损及减少是由于丙肝病毒的复制,用IFN-α预处理肝癌细胞以抑制病毒的复制可使TLR7的表达不减少,同时提出虽然丙肝病毒的复制可使TLR7的表达减少,但与此同时,仍上调其它信号通路的活化,且活化程度与病毒感染有关[18],故考虑TLR7表达的降低可能是由于病毒在细胞内复制所致,但其下游MyD88信号通路已被活化,故MyD88、NF-κB的表达在感染组均较正常组增高,MyD88、NF-κB表达增加,可促进 DC分化成熟,且NF-κB的活化可在病毒感染早期阶段介导炎性细胞因子的分泌,并随之促进Ⅰ型干扰素、趋化因子的分泌而发挥抗病毒作用。随着时间的延长,在DEN2 感染72 小时后,TLR7、MyD88、NF-κB 的蛋白表达不论在正常细胞组还是病毒感染组均较前下降,TLR7介导的信号通路在病毒感染早期发挥作用,导致病毒感染细胞凋亡,而使病毒感染组TLR7、MyD88、NF-κB的表达下降,与病毒自身复制及DEN2感染后产生相关细胞因子发挥抗病毒作用有关。
传统观念认为,pDC在识别病毒后可产生大量的IFN-α。近期研究发现骨髓来源DC识别病毒也可产生大量的IFN-α,并具有强大的刺激T细胞活化的能力[19]。病毒感染DC时可刺激细胞产生大量的IFN-α/β,启动宿主迅速而强烈的抗病毒应答[20],抑制体外DEN感染扩增并诱导产生IP-10,从而抑制病毒对其它细胞的感染,引起被感染细胞的凋亡,最终清除感染的病毒。本研究观察到,当DEN2感染小鼠髓源性DC 24小时后IFN-α的分泌较正常对照组升高,且随着时间延长,分泌量不断增加;DEN2感染72小时后,IFN-α量达到最高,而此时病毒载量却较48小时降低,因此可推断IFN-α在此过程中发挥了抗病毒作用。
IP-10是IFN-γ诱导蛋白10,属CXCL10趋化因子家族,可招募淋巴细胞、特异性CTL细胞到达感染部位识别病毒感染的DC,启动T细胞免疫应答,为适应性免疫应答提供条件,Ⅰ型干扰素的产生可抑制病毒感染的传播并导致大量趋化因子IP-10的产生。最近研究指出,CXCL10缺乏的小鼠对DEN易感,除了缺乏募集淋巴细胞的能力,还缺乏促进病毒清除的抗病毒活性[21]。因此IP-10在抗DEN中发挥重要作用,它可通过启动适应性免疫应答和直接的抗病毒方式以发挥抗病毒作用。本研究证实DEN2感染组IP-10的分泌在感染后24小时较正常组明显升高,48小时达顶峰,72小时又有所下降,但仍远高于正常对照组。IP-10可使Th1细胞聚集在病毒感染的部位而发挥Th1型免疫应答,48小时病毒复制达最高峰,此时IP-10的分泌也达顶峰,可使IL-12等细胞因子聚集,为募集Th1细胞创造条件,激活初始T细胞,进而启动适应性免疫应答;此外,它直接抗病毒作用的发挥也使DEN2在BMDC内的核酸水平在72小时有所下降。
本课题组研究已证实,小鼠被DEN2感染后,血清中Th1、Th2类细胞因子水平发生变化[22]。在本研究中DEN2感染BMDC后,观察到TLR7、MyD88及NF-κB的表达变化和IFN-α、IP-10分泌的明显增加,结合BMDC内DEN核酸水平的变化,可证明在DEN2感染BMDC后,可改变MyD88依赖型信号通路并促进IFN-α、IP-10的产生,抑制病毒的复制,在抗DEN感染的固有免疫应答中发挥一定作用。
1 Murrell S,Wu S C,Butler M.Review of dengue virus and the devel-opment of a vaccine[J].Biotechnology Advances,2011;29(2):239-247.
2 Kawai T,Akira S.The roles of TLRs,RLRs and NLRs in pathogen recognition[J].Immunol,2009;21(4):317-337.
3 Teri L Kissner,Gordon Ruthel,Emily D Cisney et al.MyD88-dependent pro-inflammatory cytokine response contributes to lethal toxicity of staphylococcal enterotoxin B in mice[J].Innate Immunity,2011;17(5):451-462.
4 Monika Avbel J,Simon Horvat,Roman Jerala.The role of intermediary domain of MyD88 in cell activation and therapeutic inhibition of TLRs[J].Immunol,2011;187(5):2394-2404.
5 Appledorn D M,Patial S,McBride A et al.Adenovirus vector-induced innate inflammatory mediators,MAPK signaling,as well as adaptive immune responses are dependent upon both TLR2 and TLR9 in vivo[J].Immunol,2008;181(3):2134-2144.
6 Nembr ini C,Abel B,Kopf M et al.Strong TCR signaling,TLR liglands and cytokine redundancies ensure robust development of type 1 effector T cell[J].Immunol,2006;176(12):7180-7188.
7 Singh S K,Streng-Ouwehand I,Litjens M et al.Design of neo-glycoconjugates that target the mannose receptor and enhance TLR-independent cross-presentation and Th1 polarization[J].Eur J Immunol,2011;41(4):916-925.
8 Humbert J M,Frecha C,Bouafia F A et al.Measles virus glycoprotein-pseudotyped lentiviral vectors are highly superior to vesicular stomatitis virus G pseudotypes for genetic modification of monocyte-derived dendritic cells[J].Virol,2012;86(9):5192-5203.
9 Ferreira C S A,Frenzke M,Leonard V H J et al.Measles virus infection of alveolar macrophages and dendritic cells precedes spread to lymphatic organs in transgenic mice expressing human signaling lymphocytic activation molecule(SLAM,CD150)[J].Virol,2010;84(6):3033-3042.
10 Jakub Siednienko,Thusitha Gajanayake,Katherine A et al.Absence of MyD88 results in enhanced TLR3-dependent phosphorylation of IRF3 and increased IFN-β and RANTES production[J].Immunol,2011;186(4):2514-2522.
11 Taro Kawai,Shizuo Akira.The role of pattern-recognition receptors in innate immunity:update on Toll-like receptors[J].Nature Immunology,2010;11(5):373-384.
12 Bauer S,Pigisch S,Hangel D et al.Recognition of nucleic acid and nucleic acid analogs by Toll-like receptors 7,8 and 9[J].Immunobiology,2008;213(3-4):315-328.
13 Brinkmann M M,Spooner E,Hoebe K et al.The interaction between the ER membrane protein UNC93B and TLR3,7,and 9 is crucial for TLR signaling[J].Cell Biol,2007;177(2):265-275.
14 Carlo Iavarone,Katrin Ramsauer,Andriy V Kubarenko et al.A point mutation in the amino terminus of TLR7 abolishes signaling without affecting ligand binding[J].Immunol,2011;186(7):4213-4222.
15 Sophia Davidson,Gerard Kaiko,Zhixuan Loh et al.Plasmacytoid dendritic cells promote host defense against Acute Pneumovirus infection via the TLR7-MyD88-dependent signaling pathway[J].Immunol,2011;186(10):5938-5948.
16 Kristy J Szretter,Stephane Daffis,Jigisha Patel et al.The innate immune adaptor molecule MyD88 restricts West Nile virus replication and spread in neurons of the central nervous system[J].Virol,2010;84(23):12125-12138.
17 Nadege Ade,Diane Antonios,Saadia Kerdine-Romer et al.NF-κB plays a major role in the maturation of human dendritic cells induced by NiSO4 but not by DNCB[J].Toxicological Sciences,2007;99(2):488-501.
18 Serena Chang,Karen Kodys,Gyongyi Szabo.Impaired expression and function of Toll-like receptor7 in hepatitis C virus infection in human hepatoma cells[J].Hepatology,2010;51(1):35-42.
19 Meredith O’Keeffe,Ben Fancke,Mark Suter et al.Nonplasmacytoid,high IFN-α producing,bone marrow dendritic cells[J].Immunol,2012;188(8):3774-3783.
20 Seo Y J,Hahm B.Type I interferon modulates the battle of host immune system against viruses[J].Adv Appl Microbiol,2010;73:83-101.
21 Peng-Peng Ip,Fang Liao.Resistance to dengue virus infection in mice is potentiated by CXCL10 and is independent of CXCL10-mediated leukocyte recruitment[J].Immunol,2010;184(10):5705-5714.
22 陈文婕,左 丽,潘 宇 et al.DEN2 NGC株感染BALB/c小鼠TH1/TH2类细胞因子产生的差异[J].中国免疫学杂志,2007;23(1):21-24.
