海参磷脂型二十碳五烯酸降血糖机制研究
2013-11-26胡世伟王静凤徐雷雷楼乔明龙腾腾薛长湖
胡世伟,王静凤,徐雷雷,柳 东,楼乔明,龙腾腾,薛长湖
中国海洋大学食品科学与工程学院,山东青岛266003
糖原是葡萄糖在体内的存储形式,可通过胰岛素的调控进行合成与分解.有研究证实,糖尿病患者会因胰岛素分泌绝对或相对不足,导致肝糖原含量明显低于正常人[1].肝糖原的合成与胰岛素介导的Akt/GSK-3β信号转导通路密切相关,当Akt/GSK-3β信号转导通路被胰岛素诱导激活后,可参与下游与糖代谢相关酶活性的调节,相反,当Akt/GSK-3β信号转导通路中任何一个基因表达异常时,均可引起严重的糖代谢紊乱,并诱发糖尿病.
海参为棘皮动物门(Echinodermata)海参纲(Holothuroidea)盾手目(Aspidoehirota)生物,是一种名贵的滋补食品和海洋药材.海参体壁富含海参硫酸多糖、海参胶原多肽、海参皂苷、海参脑苷脂、神经节苷脂和磷脂等多种活性物质[2],具有降血糖、降血脂、抗肿瘤和增强免疫力等功效.目前,有关海参中磷脂的报道较少.磷脂是海参脂质的主要组成成分,约占总脂质含量的1/3,富含二十碳四烯酸(arachidonic acid,AA)和二十碳五烯酸(eicosapentaenoic acid,EPA)等不饱和脂肪酸.Lou等[3]对不同种类海参体壁的磷脂含量及磷脂中多不饱和脂肪酸的组成进行了分析比较,结果发现以冰岛刺参(Cucumaria frondosa)为主的寒带海参体壁含有丰富的磷脂酰胆碱(phosphatidylcholine,PC),且PC中的多不饱和脂肪酸组成以EPA为主.通过结构解析发现,EPA位于PC的Sn-2位,形成了海参特有的磷脂型二十碳五烯酸(eicosapentaenoic acid phosphatidylcholine,EPA-PC).活性研究发现,海参EPA-PC具有较强的抗氧化性、减肥特性和保护胰岛作用[3-4],但有关海参EPA-PC在降血糖方面的作用机制尚未见报道.
本实验以海参EPA-PC为研究对象,探究其对糖尿病大鼠肝脏糖原合成和Akt/GSK-3β信号转导通路的影响,及其降低血糖的机制.
1 实验材料和仪器
本实验采用干制冰岛刺参,购于青岛市水产品市场,粉碎后室温干燥保存备用;健康雄性SD大鼠,体重(200±20)g,SPF级,由北京维通利华动物实验技术有限公司提供,合格证号:SCXK(京)2010-0007.
所用试剂有:链尿佐菌素(Streptozotocin,STZ)(美国Sigma公司);葡萄糖测定试剂盒及肝糖原测定试剂盒(北京中生北控生物科技股份有限公司);胰岛素ELISA试剂盒(美国R&D公司);TRIzol(Reagent生物科技有限公司);Taq酶、M-MLV(美国 TaKaRa公司);IR、IRS-1/2、PI3K、Akt、GSK-3β、GS及内参β-actin(上海生工生物工程有限公司);Western及IP细胞裂解液、BCA蛋白浓度测定试剂盒、ECL化学发光试剂盒(碧云天生物技术研究所);兔抗大鼠IRS-2、PI3K、Akt、GSK-3β多克隆抗体(美国Cell Signaling公司);山羊抗兔IgG-HRP、GAPDH抗体(美国Santa-cruz公司).
本实验所用仪器有:680型酶标仪(Bio-Rad公司);UV-2550紫外/可见分光光度计(日本岛津公司);Western电泳仪、转膜装置(Bio-Rad公司);Life Pro基因扩增仪(杭州博日科技有限公司);GIS-2008数码凝胶成像系统(上海天能科技有限公司).
2 实验方法
2.1 海参EPA-PC的制备
干制冰岛刺参,粉碎后水发过夜,去水,加甲醇-氯仿溶液(体积比为2∶1)浸提,取滤液,低温真空旋转蒸发,得总脂质粗样品.经丙酮和甲醇反复清洗除杂,收集丙酮不容物,氯仿溶解后,硅胶柱层析洗脱,TLC点板层析,并用碘和Dittmer试剂显色,收集磷脂组分洗脱液,减压浓缩,得到高纯度的磷脂样品,经高效液相色谱法测得PC质量分数为72.0%.然后,对磷脂样品中的PC进行高效液相半制备,并通过气相色谱/质谱法对PC中的脂肪酸组成分析,测得EPA质量分数为30.1%[3].将EPA-PC与胆固醇等摩尔混合,用少量氯仿溶解,真空旋蒸成均匀薄层,加入生理盐水震荡混匀,冲入氮气后低温超声成水溶性悬浊液,即为实验用海参EPA-PC.
2.2 糖尿病模型建立及动物实验
SD大鼠适应性喂养7 d,随机选取10只作为正常对照组,其余为造模组.所有大鼠禁食不禁水12 h,造模组于当日和次日分别以45和10 mg/(kg·周)的剂量腹腔注射STZ溶液(溶于0.1 mmol/L柠檬酸-柠檬酸纳缓冲液,pH=4.3),正常对照组注射等体积缓冲液(pH=4.3).72 h后尾静脉采血测空腹血糖,以大鼠空腹血糖浓度≥16.7 mmol/L 者为造模成功[10].
将造模成功的大鼠按体重和空腹血糖值随机分为模型对照组,海参EPA-PC低、高剂量组(25和75 mg/(kg·周),以 EPA质量计),每组10只.分组当日开始给药,正常对照组和模型对照组灌胃生理盐水10 mL/(kg·周),1次/d,连续60 d,期间大鼠自由进食、饮水.于末次给药后,检测大鼠空腹血糖值、口服葡萄糖耐量、血清胰岛素含量.大鼠处死后,快速分离肝脏组织,置于液氮中,-80℃保存备用.
2.3 空腹血糖浓度测定
大鼠末次给药后禁食不禁水5 h,尾静脉取血,参照葡萄糖试剂盒说明书测定空腹血糖浓度.
2.4 口服葡萄糖耐量测定
大鼠禁食不禁水5 h,灌胃葡萄糖溶液(剂量为2 g/kg,分别于灌胃后0、0.5和2 h取血测定血糖值,并计算血糖浓度-时间曲线下面积(area under the curve,AUC)[2](单位:h·mol/L),

2.5 肝糖原质量分数测定
大鼠腹主动脉取血后,5 min内迅速剥取肝脏约0.1 g,与4 mol/L的NaOH 溶液0.3 mL混合,沸水浴30 min,加入96倍体积的蒸馏水稀释成待测液.离心,取上清,参照试剂盒方法测定.
借鉴国外经验,我国在推进国内互联互通工程过程中,一是应加强天然气领域的立法工作。明确监管机构和职责,增强依法监管能力建设,从顶层设计层面,以建设统一协调运行的天然气基础设施运营系统为着眼点,统一设计标准、建设标准和运营标准,减少互联互通的技术障碍,强制实施天然气基础设施设计、建设与互联互通同步进行,为推进全国一张网的互联互通工程奠定坚实基础。
2.6 血清胰岛素含量测定
大鼠禁食不禁水10 h,腹主动脉取血分离血清,参照试剂盒说明书测定血清胰岛素含量.
2.7 采用RT-PCR检测肝脏中相关基因mRNA表达水平
采用TRIzol法提取肝脏中的总RNA.取1 μg总RNA逆转录成cDNA,并于30 μL反应体系中进行聚合酶链反应扩增,反应体系为:cDNA 2 μL、25 mmol/L MgCl2(液体)1.8 μL、10×PCR 缓冲液3 μL、10 mmol/L dNTPs 1.2 μL、10 μmol/L 引物各0.6 μL、5 U/μL Taq 酶 0.6 μL,加超纯水补至 30 μL.PCR反应条件为:94℃预变性5 min,94℃变性45 s,退火30 s,72℃延伸45 s,循环结束后72℃再延伸10 min.所用目的基因序列、产物长度、退火温度以及循环数见表1.反应产物经 0.01 g/mL的琼脂糖凝胶电泳,凝胶成像系统拍照,Image J图像分析软件分析条带灰度.结果以目的基因与内参β-actin条带灰度的比值表示.
2.8 Western blot检测肝脏中相关蛋白表达水平
采用Western blot及IP细胞裂解液提取肝脏中总蛋白,BCA法检测总蛋白含量.取50 μg的蛋白加入4×蛋白上样缓冲液,沸水浴5 min,经质量浓度为1 mg/mL的SDS-PAGE凝胶电泳,转移至PVDF膜,用质量浓度为5 mg/mL的脱脂奶粉封闭2 h.按抗体说明书分别加入对应的一抗(IRS-2、PI3K、Akt、GSK-3β和GAPDH),4℃孵育过夜,TBST清洗后加入辣根过氧化物酶标记的二抗,室温孵育2 h.ECL化学发光试剂盒显色、曝光,拍照后,Image J图像分析软件分析条带灰度,结果以目的蛋白条带灰度与内参GAPDH条带灰度比值表示.
2.9 统计学处理
数据分析结果采用SPSS17.0软件进行单因素方差分析,同时进行LSD两两比较,以P<0.05为差异显著,实验结果用±s表示.

表1 IR、IRS-1、IRS-2、PI3K、Akt、GSK-3β和GS的引物Table1 The primers of IR,IRS-1,IRS-2,PI3K,Akt,GSK-3β and GS
3 结果分析
3.1 对空腹血糖和口服葡萄糖耐量的影响
空腹血糖和葡萄糖耐量是评价高血糖症状改善的基本指标.如表2,模型对照组大鼠空腹血糖浓度和葡萄糖曲线下面积较正常对照组明显升高(P<0.01),提示所造糖尿病大鼠模型成功.经海参EPA-PC干预后,高剂量组大鼠空腹血糖值下降23.6%(P < 0.05),AUC 下降25.8%(P < 0.05),表明海参EPA-PC具有显著的降血糖作用.
表2 EPA-PC对糖尿病大鼠空腹血糖、葡萄糖曲线下面积、血清胰岛素和肝糖原质量分数(n=10,±s)的影响Table2 Effects of EPA-PC on fasting blood glucose level,AUC,serum insulin level,and hepatic glycogen content in diabetic rats(n=10,±s)

表2 EPA-PC对糖尿病大鼠空腹血糖、葡萄糖曲线下面积、血清胰岛素和肝糖原质量分数(n=10,±s)的影响Table2 Effects of EPA-PC on fasting blood glucose level,AUC,serum insulin level,and hepatic glycogen content in diabetic rats(n=10,±s)
##P < 0.01,与正常对照组比较;*P < 0.05,**P < 0.01,与模型对照组比较
正常对照 5.25 ±0.12 15.33 ±1.77 3.24 ±0.3111.49 ±2.89模 型 26.03 ±2.23## 55.67 ±4.10## 2.02 ±0.39## 4.69 ±0.66##低剂量 22.21 ±1.78 47.27 ±4.37 2.11 ±0.13 4.81 ±0.61高剂量 19.89 ±1.61* 41.30±3.61* 3.10 ±0.21** 9.47 ±1.38**
3.2 对血清胰岛素含量的影响
胰岛素对机体糖代谢具有重要的调节作用,其含量是反映胰岛细胞对胰岛素分泌功能的重要指标.如表2,海参EPA-PC高剂量组大鼠血清胰岛素含量比模型对照组提高了53.5%(P<0.01).这与徐雷雷等[4]报道的EPA-PC对糖尿病大鼠胰岛具有明显的保护作用一致,说明海参EPA-PC能够提高胰岛β细胞对胰岛素的合成和分泌能力.
3.3 对肝糖原质量分数的影响
3.4 对肝脏糖原合成信号通路mRNA表达的影响
肝脏是胰岛素敏感靶器官和糖原合成的主要场所.已公认胰岛素介导的Akt/GSK-3β信号转导通路是肝糖原合成的主要途径.由图1可知,模型对照组IR、IRS-2、PI3K、Akt和GS等基因的mRNA表达量和正常对照组相比显著降低(P<0.01,P<0.05),GSK-3β mRNA表达量明显升高(P <0.05).经海参EPA-PC干预后,剂量组大鼠的IR、IRS-2、PI3K、Akt和GS mRNA表达量分别平均提高了86.6%、105.1%、33.02%、30.54% 和22.37%(P < 0.01,P < 0.05),同时高剂量组GSK-3β mRNA表达量下调了16.38%(P<0.05).结果提示海参EPA-PC能在转录水平上显著上调胰岛素介导的Akt/GSK-3β信号转导通路,促进肝糖原合成.
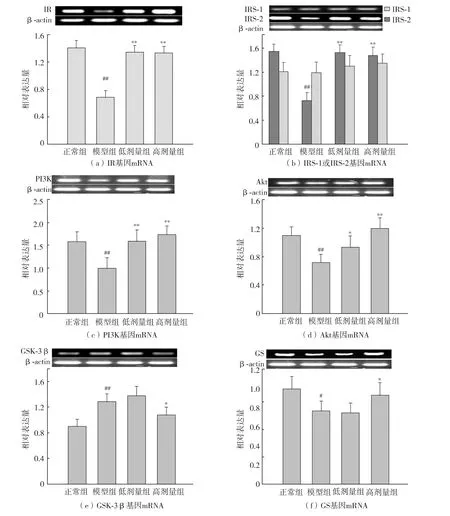
图1 海参EPA-PC对糖尿病大鼠肝脏IR、IRS-1/2、PI3K、Akt、GSK-3β和GS基因转录表达的影响Fig.1 Effects of EPA-PC on transcription of IR,IRS-1/2,PI3K,Akt,GSK-3β and GS in the liver of diabetic rats
3.5 对肝脏糖原合成信号通路蛋白表达的影响
采用Western blot进一步检测海参EPA-PC对IRS-2、PI3K、Akt和GSK-3β蛋白表达的影响,结果如图2.与模型对照组相比,高剂量组大鼠肝脏中IRS-2、PI3K和Akt蛋白表达量分别显著提高了61.5%、51.1%和18.2%(P < 0.01,P < 0.05),GSK-3β蛋白表达量和模型对照组相比下降了24.5%(P <0.05).提示海参EPA-PC能够在转录后水平上激活胰岛素介导的Akt/GSK-3β信号转导通路,促进肝糖原合成.

图2 海参EPA-PC对糖尿病大鼠肝脏IRS-2、PI3K、Akt和GSK-3β蛋白表达的影响Fig.2 Effects of EPA-PC on the protein expression of IRS-2,PI3K,Akt and GSK-3β in the liver of diabetic rats
4 讨论
本实验采用腹腔注射链脲佐菌素方法建立了糖尿病大鼠模型,探讨了海参EPA-PC对糖尿病大鼠的降血糖作用.结果表明,海参EPA-PC可显著降低糖尿病大鼠空腹血糖水平,改善葡萄糖耐受性,增加血清胰岛素的含量,促进肝脏中糖原的合成,同时显著上调胰岛素介导的Akt/GSK-3β信号转导通路中与糖原合成相关基因和蛋白的表达,具有显著的降血糖作用.
肝糖原的合成对维持机体葡萄糖稳态具有重要作用,这一过程主要是通过胰岛素介导的Akt/GSK-3β通路完成[5].在此通路中,IR与胰岛素结合,促使该蛋白本身激活并向下游传递信号响应,依次激活 IRS-2、PI3K 和Akt[6].Kubota 等[7]证明激活的IR和IRS-2能有效地促进肝糖原合成.而PI3K抑制剂wortmannin和Akt抑制剂MK-2206显著抑制了胰岛素信号的传递和肝糖原的合成[8].Xie等[9]证实,糖尿病大鼠体内活化的PI3K和Akt可显著地促进肝糖原的合成.本研究结果显示,糖尿病大鼠经海参EPA-PC干预后,肝脏中 IR和IRS-2 mRNA表达水平,IRS-2蛋白表达水平,以及PI3K和Akt mRNA和蛋白表达水平均明显上升.提示海参EPA-PC通过激活Akt/GSK-3β信号转导通路促进肝脏中糖原的转换和储存,起到降血糖的作用.
GSK-3β和GS是胰岛素介导肝脏糖原合成过程中的关键基因[10].GSK-3β 位于 Akt的下游,是Akt/GSK-3β信号转导通路中的负性调节基因,活化的Akt能促进GSK-3β的磷酸化并抑制其活性,导致下游的GS去磷酸化而被激活,从而促进肝糖原的合成.Haseena等[11]证明糖尿病大鼠中高表达的GSK-3β能够抑制糖原的合成.Fang等[12]研究表明激活的GS能够促进肝细胞中糖原的合成.本研究结果显示,糖尿病大鼠经海参EPA-PC干预后,肝脏中的GSK-3β mRNA和蛋白的表达明显降低,同时GS mRNA和蛋白的表达显著升高,说明海参EPA-PC通过抑制GSK-3β增加GS的表达,以促进肝脏中糖原的合成.
综上所述,海参EPA-PC能够通过激活肝脏中Akt/GSK-3β信号转导通路,促进肝糖原合成,起到降血糖的作用.
/References:
[1]Krssak M,Brehm A,Bernroider E,et al.Alterations in postprandial hepatic glycogen metabolism in type 2 diabetes [J].Diabetes,2004,53(12):3048-3056.
[2]Wang Jingfeng,Fu Jia,Xu Leilei,et al.Involvement of the PI3K/Akt pathway in the hypoglycemic effects of sea cucumber Apostichopus japonicas in diabetic rats[J].Journal of Shenzhen University Science and Engineering,2011,28(2):172-178.(in Chinese)王静凤,傅 佳,徐雷雷,等.日本刺参降血糖及对胰岛素信号通路的影响 [J].深圳大学学报理工版,2011,28(2):172-178.
[3]Lou Qiaoming,Wang Yuming,Liu Xiaofang,et al.Lipid profile and fattyacid compositionsin bodywallof Apostichopus japonicus(selenka) [J].Journal of Food Biochemistry,2012,36(3):317-321.
[4]Xu Leilei,Wang Jingfeng,Liu Dong,et al.Effects of sea cucumber eicosapentaenoic acid rich in phosphatidylcholine on rat model of diabetes mellitus[J].Chinese Pharmacological Bulletin,2012,28(10):1398-1402.(in Chinese)徐雷雷,王静凤,柳 东,等.海参磷脂型二十碳五烯酸对糖尿病大鼠血葡萄糖耐量的影响 [J].中国药理学通报,2012,28(10):1398-1402.
[5]Bhuvaneswari S,Anuradha C V.Astaxanthin prevents loss of insulin signaling and improves glucose metabolism in liver of insulin resistant mice[J].Canadian Journal of Physiology and Pharmacology,2012,90(11):1544-1552.
[6]Fisher S J,Kahn C R.Insulin signaling is required for insulin's direct and indirect action on hepatic glucose production [J].Journal of Clinical Investigation,2003,111(4):463-468.
[7]Kubota N,Kubota T,Itoh S,et al.Dynamic functional relay between insulin receptor substrate 1 and 2 in hepatic insulin signaling during fasting and feeding[J].Cell Metabolism,2008,8(1):49-64.
[8]Lai Y C,Liu Y,Jacobs R,et al.A novel PKB/Akt inhibitor,MK-2206,effectively inhibits insulin-stimulated glucose metabolism and protein synthesis in isolated rat skeletal muscle [J].Biochemical Journal,2012,447(1):137-147.
[9]Xie Xi,Li Wenyuan,Lan Tian,et al.Berberine ameliorates hyperglycemia in alloxan-induced diabetic C57BL/6 mice through activation of Akt signaling pathway[J].Endocrine Journal,2011,58(9):761-768.
[10]Hoene M,Lehmann R,Hennige A M,et al.Acute regulation of metabolic genes and insulin receptor substrates in the liver of mice by one single bout of treadmill exercise[J].Journal of Physiology,2009,587(1):241-252.
[11]Haseena B H K,Kaladevi S V,Shanthi P,et al.Ameliorating effect of Semecarpus anacardium Linn.nut milk extract on altered glucose metabolism in high fat diet STZ induced type 2 diabetic rats[J].Asian Pacific Journal of Tropical Disease,2012,5(12):956-961.
[12]Fang Y,Studer E,Mitchell C,et al.Conjugated bile acids regulate hepatocyte glycogen synthase activity in vitro and in vivo via Gαisignaling[J].Molecular Pharmacology,2007,71(14):1122-1128.
