全沟硬蜱Salp15蛋白家族成员基因的克隆与融合表达*
2013-11-26牛思博蒋宝贵
王 欣 孙 毅** 牛思博 蒋宝贵
(1. 安徽医科大学,合肥 230032; 2. 军事医学科学院微生物流行病研究所,病原微生物生物安全国家重点实验室,北京 100071;3. 中国农业科学院哈尔滨兽医研究所,兽医生物技术国家重点实验室,哈尔滨 150006)
全沟硬蜱Ixodespersulcatus栖息于寒带及寒温带的针—阔混交林,主要寄生野生动物(啮齿类、牛、狗、兔)和家畜,也侵袭人。其危害不仅限于叮咬引起的失血、中毒、过敏等症,更重要的是它可以传播螺旋体、无形体、立克次氏体、巴贝西原虫、泰勒原虫等致病微生物(Mulengaetal., 2000; Jaworski, 2003),引起人和动物疾病的暴发流行。与其吸血量大且时间较长的吸血过程相适应,硬蜱涎腺分泌物中含有大量生物活性的蛋白,发挥着舒张血管、抗凝、抗补体和抗宿主免疫等作用,不仅有利于蜱类吸附吸血,也有助于病原在宿主体内中定殖(Francischettietal., 2010)。如,可水解ATP三磷酸腺苷双磷酸酶、血小板聚集抑制剂 (Ribeiroetal., 1985; Titusetal., 1990; Mansetal., 2000)、补体抑制物Isac (Lawrieetal., 1999; Valenzuelaetal., 2000)、促进埃立克体及无形体成功传播的涎腺蛋白Salp16 (Sukumaranetal., 2006)和宿主免疫抑制剂HBPs (Paesenetal., 1999)等。涎腺分泌物已成为蜱类吸血和介导病原体传播的重要成分。目前,已从分布北美肩突硬蜱I.scapulrius的涎腺中发现了Salivary protein 15 kDa,(简称Salp15,下同),并证实其对莱姆病病原之一伯氏螺旋体的北美株Borreliaburgdorferisensustricto具有保护作用, 并发现通过免疫宿主拮抗Salp15的功能,可有效降低肩板硬蜱对莱姆病螺旋体的传播效率(Ramamoorthietal., 2005; Hoviusetal., 2008; Daietal., 2009)。可见,拮抗媒介蜱涎腺功能蛋白可望成为阻碍病原体传播、预防蜱媒疾病发生的重要策略之一,并可由此开发出市场前景巨大的新型传播阻断性疫苗应用于蜱媒病防治。然而,由于自然环境和地理条件的差异,媒介蜱种和病原体的不同可能使这一应用前景受到质疑。为了明确这种保护性机制的蛋白在我国的重要传播媒介中是否存在,是否具有类同的功能和开发价值,本文以我国莱姆病的主要传播媒介全沟硬蜱为对象,开展涎腺蛋白Salp15的相关研究,首次获得了Salp15蛋白并成功完成其原核表达,为开展后续的功能研究及疫苗开发提供了技术支撑。
1 材料与方法
1.1 材料
供试蜱:全沟硬蜱I.persulcatus,为本实验室人工繁殖第2代的实验种群,采集于黑龙江省牡丹江市大石沟林区。克隆菌株E.coliTrans5α,表达菌株E.coliTransetta (DE3),pEASYTM-T1 Simple 克隆载体购于北京全式金公司。pMAL-c4X表达载体,限制性核酸内切酶EcoRⅠ、SalⅠ,Amylose Resin,T4 连接酶购于NEB 公司。 表达菌株E.coliRosseta (DE3),山羊抗小鼠IgG(H+L)-HRP,丽春红染色试剂,TBST缓冲液购于北京康为世纪公司。RNeasy mini kit购于QIAGEN公司。MBP-Tag Mouse Monoclonal Antibody购于Anbo 公司。First-Strand Synthesis System购于英骏公司。Premix Taq 购于Takara公司。QIAquick Gel Extraction Kit 购于QIAGEN 公司。质粒DNA小量试剂盒 购于Axygen公司。pMALTMProtein Fusion and Purification System 购于NEB公司。蛋白定量试剂盒购于Bradford公司。
1.2 方法
1.2.1试蜱叮咬实验:为本实验室实验种群的幼蜱。将15只幼蜱置于昆明鼠(SPF级,4周龄,雄性)腹部,每组15只幼蜱叮咬3 d,至半饱血,立即用镊子取下。3组重复。RNA提取:将半饱血蜱放入已加液氮的研钵,充分研磨,按RNeasy mini kit试剂盒操作手册提取全蜱RNA。按First-Strand Synthesis System逆转录试剂盒立即逆转录。逆转录体系如下:RNA(1.5 μg), oligo dT (20 pmol)总体系20 μL。逆转录之后,立即取2.5 μL cDNA PCR扩增目的基因。引物设计:参照GenBank 中已存在的Salp15同源家族的CDS序列设计-肩突硬蜱I.scapularis(AAK97817),篦子硬蜱I.ricinus(EU128526), 全沟硬蜱I.persulcatus(ACV32167)。设计扩增引物如下:上游引物F-salp: 5′-ATGGAATCTTTCGTCGCAATG-3′;下游引物R-salp: 5′-CTAACATCCGGGAATGTGC-3′。扩增条件:采用Premix Taq, 无菌水至50 μL。PCR反应条件:94℃预变性3 min; 94℃ 30 s, 53℃ 40 s,72℃ 1 min,9个循环;94℃ 30 s, 51℃ 40 s,72℃ 1 min,26个循环;72℃延伸10 min,4℃恒温。琼脂糖凝胶电泳检测按照常规方法进行。对照基因:以全沟硬蜱的管家基因β-actin基因作为阳性对照。其扩增引物为,上游引物Factin:5′-ATGTGTGACGACGAGGTTGCCG-3′;下游引物Ractin: 5′-TTAGAAGCACTTGCGGTGG ACAATG-3′。扩增条件除了退火温度设为55℃,其余同Salp15基因扩增参数。
1.2.2Salp15同源家族基因的克隆及鉴定分析:按QIAquick Gel Extraction Kit的操作说明对PCR 扩增的目的产物切胶纯化,立即取4 μL 产物与1 μL pEASYTM-T1 Simple 克隆载体相连,25℃ 30 min。连接产物转化入E.coliTrans5α 感受态细胞,复苏1 h,涂于LB固体平板(氨苄青霉素浓度为100 μg/mL),37℃过夜。第2 d,挑取白色菌斑-单克隆,至3 mL LB液体培养基,37℃摇菌6.5 h。按AxyPrep 质粒DNA小量试剂盒试剂盒操作说明提取质粒,送至上海生工测序。共挑取20个阳性克隆测序。
经北京大学生物信息学平台weblab对此序列与其他已知Salp15蛋白进行两两比对(Liuetal., 2009),得此序列在氨基酸水平与核苷酸水平与其他类似蜱种Salp15蛋白的相似性和一致性。此外,对其蛋白序列与其他Salp15蛋白经Clustal X2做多序列比对,预测Salp15家族蛋白的保守性位点。由于Salp15是唾液腺分泌蛋白,因此推测其具有信号肽,用在线预测软件Signal P 4.0 (http://www.cbs.dtu.dk/services/SignalP/) 对所得序列进行预测。
1.2.3Salp15同源家族基因的原核重组蛋白表达、纯化:以FE:5′-CGGAATTCATGGAATCT TTCGTCGCAATG-3′;RS: 5′-GCGTCGACCTAA CATCCGGGAATGTGC-3′对I.p larva5的cDNA PCR扩增,增加EcoRⅠ,SalⅠ酶切位点,切胶纯化PCR产物,对产物以及pMAL-c4X表达载体双酶切,T4连接酶连接过夜,转化至Trans5α,提取质粒,进行双酶切并测序鉴定成功插入表达载体。阳性载体转化入E.coliTransetta (DE3)简写为Transetta(pMAL-c4X′),空载体转化入E.coliTransetta (DE3)为Transetta(pMAL-c4X)。部分阳性质粒-80℃保存,5 μL 阳性载体转化入E.coliTransetta (DE3)、E.coliRosseta (DE3), 挑取单克隆培养至对数期,经1 mmol/L IPTG 诱导表达4 h, 10 000 r/min离心2 min收集菌体。磷酸盐缓冲液(0.01 mol/L, pH7.4, PBS)洗3遍,预留1管菌体加蛋白上样缓冲液直接煮沸5 min,使菌体总蛋白变性。另取1管菌体超声波破碎,转速为10 000 r/min 2 min,分离上清,重悬浮沉淀。蛋白SDS-PAGE检测,重组蛋白分子量约为60 kDa。纯化步骤按pMALTMProtein Fusion and Purification System操作手册纯化。
1.2.4Salp15同源家族原核重组蛋白鉴定:首先按照 BioMed 公司的Bradford试剂盒说明书进行蛋白质浓度的测定,测定结果浓度为1.2 mg/mL,确定蛋白样品上样25 μL即30 μg。SDS-PAGE 后转NC膜,Western Blot封闭液Ⅱ(CWbio.Co.Ltd)室温封闭30 min。孵育一抗, 1∶5 000稀释比例稀释MBP抗体(Maltose-binding protein), 完全浸润NC膜,室温孵育30 min后,放于4℃过夜。TBST洗膜5次,每次3 min,加山羊抗小鼠IgG-HRP(IgG-horseradishperoxidase),1∶4 000稀释,室温孵育40 min。TBST洗膜5次,每次3 min。增强化学发光法显色,成像系统曝光并拍照。
2 结果
2.1 全沟硬蜱Salp15 蛋白家族目的基因及序列分析
以全沟硬蜱幼蜱的RNA为模板,oligo dT逆转录获得cDNA, 成功扩增出目的产物,经琼脂糖凝胶电泳检测,目的条带大小约420 bp左右(图1)。经载体连接,挑取单克隆测序,成功测序16个。
经克隆测序获得长度为414 bp的序列,经Blast比对(http://www.ncbi.nih.gov/BLAST),鉴定此CDS序列翻译的蛋白属于Salp15 蛋白超家族成员,翻译后的蛋白具有137个氨基酸残基,推测的分子量为15 476 Da(DNAStar),经SignalP 4.0预测在肽链的N端还有信号肽(图2)。该蛋白在83~137位具有保守位点(图3),将此Salp15同源蛋白命名为I.p larva5, GenBank登录号为(HE820731)。

图1 全沟硬蜱幼蜱中Salp15基因的扩增Fig.1 RT-PCR amplified for Salp15 genes from larva of I.persulcatusM: DL2000; 1: 目的蛋白基因cDNA of I.p larva 5;2: 对照基因β-Actin.M: DL2000; 1: Target gene cDNA of I.p larva5; 2: β-Actin gene as positive control.
经两两比对,I.p larva5(HE820731)与篦子硬蜱I.ricinus的Salp15 iric3(ABU93615) 氨基酸水平的相似性最大为74.5%,与太平洋硬蜱I.pacificus的相似性最小为55.1%(表1),在所有的不同来源的Salp15中,俄罗斯西伯利亚地区的全沟硬蜱Salp15与日本的全沟硬蜱的iper2 (BAH09311)、欧洲的篦子硬蜱iric1 (EU128526)相似性最大,分别为89.1%、87.4%;太平洋硬蜱pacificus (ACV32166)与I.p larva5相似性最小为55.1%(表1)。
2.2 构建表达质粒
经PCR方法在I.p larva5在其5′、3′端分别加上EcoRⅠ,SalⅠ酶切位点。连入pMAL-c4X, 经双酶切以及测序鉴定,正常插入。测序结果显示成功正确连入表达载体,说明重组表达载体构建成功。成功插入的阳性载体命名为pMAL-c4X′。
2.3 诱导表达、纯化所得目的蛋白
重组pMAL-c4X′ 分别转入E.coliTransetta (DE3)、E.coliRosseta (DE3),经IPTG诱导表达菌体总蛋白煮沸变性经SDS-PAGE分析显示,重组融合蛋白大部分可溶,大小约为60 kDa(图4)。经比较,E.coliTransetta (DE3)表达效果好于E.coliRosseta (DE3)。纯化方法按照pMALTMProtein Fusion and Purification System 操作手册纯化目的蛋白。经不同浓度的麦芽糖洗脱液洗脱,确定麦芽糖最佳洗脱浓度为8 mmol/L(图5)。
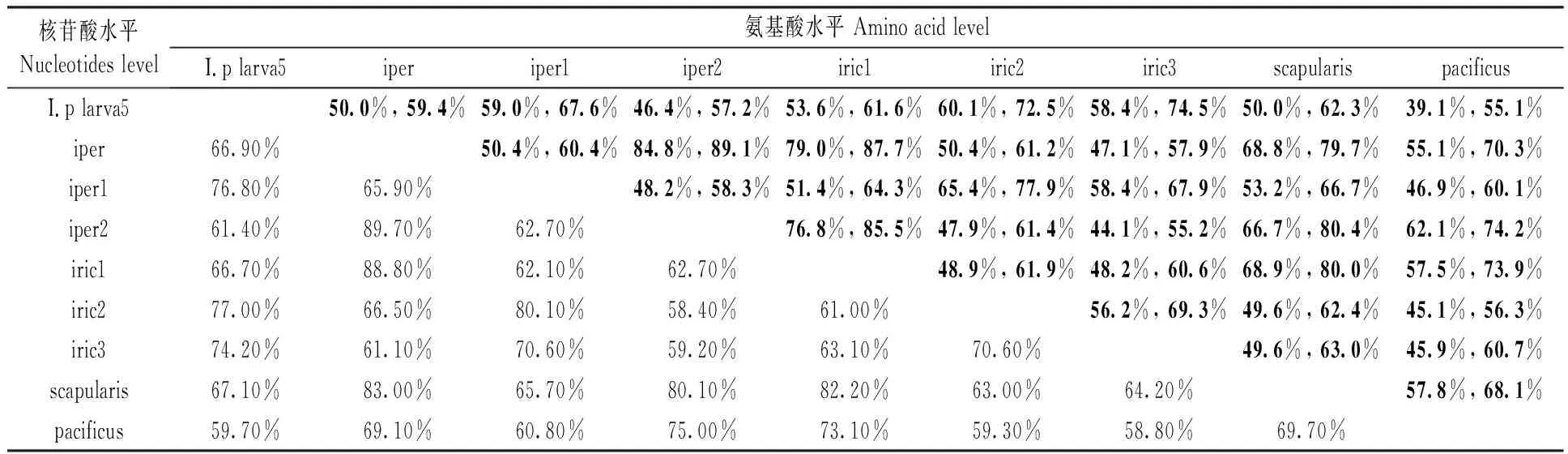
表1 同一家族的Salp15成员氨基酸水平、核苷酸水平的相似性比较Tab.1 The similarities of Salp15 homologues in amino acid level and nucleotides level
注:I.p larva5(HE820731)来自全沟硬蜱; iper (ACV32167), iper1 (BAH09310), iper2 (BAH09311)来自于欧亚全沟硬蜱; iric1 (EU128526), iric2 (ABU93614), iric3(ABU93615)来自于欧洲篦子硬蜱; scapularis(AAK97817)来自于肩突硬蜱;pacificus (ACV32166)来自于太平洋硬蜱。表中粗体为一致性,正体为相似性.
Note: I.p larva5(HE820731)fromI.persucatu(this study); iper (ACV32167), iper1 (BAH09310), iper2 (BAH09311) from Eurasian; iric1 (EU128526), iric2 (ABU93614), iric3(ABU93615) fromI.ricinus; scapularis (AAK97817) fromI.scapularis; pacificus (ACV32166) fromI.pacificus. Bold mean identity, normal mean similarities.

图2 I.p larva5 核苷酸与氨基酸信息Fig.2 Nucleotide and deduced amino acid sequences of cDNA encoding I.p larva5下划线残基为推测的信号肽序列.Predicted signal peptide is underlined.

图3 来源于不同硬蜱的Salp15超家族蛋白多序列比对Fig.3 Alignment of I. persulcatus Salp15 with other Salp15 homologues方框中序列为预测的Salp15 与CD4分子结合位点。不同序列间一致的氨基酸残基、高度保守的残基、相似的残基分别用星号、分号、句号标注。I.p larva5(HE820731)来自全沟硬; iper(ACV32167), iper1(BAH09310), iper2(BAH09311)来自于欧亚全沟硬蜱; iric1(EU128526), iric2(ABU93614), iric3(ABU93615)来自于欧洲篦子硬蜱;来自于肩突硬蜱scapularis (AAK97817);pacificus (ACV32166)来自于太平洋硬蜱。Positions of amino acid sequence identity, amino acid residue similarity and highly conserved amino acid substitutions are marked by an asterisk, full stop and colon, respectively. Cluster of differentiation (CD)4 binding site in putative Salp15 were boxed based on the report by. I.p larva5(HE820731)from I. persucatu (this study); iper(ACV32167), iper1(BAH09310), iper2(BAH09311) from Eurasian; iric1 (EU128526), iric2(ABU93614), iric3(ABU93615) from I. ricinus; scapularis(AAK97817) from I. scapularis; pacificus(ACV32166) from I. pacificus.

图4 菌体裂解液SDS-PAGE检测Fig.4 SDS-PAGE assay of lysised bacteriaM:蛋白分子量标记; 1, 2: Transetta (pMAL-c4X)未经IPTG诱导上清及沉淀; 3, 4:Transetta (pMAL-c4X)经1 mmol/L IPTG诱导上清及沉淀。5, 6:Transetta (pMAL-c4X′) 未经IPTG诱导上清及沉淀;7, 8:Transetta (pMAL-c4X′) 0.5 mmol/L IPTG诱导上清和沉淀;9, 10:Transetta (pMAL-c4X′) 1 mmol/L IPTG诱导上清和沉淀; 11, 12: Transetta (pMAL-c4X′) 1.5 mmol/L IPTG诱导上清和沉淀;13, 14: Transetta(pMAL-c4X′) 1.8 mmol/L IPTG诱导上清和沉淀.M: Protein molecular weight; 1, 2:Supernatant and precipitation of Transetta (pMAL-c4X) uninduced;3, 4:Supernatant and precipitation of Transetta (pMAL-c4X) induced by 1 mmol/L IPTG;5, 6:Supernatant and precipitation of Transetta (pMAL-c4X′) uninduced; 7, 8: Supernatant and precipitation of Transetta (pMAL-c4X′) induced by 0.5 mmol/L IPTG; 9,10: Supernatant and precipitation of Transetta (pMAL-c4X′) induced by 1 mmol/L IPTG; 11, 12: Supernatant and precipitation of Transetta (pMAL-c4X′) induced by 1.5 mmol/L IPTG; 13,14: Supernatant and precipitation of Transetta (pMAL-c4X′) induced by 1.8 mmol/L IPTG.
2.4 重组蛋白Western blotting 鉴定
pMAL-c4X 表达的重组蛋白带有MBP标签,标签分子大小约为42.5 kDa (Nallamsettyetal., 2007)。SDS-PAGE显示纯化的重组目的蛋白分子大小约为60 kDa。以目的蛋白作为抗原,抗MBP的单抗作为一抗,HRP标记的羊抗鼠作为二抗,经Western blot鉴定(图7)。结果显示,诱导前菌体总蛋白出现3个条带,包括两条非特异性条带(100、48 kDa),纯化后只有一条目的条带(约60 kDa),纯化效果显著(图5~7)。

图5 纯化重组蛋白Fig.5 Purification of recombinant proteinM:蛋白分子量标记; 1: 流穿液; 4~9:麦芽糖洗脱液;2~3:无麦芽糖; 4~8:分别为1、2、4、8和10 mmol/L 麦芽糖洗脱液;9: 10 mmol/L 麦芽糖第2次洗脱.M: Protein molecular weight; 1: Dilution crude extract; 2-9: maltose elution; 2-3: non-maltose fraction; 4-8: 1, 2, 4, 8 and 10 mmol/L maltose elution; 9: 10 mmol/L maltose second elution.

图6 重组Salp15蛋白纯化结果Fig.6 The purification result of the recombinant Salp15M:蛋白分子量标记; 1: 浓缩纯化蛋白I.p larva5; 2:对照(牛血清白蛋白).M: Protein molecular weight; 1: Concentrated purified protein I.p larva5; 2: BSA as control.

图7 Western bolt 鉴定重组蛋白Fig.7 Determination of recombinant protein by western blotM:蛋白分子量标记; 1:诱导前菌体总蛋白; 2:诱导后菌体总蛋白; 3:纯化后蛋白.M: Protein molecular weight; 1: Uninduced cells; 2: Induced cells; 3: Purified target protein.
3 讨论
Salp15 是蜱类唾液腺一种分泌蛋白(Salivary protein 15 kDa), 最先发现于北美肩突硬蜱(GenBank登录号AF209914)。它的功能与莱姆病螺旋体的传播、定殖密切相关。现已证实它能够特异性结合CD4+T细胞的CD4分子,保护螺旋体免于被哺乳动物免疫系统识别、杀伤,并且直接抑制T细胞的激活,阻碍下游通路的开启(Anguitaetal., 2002; Gargetal., 2012)。如,导致Lck激活失败,其早期的下游信号分子LAT 和Vav1的络氨酸无法磷酸化(Juncadellaetal., 2007)。同时Salp15还特异性能与螺旋体外膜蛋白OspC 结合,有效保护螺旋体免于宿主抗体杀伤。来源于欧洲的篦子硬蜱的Salp15超家族成员Salp15 iric1既能够与其伽氏疏螺旋体B.garinii和 埃氏疏螺旋体B.afzelii结合,也能够与伯氏螺旋体北美株B.burgdorferisensustricto结合。但是,体内及体外实验证实Salp15 irc-1只能够保护B.burgdorferisensustricto免于宿主抗体杀伤,却不能够保护B.garinii和B.afzelii(Hoviusetal., 2008), 篦子硬蜱的其他Salp15超家族成员Salp15 iric2, Salp15 iric3 可能有效保护B.garinii和B.afzelii的相应地理株,促进其有效传播。由此可见,Salp15的多功能性有利于螺旋体以及蜱类共同逃避宿主的免疫系统杀伤,促进螺旋体的成功传播定殖,也有利于蜱类成功完成长期的吸血过程(约7 d左右), 是媒介与病原,哺乳动物共同进化的结果。因此,研究人员提出Salp15用作传播阻断性疫苗的构想,即,针对Salp15的非病原疫苗可有效阻断螺旋体的传播。肩突硬蜱的Salp15 与Salp25 的免疫实验证实,40%的Salp15 免疫鼠(3周后检测)能够的有效免于伯氏螺旋体B.burgdorferi的感染,而Salp25无免疫效果;将Salp15与另一种蜱类抗原OspA共同免疫小鼠,发现80%的小鼠免于感染(Daietal., 2009)。
截止目前,对于蜱类涎腺蛋白,只有肩突硬蜱的Salp15、篦子硬蜱的Salp15 iric1进行了原核或真核表达,还未见全沟硬蜱的Salp15表达及下游研究。本文对I.p larva5成功进行了原核表达,得到了大小约为60 kDa的重组蛋白。尽管该蛋白具有肽链C末端高度相似的典型特征,但氨基酸序列与已获得表达其他Salp15蛋白存在差异,其功能及其与蜱媒病原传播的关系是否存在差异还有待进一步研究。
本文获得的全沟硬蜱Salp15 超蛋白家族成员-I.p larva5,其肽链C末端与其他Salp15成员高度相似,其与肩突硬蜱核苷酸Salp15序列一致性为67.10%, 氨基酸的一致性为50%,相似性为62.3%,与Salp15 iric1 核苷酸序列一致性为66.70%,氨基酸序列的一致性为53.6%,相似性为61.6%(表1)。除了I.p larva5之外,本研究室还从全沟硬蜱中发现4条类似的Salp15蛋白(将另文发表)。此外,目前篦子硬蜱已发现有3种Salp15蛋白即iric1、iric2、iric3,分布于日本的全沟硬蜱已鉴定到2种Salp15蛋白iper1、iper2。经比较,iper1与iper2相似性为58.3%; iric1与iric2、iric3相似性分别为61.9%、60.6%,iric2与iric3相似性为69.3%(表1)。可见,Salp15不仅在不同蜱种中呈现出高度多样性,相似性从55.1%至89.1%不等,即使在同一蜱种中也呈现一定的多样性。其原因可能是(1)Salp15在蜱类中具有多种旁系同源的基因,每种基因表达一种Salp15蛋白;(2)Salp15在基因组中可能是一种基因,在转录水平经过加工,由一种前体Salp15变化为多家族的Salp15;(3)这些序列存在于转录组中,每一种产物不一定都表达,即,选择性在蛋白水平表达,或者即使表达但不一定功能完全相同。譬如,Salp15 iric1保护B.burgdorferisensustricto免于宿主抗体杀伤,却不能够保护B.garinii和B.afzelii,Salp15 iric2, Salp15 iric3可能有效保护B.garinii和B.afzelii;(4)从已知的序列来看,分布北美的肩突硬蜱、太平洋硬蜱只有一种Salp15蛋白,这可能是目前只获得了一种Salp15蛋白,其他蛋白家族成员还未有克隆。这些Salp15家族成员都具有7个半胱氨酸残基,预示着其具有复杂的高级结构和类似的功能。
