多系统萎缩患者临床表现、影像学特点及肛门、尿道括约肌肌电图改变
2013-11-23宋东东俞英欣邱峰钱海蓉姚伟李丽萍戚晓昆
宋东东 俞英欣 邱峰 钱海蓉 姚伟 李丽萍 戚晓昆
多系统萎缩(multiple system atrophy,MSA)是一种隐匿性起病,渐进性发展的神经系统多部位受累的变性病。临床主要表现为帕金森样症状、小脑性共济失调、锥体束征和自主神经功能障碍等。现已证实,少突胶质细胞内包涵体是该病的特征性病理学标志物,其主要成分是一种高度磷酸化的α-突触核蛋白[1]。根据2008年 MSA最新诊断标准[2]将其分为以帕金森样症状为主,且对左旋多巴反应欠佳的MSA-P型,以及以小脑性共济失调为主要表现的MSA-C型,二者均有自主神经系统受累。MSA临床症状复杂且多变,与多种疾病鉴别相对困难,临床误诊率较高。本研究通过对35例临床诊断为MSA患者的临床表现、神经影像学及肛门括约肌肌电图(external anal sphincter electromyography,EAS-EMG)、尿道括约肌肌电图(urethral sphincter electromyography,US-EMG)检查的结果进行分析,旨在提高对该病的认识,明确EAS-EMG、US-EMG在早期诊断中的意义,以减少漏诊及误诊的发生。
1 对象和方法
1.1 对象 收集2009-08-2013-01海军总医院神经内科门诊和住院收治的MSA患者35例,其中男15例,女20例,年龄43~76岁,平均年龄(52.17±12.01)岁,病程0.5~10年,病程中位数为3.0年,四分位数间距为1.5年。均符合2008年Gilman等[2]提出的 MSA最新诊断标准,其中MSA-P 型 12 例 (34.3%),MSA-C 型 23 例(65.7%)。
1.2 方法 由神经科医师完善病史记录、神经系统查体以及认知、情感量表筛查,并收集实验室检查、头颅MRI检查资料。认知量表采用简易智能状 况 评 估 表 (mini-mental state examination,MMSE),以及蒙特利尔认知评估量表(Montreal cognitive assessment,MoCA)中文版。情绪量表采用焦虑自评量表及抑郁自评量表评。EASEMG和US-EMG检查均由同一名有经验的技师进行操作及记录。每例患者收集10~20个波,记录放松时的自发电位,轻微收缩时的运动单位动作电位(MUPs)的时程、平均波幅、多相波的百分比和有无卫星电位等。EAS-EMG和US-EMG异常的判断标准:(1)平均时限超过10ms;(2)多相波增多>40.0%,伴有或不伴有卫星电位。同时记录大力收缩时的募集电位相型,出现单纯相为明显异常标准。
1.3 统计学处理 采用SPSS19.0软件包进行统计学处理,符合正态分布的计量资料采用均数±标准差表示,两均数间比较采用t检验,非正态分布的计量资料采用中位数和四分位数间距表示,比较采用非参数Kolmogorov-Smirnov检验。以P<0.05为差异有统计学意义。
2 结果
2.1 首发症状 以小脑功能障碍、帕金森样症状、自主神经功能障碍、全身乏力和认知障碍为首发症状者分别占31.4%、8.6%、48.5%、8.6%和2.9%。MSA-C型患者中以步态不稳、言语不清等小脑症状首发者11例(47.8%),MSA-P型患者中运动迟缓、肢体抖动等帕金森样症状首发者3例(25.0%)。具体结果见表1。
2.2 主要临床表现 MSA患者临床表现多样,多数患者可同时出现3个或3个以上系统受累表现,且全部患者均存在较为广泛的自主神经功能障碍。临床表现为小脑症状体征者占77.1%(27/35),锥体系统功能障碍者占74.3%(26/35),帕金森样症状者占45.7%(16/35)。MSA患者主要临床表现见表2。
2.3 头颅 MRI检查 23例MSA-C型患者中12例表现为脑干及小脑萎缩(小脑、脑桥、延髓体积缩小,双侧脑桥臂变细,小脑脑回变窄,脑沟增宽,第四脑室及桥小脑角等相邻脑池扩大);3例表现为全脑萎缩;5例表现为多发腔隙性脑梗死;3例未见明显异常。MSA-P患者中2例显示有中脑萎缩、脑干周围间隙扩大;2例表现为外侧裂隙高信号;4例表现为全脑萎缩;2例显示有多发腔隙性脑梗死;2例未见明显异常。
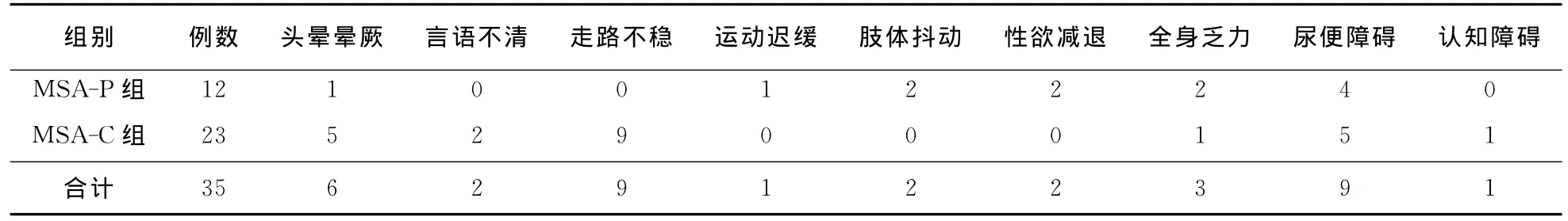
表1 MSA患者首发症状(例)
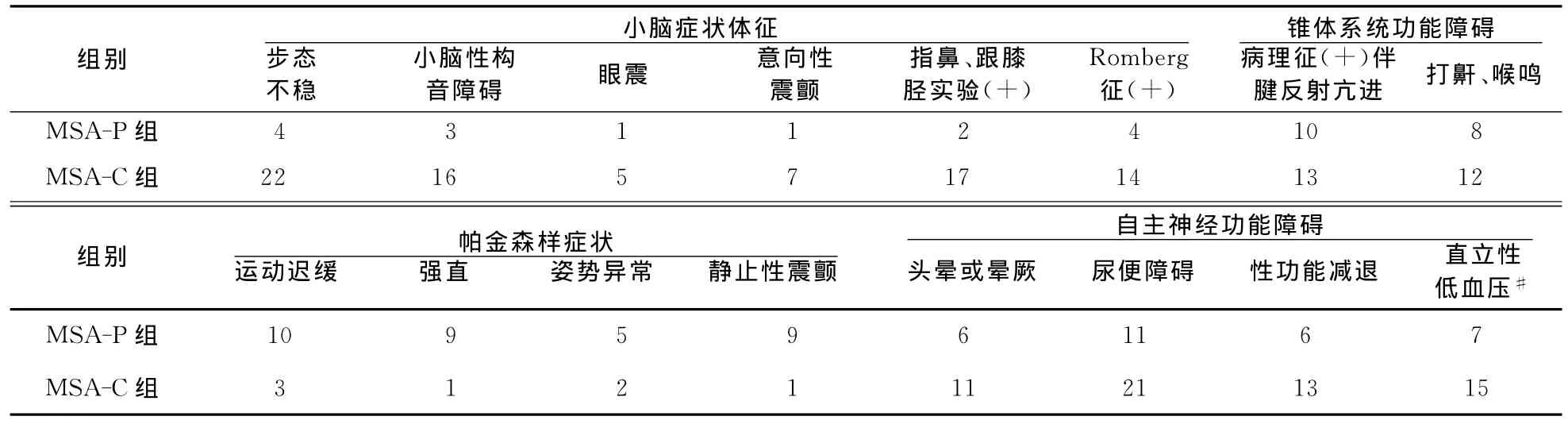
表2 MSA患者主要临床表现(例)
表3 MSA患者EAS-EMG检查结果 ()
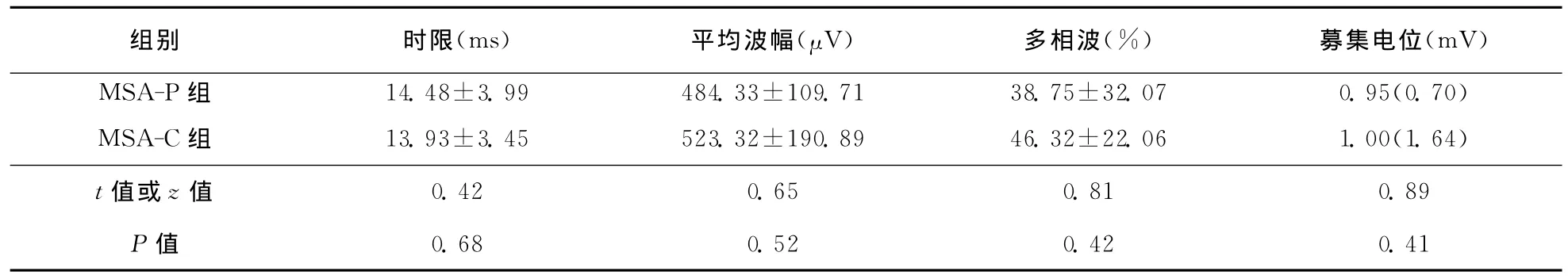
表3 MSA患者EAS-EMG检查结果 ()
组别 时限(ms) 平均波幅(μV) 多相波(%) 募集电位(mV)MSA-P组 14.48±3.99 484.33±109.71 38.75±32.07 0.95(0.70)MSA-C组 13.93±3.45 523.32±190.89 46.32±22.06 1.00(1.64)t值或z值0.42 0.65 0.81 0.89 P值0.68 0.52 0.42 0.41
表4 MSA患者US-EMG检查结果 ()
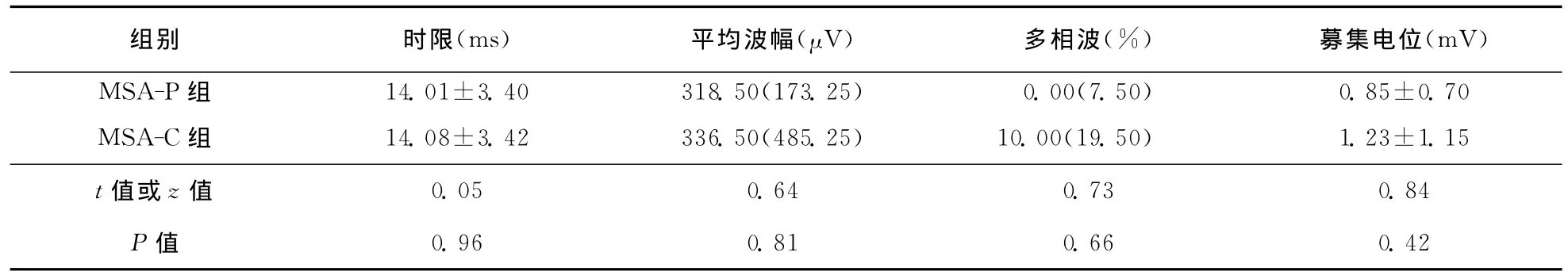
表4 MSA患者US-EMG检查结果 ()
组别 时限(ms) 平均波幅(μV) 多相波(%) 募集电位(mV)MSA-P组 14.01±3.40 318.50(173.25) 0.00(7.50)0.85±0.70 MSA-C组 14.08±3.42 336.50(485.25) 10.00(19.50) 1.23±1.15 t值或z值0.05 0.64 0.73 0.84 P值0.96 0.81 0.66 0.42
2.4 认知及情感量表 32例 MSA患者通过MMSE及MoCA量表筛查发现23例患者存在轻到中度认知功能障碍。32例患者通过焦虑、抑郁自评量表检查发现21例(65.6%)MSA患者存在轻到中度抑郁,其中13例为轻度抑郁,8例为中度抑郁;22例(68.8%)MSA患者的存在焦虑,其中16例为轻度焦虑,6例为中度焦虑。13例(40.6%)患者同时存在焦虑、抑郁情感障碍。
2.5 EAS-EMG 和 US-EMG 34 例 患 者 完 成EAS-EMG检查,其中31例患者呈神经源性受损,MUP平均时限超过10ms者30例,多相波比例>40%者19例,7例患者出现卫星电位,大力收缩募集电位中17例呈单纯相,10例呈混合相,4例呈干扰相,3例呈单混相。20例患者完成US-EMG检查,其中16例患者呈现神经源性损伤,MUP平均时限超过10ms者15例,多相波比例>40%者1例,其中2例出现卫星电位,大力收缩募集电位8例呈单纯相,9例呈混合相,2例呈单混相,1例呈干扰相。具体结果见表3、表4。
3 讨论
MSA是一种散发、神经系统多部位受累的进行性变性疾病,临床表现为帕金森样症状、小脑性共济失调和自主神经功能障碍的不同组合。2008年第2版 MSA 诊断标准[2]中,将 MSA 分为MSA-P型MSA-C型。MSA神经病理研究发现病灶主要累及皮质下区域,尤其是黒质、纹状体、下橄榄核、脑桥核和小脑等部位的神经元变性及丢失。组织学标记物是少突胶质细胞中神经胶质细胞胞质包涵体,其主要成分是α-突触核蛋白,因此MSA、帕金森病和路易体痴呆等被称为α-突触核蛋白脑病[3]。
目前关于MSA流行病学的报道并不多,MSA多以中老年发病,起病较缓慢,50岁以上人群年发病率约为3/10万,平均发病年龄约为55岁(34~83岁),其生存时间平均为6~9年,无明显性别差异[4]。根据欧洲 MSA研究小组最新报道[5],欧洲MSA患者平均发病年龄57.8岁,平均病程5.8年,其中以MSA-P型为主,占68.2%,与北美地区相关报道结果[6]一致。相反,在日本以 MSA-C型患者更为常见,Watanabe等[7]通过对230例MSA回顾研究发现MSA-C型占67.4%,MSA-P型占32.6%。MSA各亚型在不同种族间的不同分布特征可能与遗传和环境因素相关,但具体原因尚需进一步研究。
MSA特征性临床表现主要包括:对左旋多巴不敏感的帕金森样症状、小脑性共济失调、自主神经功能障碍和锥体束征。本组MSA-P型患者中以帕金森样症状为首发表现占25%(3/12),全部患者中表现为帕金森样症状者占45.7%,以运动迟缓、肌强直、静止性震颤、姿势异常为主要特点,并且对左旋多巴治疗效果不佳。MSA-C型患者主要表现为进展性的步态不稳、肢体共济失调、构音障碍及小脑性眼球运动受损等。本研究 MSA-C中以小脑症状首发占47.8%,全部患者中表现为小脑症状者占77.1%。自主神经功能障碍在两种MSA亚型中最为常见,多先于其他神经系统损伤出现。本组病例全部出现自主神经功能障碍,且以自主神经功能障碍为首发症状者占48.5%。典型的自主神经功能障碍表现为体位性低血压和以尿急、尿失禁或尿潴留为主的泌尿系功能异常[8]。由于存在直立性低血压,患者常出现头晕、虚脱或者晕厥。阳痿是男性MSA患者较早出现的临床体征,也是最重要的体征之一。本组患者中锥体系受累者占74.3%,查体显示巴宾斯基征阳性、腱反射活跃或亢进。本组20例(57.1%)患者存在打鼾、喉鸣,呼吸困难、夜间吸气性喘鸣是MSA特异性症状,提示疑核受累导致喉肌失神经支配,可出现鼾声、吸气性喘鸣及睡眠呼吸暂停,后者可能是患者夜间猝死的一个主要原因[9]。2008年 MSA诊断标准认为MSA不存在认知功能障碍,并将其作为排除MSA的标准之一。然而,近几年通过高质量的神经心理评估量表发现MSA患者存在一定的认知功能损伤。据国外文献报道,MSA合并痴呆发病率约为20%~40%,欧美地区以MSA-P型为主,亚洲人群多以MSA-C型为主[10]。目前国内尚无MSA认知障碍系统性研究的报道。本研究通过对32例MSA患者进行MMSE及MoCA量表筛查,71.9%的患者存在轻到中度认知功能障碍。对于MSA患者出现的认知障碍及情感障碍应引起临床工作者的重视,及早干预和治疗可提高患者的生活质量。
磁共振成像检查是诊断MSA的主要辅助手段。典型MSA-P型表现为壳核萎缩,T2WI上壳核背外部带状低信号,外侧缘裂隙样高信号。MSA-C型主要表现为小脑蚓部萎缩,其次小脑半球、小脑中脚、脑桥和延髓萎缩,桥延池和第四脑室扩大,T2WI会出现上对称性高信号,部分出现脑桥“十字征”。这种壳核外侧缘裂隙样高信号和脑桥“十字征”样高信号对诊断 MSA具有极高的价值。但早期MSA影像学表现多不典型,甚至正常,在临床工作中容易造成误诊。
MSA早期临床运动障碍多不突出,而自主神经障碍等非运动障碍多出现较早。本组病例48.5%患者以自主神经障碍为首发症状,其中尿便障碍表现更为突出。在一篇关于梅奥医学院的文献中[11],膀胱功能受累占89%(尿失禁44.4%、尿潴留26%、尿频18.5%),直肠功能障碍77%(便秘46%、大便失禁27%)。本组病例91.4%(32/35)患者尿便系统受累,与国外文献报道基本一致。骶髓前角细胞中的Onuf核是调控膀胱和直肠括约肌的自主神经中枢,通过 EAS-EMG和 USEMG检查可反映Onuf核神经元脱失[12]。本研究中,经 EAS-EMG 检 查 显 示 91.2% (31/34)的MSA患者出现不同程度的神经源性损害改变,US-EMG检查显示80.0%(16/20)的患者出现不同程度的神经源性损害改变,这一结果与国内外相关报道基本一致[13-17]。另外,本研究发现 MSA-P型与 MSA-C型之间EAS-EMG、US-EMG比较并无统计学差异,且受累程度一致。但两组肌电图卫星电位阳性率略低于目前国内文献报道,可能与本组患者病程短有关。总之EAS-EMG和US-EMG是MSA的早期诊断重要的检查手段。
综上所述,MSA患者多系统受累,临床症状复杂多样,各亚型之间临床表现相互交叉,EASEMG和US-EMG检查有助于早期诊断和治疗,减少误诊和漏诊,从而延长患者生存时间,改善生活质量。
[1]Trojanowski JQ,Revesz T.Proposed neuropathological criteria for the post mortem diagnosis of multiple system atrophy[J].Neuropathol Appl Neurobiol,2007,33(6):615-620.
[2]Gilman S,Wenning GK,Low PA,et al.Second consensus statement on the diagnosis of multiple system atrophy [J].Neurology,2008,71(9):670-676.
[3]Jellinger KA,Lantos PL.Papp-Lantos inclusions and the pathogenesis of multiple system atrophy:an update[J].Acta Neuropathol,2010,119(6):657-667.
[4]Papapetropoulos S,Tuchman A,Laufer D,et al.Causes of death in multiple system atrophy[J].J Neurol Neurosurg Psychiatry,2007,78(3):327-329.
[5]Kollensperger M,Geser F,Ndayisaba JP,et al.Presentation,diagnosis,and management of multiple system atrophy in Europe:final analysis of the European multiple system atrophy registry[J].Mov Disord,2010,25(15):2604-2612.
[6]Gilman S,May SJ,Shults CW,et al.The North American Multiple System Atrophy Study Group[J].J Neural Transm,2005,112(12):1687-1694.
[7]Watanabe H,Saito Y,Terao S,et al.Progression and prognosis in multiple system atrophy:an analysis of 230Japanese patients[J].Brain,2002,125(Pt 5):1070-1083.
[8]Yamamoto T,Sakakibara R,Uchiyama T,et al.Questionnaire-based assessment of pelvic organ dysfunction in multiple system atrophy[J].Mov Disord,2009,24(7):972-978.
[9]Shimohata T,Ozawa T,Nakayama H,et al.Frequency of nocturnal sudden death in patients with multiple system atrophy[J].J Neurol,2008,255(10):1483-1485.
[10]Brown RG,Lacomblez L,Landwehrmeyer BG,et al.Cognitive impairment in patients with multiple system atrophy and progressive supranuclear palsy[J].Brain,2010,133(8):2382-2393.
[11]Iodice V,Lipp A,Ahlskog JE,et al.Autopsy confirmed multiple system atrophy cases:Mayo experience and role of autonomic function tests[J].J Neurol Neurosurg Psychiatry,2012,83:453-459.
[12]Yamamoto T,Sakakibara R,Uchiyama T,et al.When is Onuf’s nucleus involved in multiple system atrophy?A sphincter electromyography study[J].J Neurol Neurosurg Psychiatry,2005,76(12):1645-1648.
[13]戚晓昆,邱峰,李丽萍,等.肛门括约肌肌电图在鉴别诊断多系统萎缩、帕金森病及晚发型脊髓小脑共济失调中的作用[J].中华神经科杂志,2011,44(2):105-108.
[14]Podnar S,Fowler CJ.Sphincter electromyography in diagnosis of multiple system atrophy:technical issues[J].Muscle Nerve,2004,29(1):151-156.
[15]戚晓昆,李丽萍,邱峰等.尿道括约肌肌电图对多系统萎缩的诊断价值[J].中华内科杂志,2012,51(12):975-977.
[16]Winge K,Jennum P,Lokkegaard A,et al.Anal sphincter EMG in the diagnosis of parkinsonian syndromes[J].Acta Neurol Scand,2010,121(3):198-203.
[17]Hansen J,Borau A,Rodriguez A,et al.Urethral sphincter EMG as event detector for Neurogenic detrusor overactivity[J].IEEE Trans Biomed Eng,2007,54(7):1212-1219.
