有氧运动对衰老大鼠骨骼肌细胞凋亡及Bcl-2和Bax表达的影响
2013-11-22刘宁宁李明学金雯
刘宁宁,李明学,金雯
(江苏大学1.基础医学与医学技术学院,2.体育部,江苏 镇江212013)
骨骼肌是人体重要的运动器官,其机能的下降是衰老的重要标志。骨骼肌衰老时,最大肌力与肌肉最大输出功率明显下降,主要与骨骼肌萎缩有关[1]。肌纤维总数不断下降,从而产生不可逆转的衰老性肌肉萎缩。从分子水平而言,肌纤维数目的减少是由于细胞凋亡而引起的[2]。增龄过程中,线粒体功能紊乱,导致肌细胞凋亡速度加快,肌纤维数量下降[3]。因此,可采取有效措施来降低骨骼肌细胞的凋亡,从而延缓肌肉衰老的发生发展。本文通过研究有氧运动对衰老模型大鼠骨骼肌细胞凋亡及Bcl-2和Bax蛋白表达的影响,来探讨有氧运动延缓骨骼肌细胞衰老的作用机制。
1 材料与方法
1.1 试剂
D-半乳糖(Sigma公司),Bax单克隆抗体、Bcl-2单克隆抗体(Santa Cruz公司);HRP-羊抗大鼠IgG(北京中杉金桥生物技术有限公司);增强发光剂试剂盒(Amersham Biosciences公司);TUNEL检测试剂盒(武汉博士德生物工程有限公司)。
1.2 实验动物
21月龄雌性SD大鼠8只(老年对照组),体质量(400±10)g;3月龄雌性SD大鼠40只,体质量(200±10)g。所有大鼠均由江苏大学医学实验动物中心提供。分笼饲养,每笼8只,饲以标准啮齿类动物饲料,不限制饮食,自由饮水,室温18~23℃,相对湿度41% ~57%,适应性饲养1周后建造模型。
1.3 实验分组及运动训练
将40只3月龄雌性SD大鼠随机分成青年对照组(n=8)和衰老模型组(n=32),采用D-半乳糖腹部皮下注射法建立衰老模型[4-5]。用生理盐水将D-半乳糖配置成5%的注射液,衰老模型组大鼠每天注射1次(500 mg/kg),青年对照组则每天注射相应剂量的生理盐水,连续注射6周。末次注射后,禁食12 h,分别处死青年对照组8只、老年对照组8只和衰老模型组(随机选取8只)。
剩余的衰老模型组SD大鼠随机分为3组,每组8只,分别为衰老模型对照组,3次/周运动组,6次/周运动组。运动采取无负重游泳的方式,水温为(32±1)℃,水深为60 cm,并确保其不停地游泳。对照组则放入同样温度的浅水中。运动组首次游泳时间为30 min,然后以10 min/d递加,直到90 min,以后保持不变。每次游泳结束后,用吹风机吹干大鼠皮毛,共训练12周。
1.4 标本收集
造模结束时,分别取青年对照组、老年对照组和衰老模型组大鼠的左心室游离壁全层的心肌组织,用4%低聚甲醛固定24 h,再用蔗糖沉淀过夜。然后制作冰冻切片,厚度为10 μm,每个标本取不连续的2张,采用TUNEL法检测细胞凋亡情况,判断模型建造情况。运动结束时,分别取衰老模型对照组及2组运动组大鼠的腓肠肌组织,各分成2份,一份同上述操作,用于TUNEL法检测细胞凋亡情况;另一份则立刻-70℃冻存,用于蛋白质检测。
1.5 TUNEL法检测细胞凋亡
按照TUNEL法检测细胞凋亡试剂盒的说明进行操作,然后于显微镜下观察计数。呈蓝色的为正常细胞,呈棕黄色的为凋亡细胞。每张切片选取5个高倍视野(×400),对凋亡阳性细胞进行计数,每只大鼠取2张切片。根据公式:细胞凋亡指数=凋亡阳性细胞数/总细胞数,计算细胞凋亡指数。
1.6 免疫印迹法检测蛋白表达
制备蛋白样品:取冻存的骨骼肌标本100 mg,加细胞裂解液1 mL,PMSF,蛋白酶抑制剂,磷酸酶抑制剂各10 μL,置匀浆器于冰上匀浆30 min。然后,4℃离心,12 000×g,15 min。取上清,测定蛋白含量,再加入等体积的2×上样缓冲液,混匀后煮沸3 min,-20℃保存备用。蛋白检测:配制SDS-PAGE;每孔30 μg总蛋白量上样;电泳;转膜,一抗为1∶400的鼠抗Bax(Bcl-2)单克隆抗体,二抗为1∶5 000的HRP-羊抗鼠IgG;曝光;用ECL发光剂显色。
1.7 统计学处理
采用SPSS 13.0统计分析软件,数据以均数±标准差(±s)表示,多组间均数比较采用单因素方差分析,进一步两两比较采用 LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 衰老模型制备的结果
TUNEL染色结果显示(图1),与青年对照组比较,老年对照组及衰老模型组的凋亡心肌细胞明显增多,老年对照组的凋亡细胞与衰老模型组比较,差异无统计学意义。老年对照组(33.692±2.766)与衰老模型组(34.146±2.931)的心肌细胞凋亡指数均显著高于青年对照组(4.132±0.308),P均<0.05。衰老模型组的心肌细胞凋亡指数与老年对照组比较,差异无统计学意义(t=3.296,P=0.734)。

图1 不同组大鼠心肌细胞TUNEL染色(×400)Fig 1 TUNEL staining of myocytes in different groups
2.2 骨骼肌细胞凋亡和Bcl-2、Bax的表达
与衰老模型对照组比较,3次/周运动组和6次/周运动组的骨骼肌细胞凋亡指数和Bax蛋白的表达均明显降低,而Bcl-2蛋白的表达和Bcl-2与Bax比值明显升高;与6次/周运动组相比,3次/周运动组骨骼肌细胞凋亡指数(t=2.928,P<0.05)和 Bax的表达(t=3.478,P<0.05)明显降低,而Bcl-2表达(t=3.045,P<0.05)和 Bcl-2与Bax比值明显升高(t=4.643,P<0.05)。见图2、图 3、表 1。
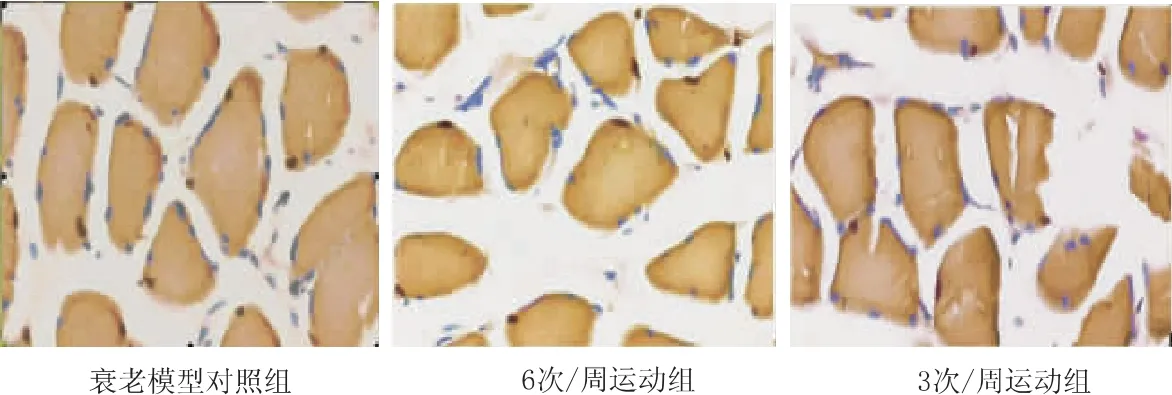
图2 不同组大鼠骨骼肌细胞TUNEL染色(×400)Fig 2 TUNEL staining of skeletal muscle cells in different groups
表1 不同组骨骼肌细胞凋亡指数和Bcl-2、Bax蛋白的表达±sTab 1 Apoptosis index of skeletal muscle and exprssions of Bcl-2 and Bax in different groups

表1 不同组骨骼肌细胞凋亡指数和Bcl-2、Bax蛋白的表达±sTab 1 Apoptosis index of skeletal muscle and exprssions of Bcl-2 and Bax in different groups
a:P<0.01,与对照组比较;b:P<0.05,与6次/周运动组比较
±0.031 6次/周运动组(n=8) 44.680±2.060a 0.787±0.052a 0.877±0.025a 0.693±0.025a 3 次/周运动组(n=8) 41.130 ±2.175a,b 0.850 ±0.054a,b 0.790 ±0.014a,b 0.743 ±0.015a,b F值 8.452 10.348 16.756 5.639 P值/% Bcl-2 Bax Bcl-2/Bax对照组(n=8) 48.960±4.163 0.590±0.031 1.053±0.042 0.620组别 凋亡指数0.007 0.006 0.004 0.009

图3 免疫印迹法检测Bcl-2和Bax蛋白的表达Fig 3 Western blot analysis of protein expressions of Bcl-2 and Bax
3 讨论
D-半乳糖致衰老模型是我国学者基于衰老的代谢学说而复制的模型,系在一定的时间内给动物连续注射D-半乳糖,使其细胞内浓度增高,经醛糖还原酶催化形成半乳糖醇,后者不能被进一步代谢而堆积于细胞内,影响细胞渗透压,导致细胞肿胀,功能障碍,代谢紊乱,最终致机体衰老。尹彤等[6]将自然衰老小鼠与D-半乳糖致衰老小鼠的重要脏器形态进行比较,结果显示,D-半乳糖致衰老小鼠心脏病理组织学与自然衰老小鼠相似。Kajstura等[7]研究指出,24月龄小鼠的左心室心肌细胞凋亡发生率较16月龄小鼠增加了近2倍。这种心肌细胞凋亡随龄性增加的现象,导致衰老小鼠的心肌细胞比青年小鼠减少了30%[7]。因此,衰老与否,可以用心肌细胞的凋亡来检测,因其发生率随年龄增加而增加,并且该现象仅局限于左心室的游离壁心肌细胞。本实验对青年对照组大鼠、衰老模型组大鼠及老年对照组大鼠采用TUNEL法进行心肌细胞凋亡检测。结果显示,衰老模型组大鼠与老年对照组大鼠的心肌细胞凋亡指数均明显高于青年对照组大鼠,且两者比较相似,表明衰老模型大鼠可代替自然衰老大鼠进行本实验的研究。
细胞凋亡是受多基因严格控制的过程,这些基因在种属之间非常保守,如Bcl-2家族、caspase家族、癌基因家族包括C-myc、抑癌基因P53等。Bcl-2家族蛋白在线粒体介导的凋亡通路中起重要调节作用,可分为2类:一类是抗凋亡,另一类是促凋亡。其中,Bcl-2和Bax这一对功能基因在细胞凋亡过程中起关键作用,两者水平的高低与细胞凋亡直接相关。Bax增高,促进细胞凋亡;Bcl-2增高,则抑制细胞凋亡。Bax与Bcl-2两者间的比例是决定细胞凋亡与否的关键因素[8]。Bax/Bcl-2>1时,细胞趋向于凋亡;Bax/Bcl-2<1时,细胞趋向于存活。随着年龄的增加,增多的活性氧等物质可诱导促凋亡蛋白Bax与Bcl-2结合的复合物解离并转运至线粒体,使线粒体膜形成孔洞,释放出细胞色素C,从而激活整个凋亡途径[9]。吴薇等[10]的研究显示,衰老小鼠的 Bcl-2 表达减少,Bax表达升高,Bax/Bcl-2比例升高,提示Bcl-2蛋白家族介导的凋亡通路被激活,线粒体膜的完整性被破坏,释放出促凋亡物质,促进细胞的凋亡。
运动训练与细胞凋亡关系的实验表明,适宜的运动强度不会引起细胞凋亡的增加;而力竭运动和超负荷运动时,大鼠细胞凋亡数量显著增加,且运动强度与细胞凋亡的程度成正相关[11]。有氧运动可改变Bcl-2/Bax比值,从而影响骨骼肌细胞的凋亡。Song等[12]研究发现,老年大鼠在进行了12周的跑台耐力训练后,比目鱼肌和腓肠肌中抗凋亡基因Bcl-2表达较对照组大鼠显著增加,而Bax及Bax/Bcl-2比值均降低,比目鱼肌和腓肠肌细胞凋亡指数随之降低。Marzetti等[13]研究发现,28月龄的雄性Fischer 344大鼠骨骼肌凋亡率较8月龄雄性Fischer 344大鼠增加20.3%,而经过4周的跑台运动后,其骨骼肌细胞凋亡指数降低。Siu等[14]对成年SD大鼠进行8周中等强度的运动训练后,检测Bax和Bcl-2蛋白的表达情况,结果显示,8周后运动组大鼠比目鱼肌中Bcl-2表达较对照组增加,而Bax则较对照组下降。本研究表明,运动组经过12周的有氧运动训练后,均出现Bax蛋白表达下降,Bcl-2蛋白表达、Bcl-2/Bax比值升高,骨骼肌细胞凋亡指数降低,且3次/周运动组的骨骼肌细胞凋亡指数较6次/周运动组下降得更明显,这说明隔日运动更有利于延缓骨骼肌细胞衰老。
综上所述,长期有氧运动可以降低骨骼肌细胞凋亡,可能是由于有氧运动造成骨骼肌细胞中Bax、Bcl-2蛋白表达的变化而引起的。
[1] Kirkendall DT,Garrett WE Jr.The effects of aging and training on skeletal muscle [J].Am J Sports Med,1998,26(4):598-602.
[2] Dirks A,Leeuwenburgh C.Apoptosis in skeletal muscle with aging[J].Am J Physiol Regul Integr Comp Physiol,2002,282(2):R519 - R527.
[3] 王怀颖,郝岩君,苏佳.细胞凋亡与衰老[J].中国老年学杂志,2009,29(10):1315-1317.
[4] 徐智,吴国明,钱桂生,等.大鼠衰老模型的初步建立[J].第三军医大学学报,2003,25(4):312-315.
[5] 王少康,孙桂菊,张建新,等.亚急性衰老动物模型的建立及评价[J].东南大学学报:医学版,2002,21(3):217-219.
[6] 尹彤,徐斌,朱庆磊,等.自然衰老与半乳糖催老小鼠重要脏器的形态学差异[J].中国临床康复,2004,8(36):8248 -8249,8266.
[7] Kajstura J,Cheng W,Sarangarajan R,et al.Necrotic and apoptotic myocyte cell death in the aging heart of Fischer 344 rats[J].Am J Physiol,1996,271(3):H1215-H1228.
[8] Neuzil J,Wang XF,Dong LF,et al.Molecular mechanism of‘mitocan’-induced apoptosis in cancer cells epitomizes the multiple roles of reactive oxygen species and Bcl-2 family proteins[J].FEBS Lett,2006,580(22):5125-5129.
[9] Kwak HB,Song W,Lawler JM.Exercise training attenuates age-induced elevation in Bax/Bcl-2 ratio,apoptosis,and remodeling in the rat heart[J].FASEB J,2006,20(6):791-793.
[10] 吴薇,李欣.不同运动方式对衰老小鼠心肌细胞凋亡的影响[J].天津体育学院学报,2009,24(6):522-525.
[11] Peterson JM,Bryner RW,Sindler A,et al.Mitochondrial apoptotic signaling is elevated in cardiac but not skeletal muscle in the obese Zucker rat and is reduced with aerobic exercise[J].J Appl Physiol,2008,105(6):1934 -1943.
[12] Song W,Kwak HB,Lawler JM.Exercise training attenuates age-induced changes in apoptotic signaling in rat skeletal muscle[J].Antioxid Redox Signal,2006,8(3/4):517-528.
[13] Marzetti E,Groban L,Wohlgemuth SE,et al.Effects of short-term GH supplementation and treadmill exercise training on physical performance and skeletal muscle apoptosis in old rats[J].Am J Physiol Regul Integr Comp Physiol,2008,294(2):R558 - R567.
[14] Siu PM,Bryner RW,Martyn JK,et al.Apoptotic adaptation from exercise training in skeletal and cardiac muscles[J].FASEB J,2004,18(10):1150 -1152.
