碱性硅酸钠溶液的恒压热容
2013-11-21肖刘萍满雪玉刘士军
杨 俊,肖刘萍, 满雪玉,刘士军
(中南大学化学化工学院,中南大学有色金属资源化学教育部重点实验室,中国 长沙 410083)
硅和铝分别是地壳中第二及第三丰富的元素,也是地球生态最重要的元素.许多自然界过程如矿物形成、岩浆沉积、地下水循环、及植物生长等都与硅酸盐及铝酸盐溶液有关;而铝冶金、分子筛及各种材料制备、造纸、采油等众多工业领域与硅酸钠溶液及铝酸钠溶液更是密切相关[1-6].在铝冶金中,硅酸钠溶液与铝酸钠溶液反应生成钠硅渣而达到除硅的目的,但同时易在换热器及管道内结垢;硅铝分子筛的结构在很大程度上取决于硅酸钠溶液的性质.因此硅酸钠溶液的热力学性质对地球化学的研究及相关生产工艺的设计与优化具有重要的理论意义.
在硅酸钠溶液体系中,存在硅酸根离子的质子化及聚合等复杂的相互作用,其溶液结构与浓度、pH值、温度等因素密切相关,但在高碱性条件下,一般都认为单硅酸根是主要组分[7-11].这些复杂的相互作用使得硅酸钠溶液的热力学性质具有异于普通电解质溶液的规律,其相关的研究虽比较困难,但也得到人们的重视[9-14 ].这些研究主要集中在溶解度、溶液中各组分的活度、及相关热力学模型等方面,而关于硅酸钠溶液热容的研究还未见文献报道.
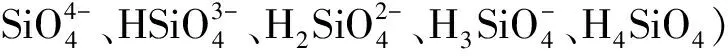
本文用C80微热量计步进升温的方法测定了一系列不同模数及不同浓度的碱性硅酸钠溶液(NaOH-Na2SiO3-H2O)在298 K~363 K范围内的恒压热容,并建立了该溶液体系恒压热容随总浓度、模数及温度变化的模型方程,可为相关工艺设计及优化提供基础数据.
1 实验部分
1.1 试剂和量热仪器
NaOH(s)(天津试剂三厂),偏硅酸钠Na2SiO3·9H2O(s)(天津市光复精细化工研究所)均为优级纯试剂.NaOH(aq)储备液根据文献[15]配制,其质量分数根据GB629-81(84)由标准盐酸滴定,3次平行滴定的相对偏差小于0.1%,碳酸钠的含量低于总碱度的0.1%.Na2SiO3(aq)储备液浓度根据GB/T 4209-2008由标准盐酸滴定,3次平行滴定的相对偏差小于0.3%.待测样品溶液由已知浓度的Na2SiO3(aq)储备液、NaOH (aq) 储备液和高纯水三者按确定的比例混合而成.实验用水皆为超纯水系统Synergy UV纯化所得的高纯水(电导率小于1×10-4S/m).
热容测定采用C80微量热量计(Setaram,法国).该热量计恒温稳定性为±0.001 K;分辨率为0.1 μW.测定前用焦耳校正法对仪器进行校正.采用步进升温模式[16]测量样品溶液的升温焓变,每次升温5 K,升温速率0.25 K·min-1,基线维持1 h后继续升温.为避免强碱性待测溶液对样品池的腐蚀,加入一个与池内壁紧密贴在一起聚乙烯塑料内衬保护管.测量过程中的参比池为空白,样品池中装入5~6 g的样品溶液,压强为大气压.
1.2 实验原理和方法
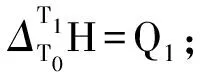
(1)
(2)
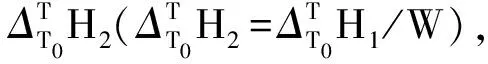
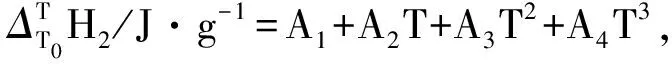
(3)
式中Ai(i=1,2,3,4)是方程的回归系数.则对式(3)求导,即得到样品的恒压热容方程;
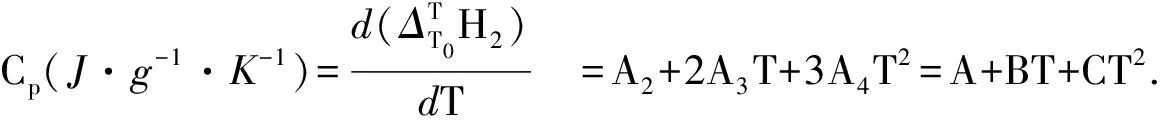
(4)
2 结果与讨论
2.1 恒压热容测量的可靠性检验
表1 水的恒压热容实验值Cp和文献
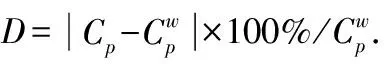
从表1的结果可见,测量结果与文献值的相对偏差小于0.6%,表明本文所采用的实验方法及仪器可靠.
2.2 碱性硅酸钠溶液体系的恒压热容
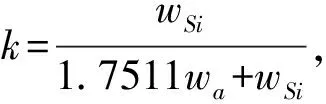
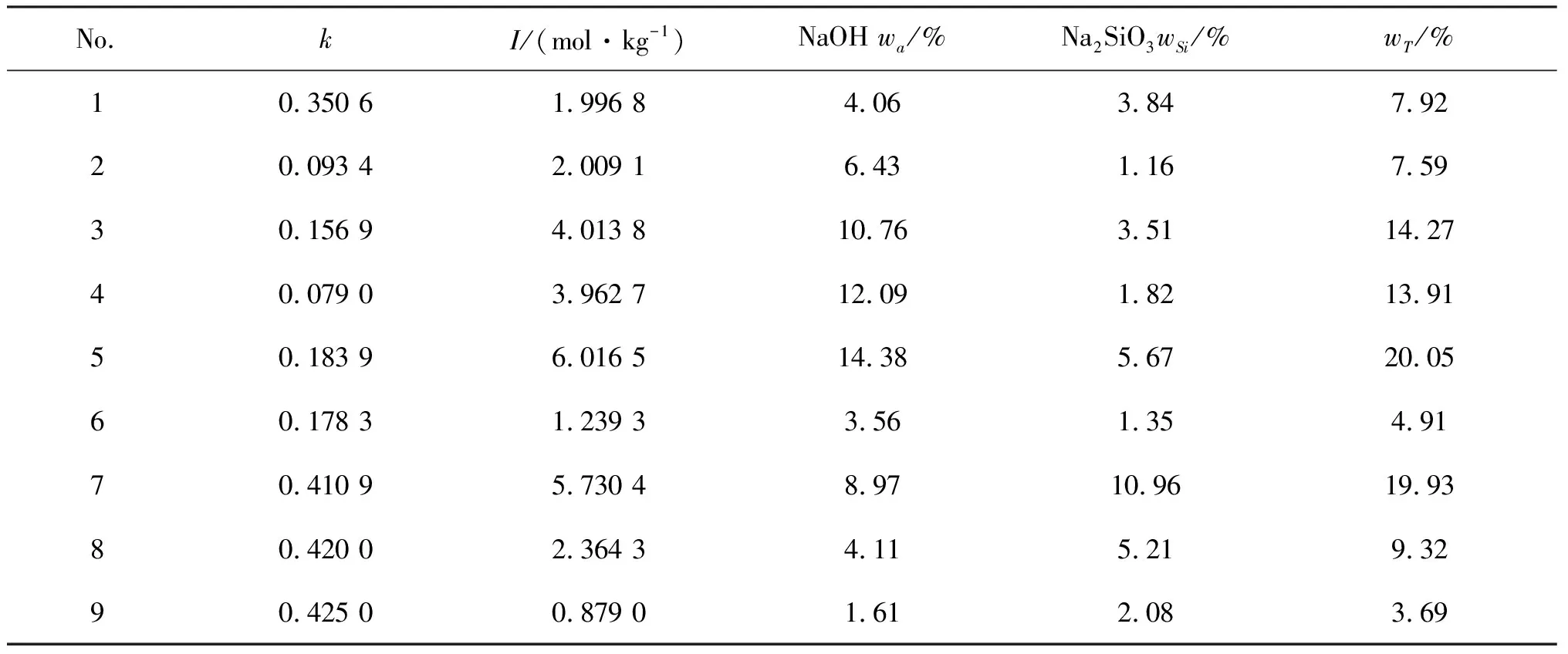
表2 样品溶液的组成*(1 kg溶剂)
*根据简化的NaOH-Na2SiO3-H2O三元溶液体系确定的组成.
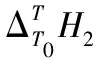
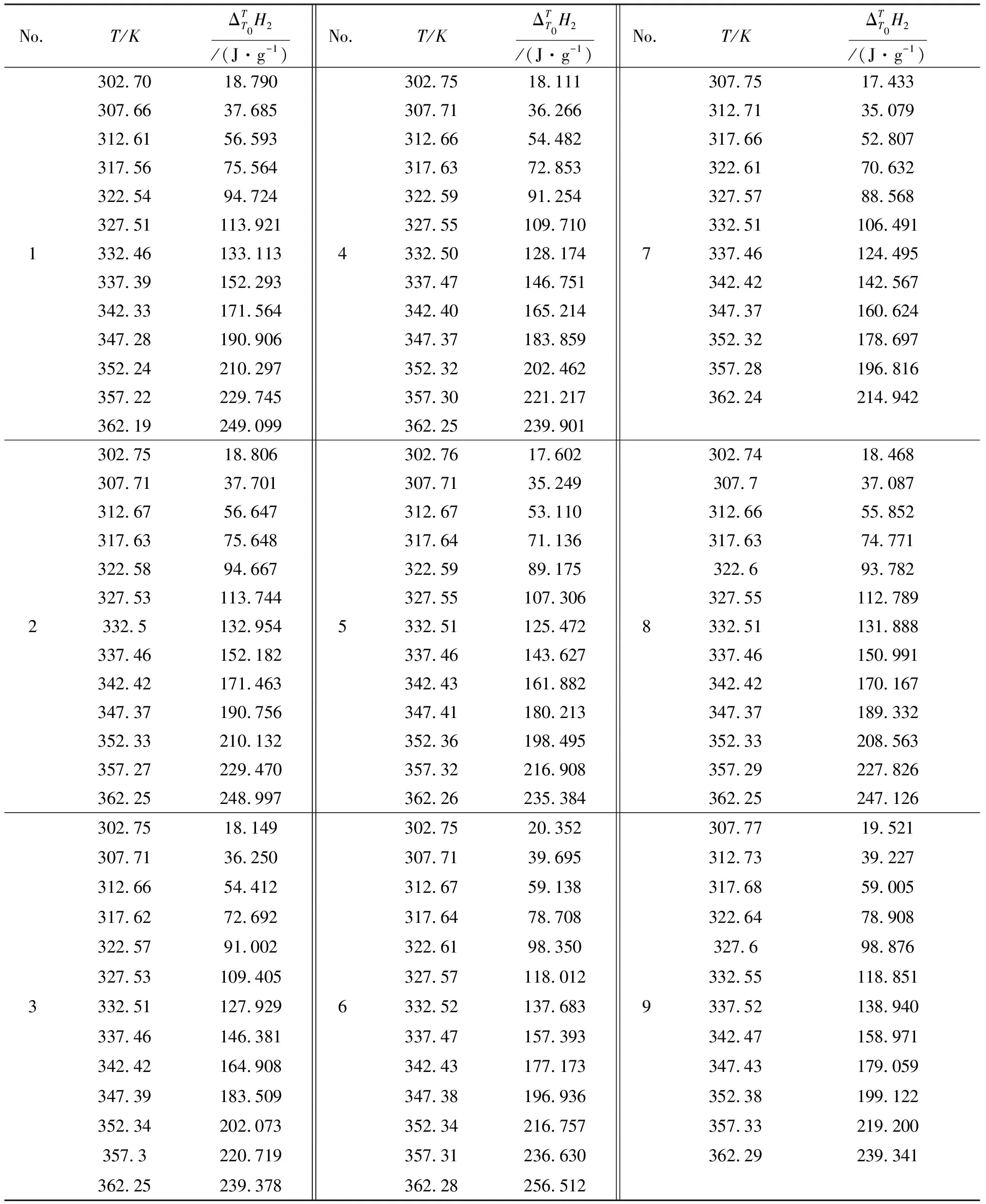
No.T/KΔTT0H2/(J·g-1)No.T/KΔTT0H2/(J·g-1)No.T/KΔTT0H2/(J·g-1)302.7018.790302.7518.111307.7517.433307.6637.685307.7136.266312.7135.079312.6156.593312.6654.482317.6652.807317.5675.564317.6372.853322.6170.632322.5494.724322.5991.254327.5788.568327.51113.921327.55109.710332.51106.4911332.46133.1134332.50128.1747337.46124.495337.39152.293337.47146.751342.42142.567342.33171.564342.40165.214347.37160.624347.28190.906347.37183.859352.32178.697352.24210.297352.32202.462357.28196.816357.22229.745357.30221.217362.24214.942362.19249.099362.25239.901302.7518.806302.7617.602302.7418.468307.7137.701307.7135.249307.737.087312.6756.647312.6753.110312.6655.852317.6375.648317.6471.136317.6374.771322.5894.667322.5989.175322.693.782327.53113.744327.55107.306327.55112.7892332.5132.9545332.51125.4728332.51131.888337.46152.182337.46143.627337.46150.991342.42171.463342.43161.882342.42170.167347.37190.756347.41180.213347.37189.332352.33210.132352.36198.495352.33208.563357.27229.470357.32216.908357.29227.826362.25248.997362.26235.384362.25247.126302.7518.149302.7520.352307.7719.521307.7136.250307.7139.695312.7339.227312.6654.412312.6759.138317.6859.005317.6272.692317.6478.708322.6478.908322.5791.002322.6198.350327.698.876327.53109.405327.57118.012332.55118.8513332.51127.9296332.52137.6839337.52138.940337.46146.381337.47157.393342.47158.971342.42164.908342.43177.173347.43179.059347.39183.509347.38196.936352.38199.122352.34202.073352.34216.757357.33219.200357.3220.719357.31236.630362.29239.341362.25239.378362.28256.512
注:1.T0=297.77 K,k=0.350 6,I=1.996 8 mol·kg-1;2.T0=297.79 K,k=0.093 4,I=2.009 1 mol·kg-1;3.T0=297.80 K,k=0.156 9,I=4.013 8 mol·kg-1;4.T0=297.78 K,k=0.079 01,I=3.962 7 mol·kg-1;5.T0=297.78 K,k=0.183 9,I=6.016 5 mol·kg-1;6.T0=297.72 K,k=0.178 3,I=1.239 3 mol·kg-1;7.T0=302.80 K,k=0.410 9,I=5.730 4 mol·kg-1;8.T0=297.78 K,k=0.420 0,I=2.364 3 mol·kg-1;9.T0=302.81 K,k=0.425 0,I=0.879 0 mol·kg-1.
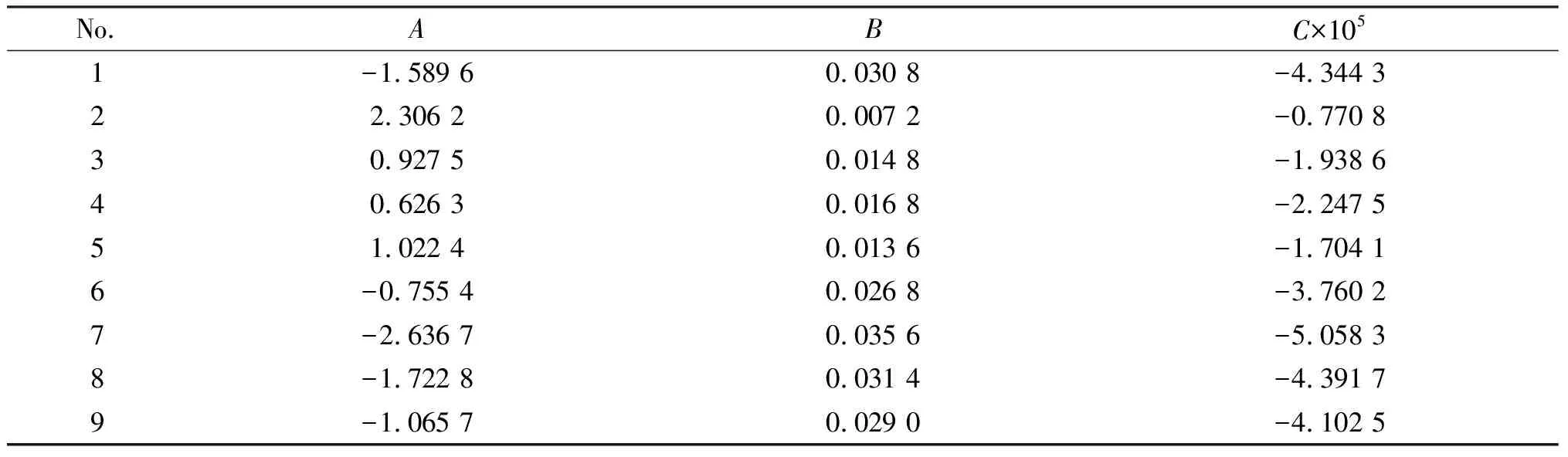
表4 样品溶液热容方程(4)的系数
各样品溶液的热容随温度的变化关系如图2所示.从图2可见,各样品溶液的热容随温度的升高而增加,但部分样品的热容在较高温度下有下降的趋势.
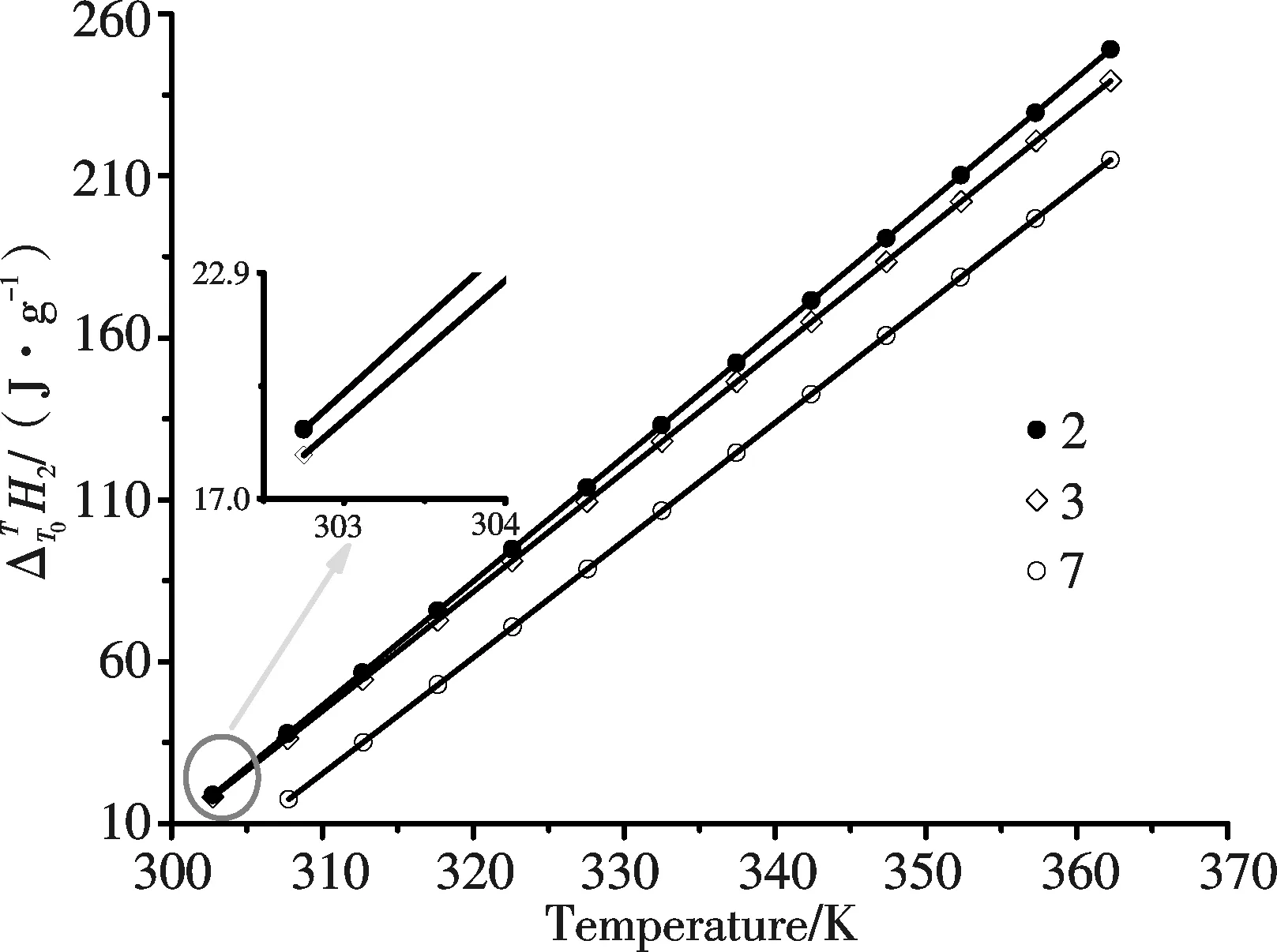
图1 样品溶液的关系
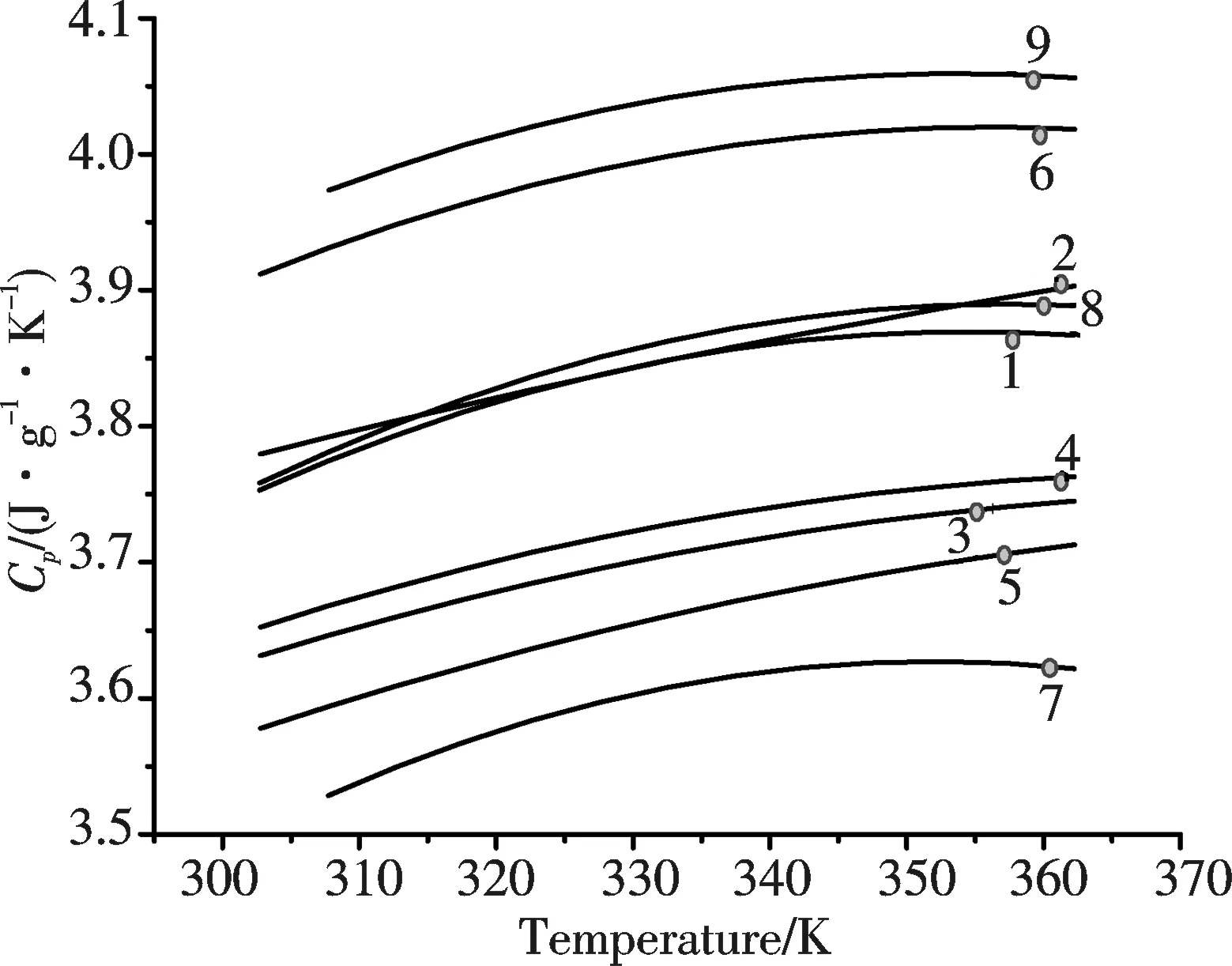
图2 各样品溶液的热容曲线Fig.2 Curves of Cp~T
2.3 溶质的总量对溶液热容的影响
在确定温度下(如308 K及358 K),碱性硅酸钠溶液的恒压热容随溶质总质量分数(wT)的变化关系如图3所示,其它温度时的变化趋势大致相同.
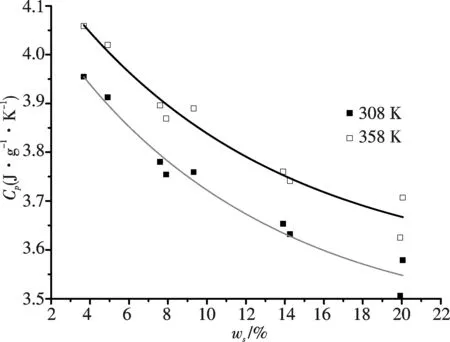
图3 热容与溶质总量(wT)的关系 Fig.3 Relationship between heat capacities and mass fraction of the solutes
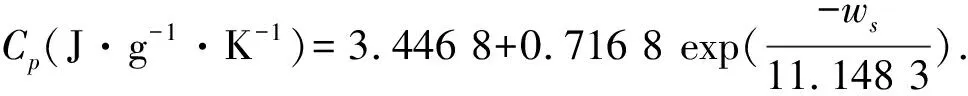
2.4 溶液的恒压热容与温度及组分含量的关系
为了确定碱性硅酸钠溶液的恒压热容与NaOH的质量分数(wa)、Na2SiO3的质量分数(wSi)、及温度的定量关系,作者进行了模型研究,即将各样品溶液在不同温度点的热容值对相应溶液的wa、wSi及温度按不同的模型函数进行回归.计算发现,以下模型方程能较好表达实验结果,
(5)
式中k0,ki和pj为相应的回归系数,其结果列于表5.
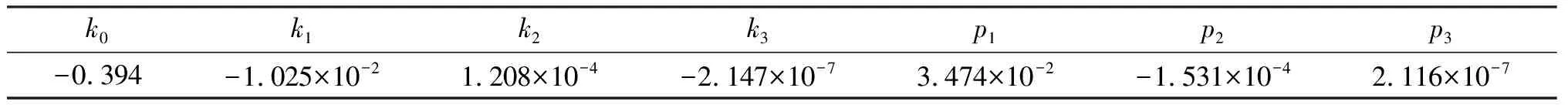
表5 模型方程(5)的系数
式(5)的计算值(Cp,mod)与相应条件下的测量值(Cp,exp)比较,其相对偏差都在1.5%以内,表明方程(5)能较好地表达碱性硅酸钠溶液的恒压热容与NaOH的质量分数、Na2SiO3的质量分数及温度的定量关系.
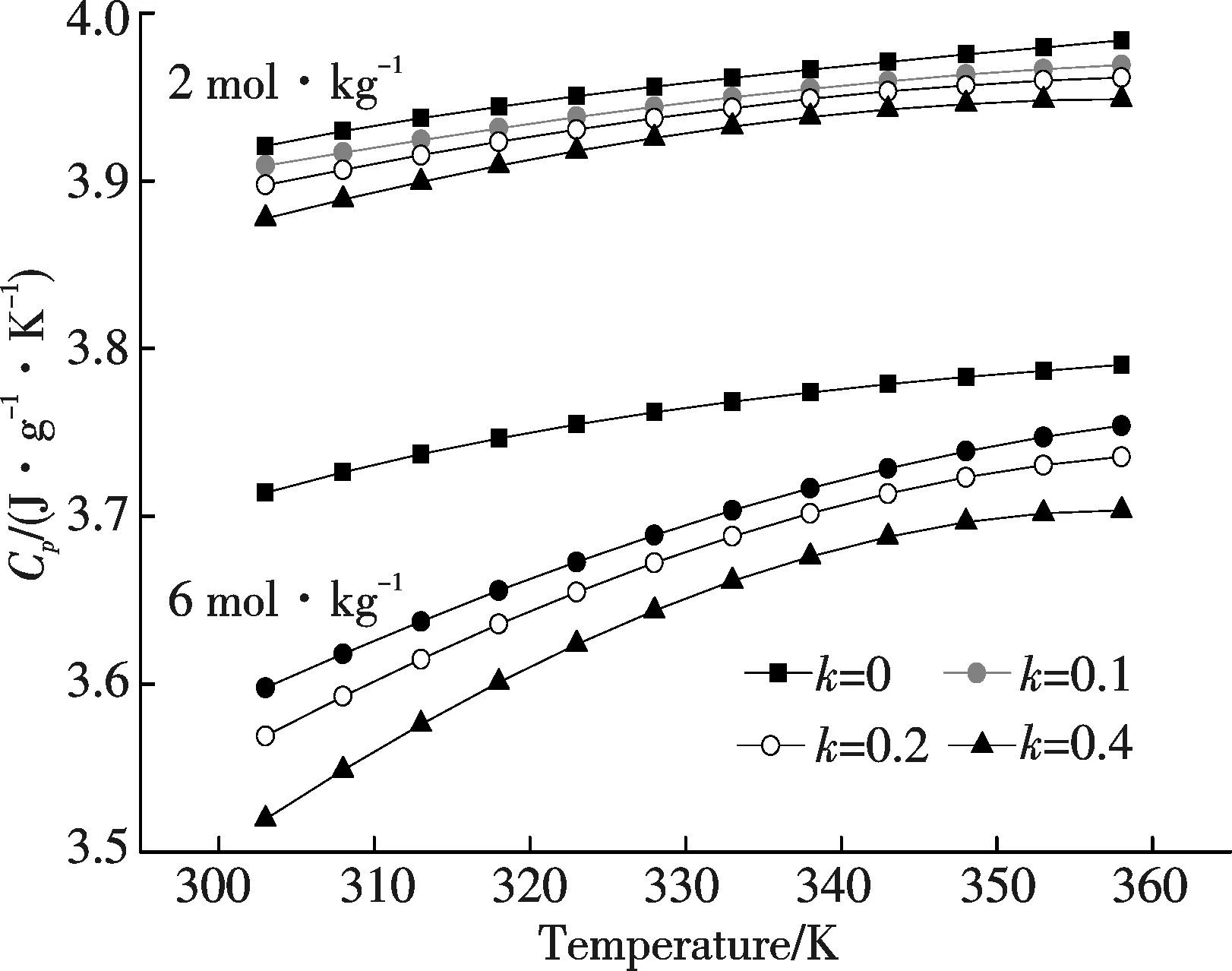
图4 确定离子强度和模数时碱性硅酸钠溶液的Cp~T曲线(k=0为NaOH溶液,其值取自文献[18])Fig.4 Cp~T curves of sodium silicate solutions at determinated modules (when k=0, the solutions are NaOH(aq.), and the Cp is from Ref[18])
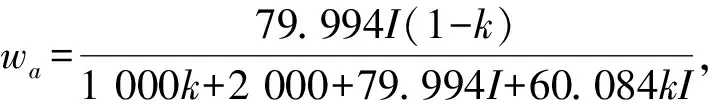
在确定的离子强度和模数时,溶液的恒压热容随温度的变化关系如图4所示,其中模数k=0所对应的为NaOH溶液,其值取自文献[18].从图4中可见,确定温度下碱性硅酸钠溶液的恒压热容随离子强度的增大而减小;离子强度相同时,热容随模数的增加而减小.
3 结论
实验测定了常压及298~362 K温度范围内不同浓度下的碱性硅酸钠溶液(NaOH-Na2SiO3-H2O)的恒压热容,建立了碱性硅酸钠溶液的恒压热容随温度及溶质总量变化的模型方程. 溶液体系的恒压热容随溶质总量或离子强度的增大而减小,并呈负指数的关系;而在温度及离子强度相同时,溶液的模数越大,热容越小.
参考文献:
[1] SWADDLE T W, SALERNO J, TREGLOAN P A. Aqueous aluminates, silicates, and aluminosilicates[J]. Chem Soc Rev, 1994,23(5):319-325.
[2] DING T P, ZHOU J X, WAN D F,etal. Silicon isotope fractionation in bamboo and its significance to the biogeochemical cycle of silicon[J]. Geochimica et Cosmochimica Acta, 2008,72(5):1381-1395.
[3] LEE S K, STEBBINS J F. Effects of the degree of polymerization on the structure of sodium silicate and aluminosilicate glasses and melts: an17O NMR study[J]. Geochimica et Cosmochimica Acta, 2009,73(4):1109-1119.
[4] ROWLES M, O’CONNOR B. Chemical optimisation of the compressive strength of aluminosilicate geopolymers synthesised by sodium silicate activation of metakaolinite[J]. J Mater Chem, 2003,13(5):1161-1165.
[5] CONRAD C F, ICOPINI G A, YASUHARA H,etal. Modeling the kinetics of silica nano-colloid formation and precipitation in geologically relevant aqueous solutions[J]. Geochimica et Cosmochimica Acta, 2007,71(3):531-542.
[6] SODERHOLM L, SKANTHAKUMAR S, GORMAN-LEWIS D,etal. Characterizing solution and solid-phase amorphous uranyl silicates[J]. Geochimica et Cosmochimica Acta, 2008,72(1):140-150.
[7] SJÖBERG S, HAGGLUND Y, NORDIN A,etal. Equilibrium and structural studies of silicon(Ⅳ) and aluminium(Ⅲ) in aqueous solution. V. Acidity constants of silicic acid and the ionic product of water in the medium range 0.05-2.0 M NaCl at 25 ℃[J]. Marine Chem, 1983,13(1):35-44.
[8] BASS J L, TURNEr G L. Anion distributions in sodium silicate solutions. characterization by29Si NMR and infrared spectroscopies, and vapor phase osmometry[J]. J Phys Chem B, 1997,101(50):10638-10644.
[9] GASTEIGER H A, FREDERICK W J, STREISEL R C. Solubility of aluminosilicates in alkaline solutions and a thermodynamic equilibrium model[J]. Ind Eng Chem Res, 1992,31(4):1183-1190.
[10] PROVIS J L, DUXSON P, LUKEY G C,etal. Modeling speciation in highly concentrated alkaline silicate solutions[J]. Ind Eng Chem Res, 2005,44(23):8899-8908.
[11] PARK H, ENGLEZOS P. Osmotic coefficient data for Na2SiO3and Na2SiO3-NaOH by an isopiestic method and modeling using Pitzer’s model[J]. Fluid Phase Equilibria, 1998,153:87-104.
[12] AZAROUAL M, FOUILLAC C, MATRAY J M. Solubility of silica polymorphs in electrolyte solutions, I. Activity coefficient of aqueous silica from 25 ℃ to 250 ℃, Pitzer’s parameterization[J]. Chem Geol, 1997,140(3-4):155-165.
[13] FELMY A R, CHO H, RUSTAD J R,etal. An aqueous thermodynamics model for polymerized silica species to high ionic strength[J]. J Solut Chem, 2001,30(6):509-525.
[14] WEBER C F, RODNEY D H. Modeling alkaline silicate solution at 25 ℃[J]. Ind Eng Chem Res, 2003,42(26):6970-6976.
[15] ZHOU J, CHEN Q Y, ZHOU Y,etal. A new kind of isopiestic apparatus for the determination of osmotic coefficients[J]. J Chem Thermodyn, 2003,35(12):1939-1963.
[16] 宋 婷,刘士军,肖刘萍,等. NaOH-NaAl(OH)4-H2O三元溶液体系的比定压热容[J].中国有色金属学报, 2012,22(10):2977-2984.
[17] WAGNER W, PRUSS A. The IAPWS formulation 1995 for the thermodynamic properties of ordinary water substance for general and scientific use[J]. J Phys Chem Ref Data, 2002,31(2):387-535.
[18] SCHRÖDLE S, KÖNIGSBERGER E, MAY P,etal. Heat capacities of aqueous solutions of sodium hydroxide and water ionization up to 300 ℃ at 10 MPa[J]. Geochimica et Cosmochimica Acta, 2008,72(13):3124-3138.
