BALB/c小鼠神经母细胞瘤移植模型的建立及相关影响因素的研究
2013-11-20张锐虎刘田福
张锐虎,荣 曼,刘田福
(山西医科大学实验动物中心, 太原 030001;*通讯作者,E-mail:YKDLTF@yahoo.com)
神经母细胞瘤是一种儿童常见的实质性肿瘤,大约65%的肿瘤起源于腹部,15%-20%起源于胸部,其余15%起源于颈部、骨盆等。该病中位发病年龄为22个月,早期难发现,易误诊误治[1]。本实验通过给不同年龄、不同部位的BALB/c小鼠接种神经母细胞瘤(N2a)细胞,成功建立了神经母细胞瘤动物移植模型,为神经母细胞瘤的研究提供了理想的实验材料。
1 材料与方法
1.1 实验材料
1.1.1 实验动物与细胞 清洁级BALB/c小鼠,由山西医科大学实验动物中心提供;N2a细胞株,购于中科院上海生命科学院细胞资源中心。
1.1.2 试剂及仪器 DMEM/F-12培养液、胎牛血清、青霉素、链霉素、PBS、0.25%胰蛋白酶消化液;超净工作台、倒置显微镜、CO2孵箱、75 cm2培养瓶、移液管、吸耳球、酒精灯等。
1.2 方法
1.2.1 细胞培养 N2a细胞接种于含10%胎牛血清、100 U/ml链霉素和100 U/ml青霉素的DMEM培养液中,在37℃、饱和湿度的5%CO2孵箱中培养。传代时吸尽培养液,加入1-2 ml PBS清洗残留的培养液,吸弃后加入0.25%胰蛋白酶消化液1-3 ml,均匀铺满培养瓶底部。置培养箱中2-5 min,镜下见细胞收缩变圆或少数悬浮时,轻轻拍打培养瓶侧面使细胞全部悬浮。加入刚吸出的旧培养液终止消化。移入离心管,1 000 r/min离心5 min,弃掉培养液,加入2-3 ml新培养液,将离心产生的沉淀轻轻吹打成细胞悬液。按1∶2-1∶3的比例分置到培养瓶内,加入完全培养液后继续培养[2]。
1.2.2 注射用细胞悬液的制备 选择对数生长期细胞,经消化、吹打、加培养液等制成单细胞悬液。在计数板上盖玻片的一侧滴加微量(约100μl)细胞悬液,使细胞悬液充满计数板和盖玻片之间的空隙。显微镜下计数活细胞,根据公式:浓度=(4个大格的细胞总数/4)×104个/ml,计算细胞悬液的浓度,并通过加减培养液将细胞浓度调整为1×107个/ml[3]。
1.2.3 实验动物的准备及分组 BALB/c小鼠饲养于屏障环境,温度22-25℃,相对湿度50%-70%。饲料、垫料经120℃高压消毒20 min,自由采食与饮水,垫料每周更换2次[4]。实验鼠按出生顺序以窝为单位随机分为腹腔、颈背、腋下3个注射组,首次注射在1-7 d进行,根据外观和触摸检查对确定未长瘤的鼠只在8-14 d进行再次注射;并对仍确定未长瘤者在15-21 d时进行了第3次注射。
1.2.4 细胞接种 1-3 d鼠的接种量为0.1 ml/只,剩余年龄段的均为0.2 ml/只。注射时根据注射部位,选择相应的体位进行抱定。其中进行腹腔和腋下注射时,选择迎面抱定;进行颈背部注射时,取俯卧位固定,用食指和拇指轻轻提起颈背部的皮肤,在形成的三角区进行注射。70%酒精消毒注射部位,1 ml注射器抽取细胞悬液,轻柔进针,缓慢注射,待注入大半时,边退针边注射。完成后,停留片刻再缓慢拔针,以防注射液外漏[1,5]。
1.2.5 模型鉴定 接种细胞后次日即开始观察并触摸小鼠的接种部位,当发现有鼓胀或触摸有异物感时,即可初步判断有瘤组织生成,继续进行观察,若发现瘤体逐渐增大即可基本确定,潜伏期按接种之日到初步确认的日期计算[1,6,7]。
1.2.6 实验鼠生长曲线的测定 实验鼠自细胞接种之日起,每周称量一次体重。
2 结果
2.1 动物数量及存活率
此次共有12窝、53只BALB/c小鼠参与实验。50只完成实验的BALB/c小鼠中有雌鼠19只、雄鼠31只,总的存活率为94.34%。21只荷瘤鼠占完成实验鼠的比例为42%,其中有雌鼠11只、雄鼠10只,各性别实验鼠的成瘤率为57.89%、32.26%,差异有统计学意义(P<0.05)。
2.2 不同注射部位成瘤率的比较
从成瘤率来看,腹腔注射的成瘤率最高,达到了46.15%(见表1)。

表1 不同接种部位成瘤率的比较Tab 1 Comparison of tumor formation rate among different inoculation sites
2.3 不同接种日龄对成瘤率的影响
在三个年龄段中1-7 d的成瘤率最高,达48.39%。随着年龄的增长,鼠只越容易抱定和注射,发生外溢的现象也随之减少,但成瘤率却未见增长(见表2)。

表2 不同年龄接种成功率的比较Tab 2 Comparison of tumor formation rate among different ages
2.4 移植瘤的潜伏期
本实验中潜伏期最短的为5 d,最长的有31 d,最多的在11-15 d,占荷瘤鼠的比例为61.9%(见表3)。
2.5 荷瘤雌鼠与正常雌鼠生长曲线的比较
实验中随机选取了10只未参与实验的同龄雌鼠与荷瘤雌鼠一起每周称重一次,分别绘制生长曲线。通过对各时间点体重及生长曲线的分析,发现两组鼠只在0-3周和7-8周这两个时间段的体重比较吻合,两者间差异无统计学意义上,而在4-6周及9周以后两组间的差异有统计学意义。由图1可知,从出生到3周,荷瘤鼠与正常鼠的生长曲线基本吻合,说明注射细胞后,由于潜伏期的存在,对荷瘤鼠的体重增长基本无影响。4-5周荷瘤鼠的体重增长明显慢于正常鼠,6周体重增长加速,在7-8周接近正常鼠的水平,此后仍以较高的速度增长,并超过正常鼠(见图1、表4)。
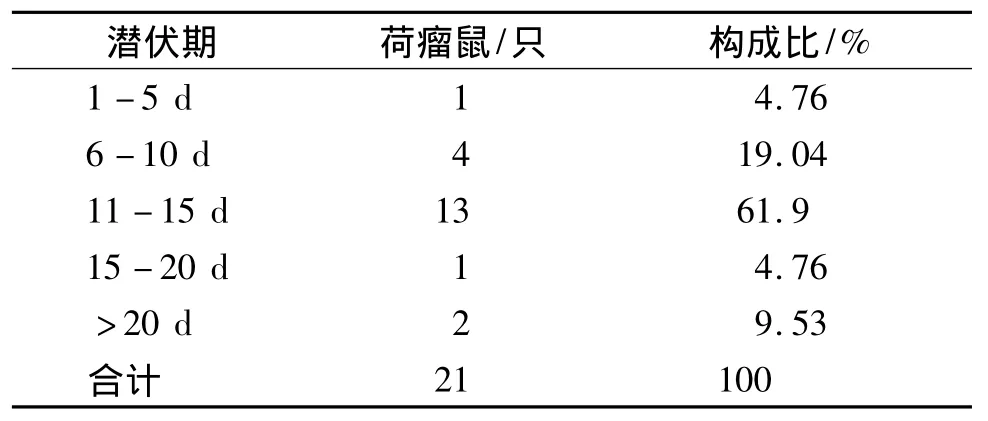
表3 荷瘤鼠的潜伏期分布情况Tab 3 The distribution of incubation period of tumorbearing mice at different incubaton period

图1 正常鼠与荷瘤鼠的生长曲线Fig 1 Growth curve of normal mice and tumor-bearing mice

表4 各组在不同时间点体重的变化Tab 4 Changes of body weight between normal and tumor-bearing mice at different time points
3 讨论
神经母细胞瘤是儿童多发的恶性肿瘤之一。已经有研究[1,3,8]利用 4-6 周龄的BALB/c 小鼠成功建立了神经母细胞瘤模型,并开展了相关研究。其中在潜伏期方面,我们与陈嘉波等的报道比较接近。在接种成功率方面,我们与郝希伟等[9]的报道较为相近,而与李霞等[6]和徐惠绵等[7]利用 BALB/c 小鼠建立黑色素瘤、结肠癌、胃癌移植瘤模型90%以上的成功率相差较大。由此我们认为,移植瘤成功率和潜伏期与移植物的种类和活力、接种部位及受试动物的免疫状态有很大关系。
甄林林等[10]和范萍等[11]在制备人乳腺瘤移植模型时,分别选用了BALB/c裸鼠和正常的BALB/c小鼠,并且都成功的建立了移植瘤模型。但在对实验动物选择方面,很多研究[12-16]认为,裸鼠缺乏免疫排斥反应,移植后肿瘤生长良好,能保持肿瘤细胞的原有形态及细胞动力学和生物学特性,是肿瘤模型研究中较为理想、也较为常用的实验动物。范萍等[11]则认为一个理想的移植瘤动物模型所选实验动物应为免疫功能正常、成瘤后动物有一定成活期的近交系。国内外的一些研究[6,17,18]也认为,选用BALB/c小鼠而非裸鼠的原因是BALB/c小鼠的抵抗力强,存活率高,对饲养条件要求较低;其次在研究转移性疾病时,宿主的免疫反应是协调因素,可以改变对转移性疾病及化疗药物的生物反应,而裸鼠T细胞免疫功能接近于零,丧失了免疫排斥能力;并且作为实验动物,其成本高,推广价值较低。对此,我们比较认同范萍等的观点,并利用具有完全免疫功能的BALB/c小鼠建立了神经母细胞瘤模型。
在利用BALB/c小鼠建立移植瘤模型的报道中,大多采用4-6周的雌性 BALB/c小鼠[1,19]。我们认为选择单一性别、固定的年龄段是不妥的,在建立一种移植瘤模型时,应从该疾病的常见发病年龄和性别组成考虑,选择具有应用推广价值的接种年龄和性别,这样建立的模型才会比较全面真实地反映疾病发病的真实状态,利于更有效地开展相关研究。
在肿瘤移植模型制备中,常用瘤细胞和瘤组织进行接种。接种液通常包括细胞生长培养液[1]、PBS缓冲液[8]和生理盐水[19]。其中细胞接种液多用完全培养液、PBS缓冲液,而组织接种液则用生理盐水和完全培养液。由此可见尚无统一标准,也未见有关效果比较的报道。我们认为细胞在体外培养时,对环境条件的要求是比较严格的,离开培养液,细胞的生长就会停止甚至死亡。为了最大程度地减少接种液和环境的改变对细胞的影响,并保持细胞活力,我们选用培养液来制备接种液,并取得了不错的效果。
[1]姚强华,汤燕静,高丰厚,等.含CpG寡核苷酸在人神经母细胞瘤裸鼠移植瘤模型中的抗肿瘤效应[J].癌症,2009,28(4):344-349.
[2]高强,董蒨,鹿洪亭,等.神经母细胞瘤体外细胞系的构建方法[J].山东医药,2004,44(21):3-4.
[3]赵红宇,李帅,徐东,等.人类神经母细胞瘤骨侵袭与转移模型的建立和评价[J].中华肿瘤防治杂志,2011,8(4):241-245.
[4]张东辉,许永华,龙志新,等.BALB/c裸小鼠繁育的实验观察[J].地方病通报,2001,16(4):80-82.
[5]曾德妙,周东,梁道明,等.人结肠癌SW480细胞BALB/c小鼠建立肝转移模型的实验研究[J].中国现代普通外科进展,2011,14(5):393-394.
[6]李霞,张西臣,李建华,等.BALB/c小鼠结肠癌皮下转移模型的建立[J].中国兽医学报,2008,28(9):1074-1076.
[7]徐惠绵,陈峻青,何三光.胃癌Balb/c小鼠腹膜移植模型建立及生物学特性的研究[J].中国医科大学学报,1998,27(5):490-492.
[8]陈嘉波,杨体泉.神经母细胞瘤裸鼠移植瘤模型的建立及相关应用研究进展[J].中华小儿外科杂志,2002,23(6):549-551.
[9]郝希伟,董蒨,鹿洪亭.神经母细胞瘤细胞生物学检测和荷瘤鼠模型的建立[J].山东医药,2005,45(18):10-12.
[10]甄林林,武正炎,范萍,等.人乳腺癌裸鼠移植模型的建立[J].南京医科大学学报,2001,21(6):509-510.
[11]范萍,王水,查小明,等.BALB/C小鼠乳腺癌移植模型的研究[J].中华实验外科杂志,2004,21(7):873-873.
[12]Roy J,Couillard S,Gutman M,etal.A novel pure SERM achieves complete regression of the majority of human breast[J].Breast Cancer Res Treat,2003,81(3):223-229.
[13]Celinski SA,Fisher WE,Amaya F,etal.Somatostatin receptor gene transfer inhibits established pancreatic cancer xenografts[J].J Surg Res,2003,115(1):41-47.
[14]Frydman B,Blokhin AV,Brummel S,etal.Cyclopropane-containing polyamine analogues are efficient growth inhibitors of a human prostate tumor xenograft in nude mice[J].J Med Chem,2003,46(21):4586-4600.
[15]She Y,Lee F,Chen J,etal.The epidermal growth factor receptor tyrosine kinase inhibitor ZD1839 selectively potentiates radiation response of human tumors in nude mice,with a marked improvement in therapeutic index[J].Clin Cancer Res,2003,9(10):3773-3778.
[16]Katz MH,Takimoto S,Spivack D,etal.A novel red fluorescent protein orthotopic pancreatic cancermodel for the preclinical evaluation of chemotherapeutics[J].J Surg Res,2003,113(1):151-160.
[17]韩斌.615小鼠结肠癌肝转移模型的建立[J].医药论坛杂志,2005,26(23):25-27.
[18]Boonmars T,Wu Z,Nagano I,etal.Epression of apoptosis- related factors in musclesinfected with Trichinella spiralis[J].Parasitology,2004,128(3):323-332.
[19]陈琼华,邱娜璇,颜晓红,等.BALB/c小鼠子宫内膜异位症模型的建立及其形态学的动态观察[J].中国微创外科杂志,2010,10(3):238-241.
