结核分枝杆菌PE/PPE蛋白研究进展
2013-11-20闵晨雨焦新安
孙 林,闵晨雨,钱 源,焦新安
1998年结核分枝杆菌基因组测序完成[1],发现了PE和PPE两大富含甘氨酸的蛋白家族,其编码基因大约占整个结核分枝杆菌基因组的10%,PE/PPE蛋白的得名是由于其氨基端分别含有Pro-Glu(PE)和 Pro-Pro-Glu(PPE)的基序(图1[2])。PE/PPE家族为结核分枝杆菌基因组中一个数量庞大的家族,共编码168个蛋白,其中PE家族有99个成员,PPE家族有69个成员。分枝杆菌基因组内包含如此广泛存在的相似基因家族,其蛋白产物对分枝杆菌的内稳态保持、繁殖及不同环境下的生存影响无疑有着巨大的研究潜力。目前为止该基因家族只在分枝杆菌基因组里发现,在其它细菌及人类基因组中并未发现类似基因家族,因此PE/PPE蛋白为分枝杆菌所独有,这更引起了广大研究者的兴趣,特对结核分枝杆菌PE/PPE蛋白近年来的研究进展作一综述。
1 PE/PPE蛋白分类
PE蛋白的特点是N-端大约110个氨基酸高度保守,并且在第8、9位氨基酸处存在Pro-Glu(PE)基序,PPE蛋白N-端大约180个氨基酸高度保守,在第7-9位氨基酸处存在Pro-Pro-Glu(PPE)基序。虽然PE和PPE蛋白家族都有保守的N-端区域,但是这两个家族之间N-端同源性却很低。根据C端的同源性以及特征性基序的不同,PE和PPE蛋白家族均可以分为不同的亚类。PE家族分为2个亚类,其中 PE-PGRS(polymorphic GC-rich-repetitive sequence,富含GC的多形性重复性序列)亚类有65个成员,C-端有多个 Gly-Gly-Ala或者 Gly-Gly-Asn重复序列,另一个亚类为PE亚类,有34个成员,C-端之间的同源性低。PPE家族可以分为4个亚类,PPE-SVP亚类是其中最大的一个亚类,一共有24个成员,该亚类的蛋白在300-350位之间有Gly-X-X-Ser-Val-Pro-X-X-Trp 特 征 性 基 序,PPE-MPTR亚类有23个成员,在C-端有多个 Asn-XGly-X-Gly-Asn-X-Gly重复基序,由一致的重复序列GCCGGTGTTG编码,中间间隔5个碱基。PPE-PPW亚类有10个成员,其特征是C-端有44个保守的氨基酸,由高度保守的 Gly-Phe-X-Gly-Thr和Pro-X-X-Pro-X-X-Trp基序组成。还有一个为PPE亚类,其C-端的同源性很低,有12个成员。
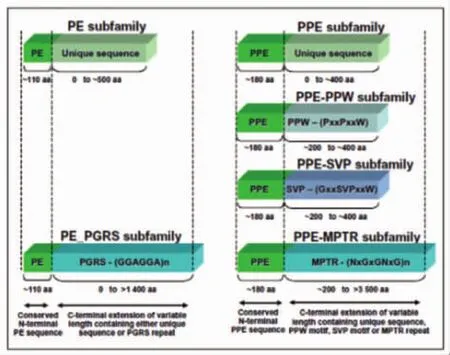
图1 PE/PPE家族基因结构示意图[2]Fig.1 Diagrammatic representation of the gene structure of PE/PPE family[2]
2 存在形式
pe/ppe基因分散在结核分枝杆菌4.4Mb的基因组上,但是这些基因并不是随机散在分布的,而是通常以操纵子或者基因簇的形式存在[3-4]。通过对细菌基因组内不同基因簇的分析表明,相关功能的基因通常存在于一个操纵子内,并且它们的产物存在相互作用。在结核分枝杆菌中一共存在40个PE/PPE操纵子,其中有22个是仅含有pe/ppe基因,而剩余的则与ESAT-6、代谢酶类、膜蛋白或者是保守的假想蛋白等相关基因共同组成操纵子。这些基因簇有一定的模式,绝大多数情况下是双顺反子形式,即一个pe基因后面接一个ppe基因。Strong 等[5]证 实,PPE41 (Rv2430c)和 PE25(Rv2431c)之间存在相互作用,PE/PPE复合体由7个α螺旋组成,PE蛋白的2个α螺旋与PPE蛋白的2个α螺旋形成4个螺旋的束状结构(图2)。Tundup等[4]研究表明,ppe41和pe25共存于一个操纵子内,并且是共转录的,表达产物形成稳定的复合体。
3 进化及抗原变异
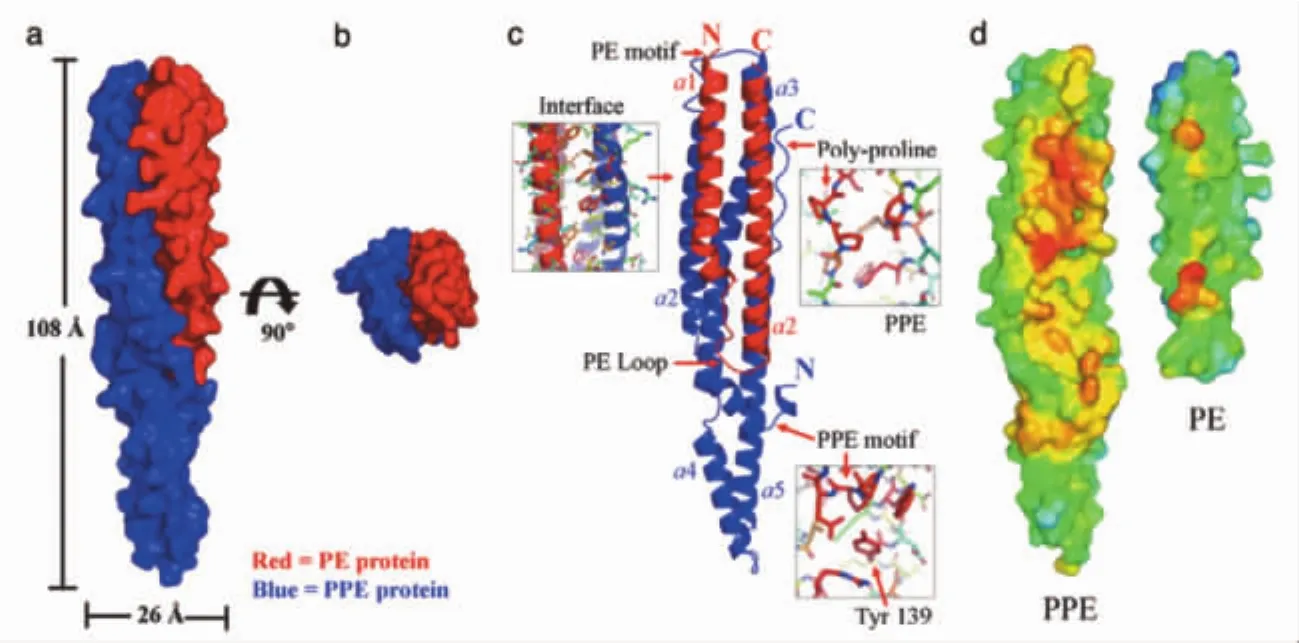
图2 结核分枝杆菌PE/PPE蛋白复合体晶体结构[5](a)表观图;(b)俯视图;(c)连续解剖图:箭头所示为高度保守区域;(d)PE/PPE蛋白疏水作用界面:红色、橙色和黄色表示非极性区域,蓝色表示极性区域,由于形成了复合物,广大非极性区域被溶剂屏蔽了。Fig.2 Crystal structure of Mycobacterium tuberculosis PE/PPE protein complex[5]a:Surface representation of the PE/PPE protein complex.b:The PE/PPE protein complex viewed down its longitudinal axis.c:Ribbon diagram of the PE/PPE protein complex.Regions of high sequence conservation are indicated by arrows.d:Interface hydrophobicity of the PPE and PE proteins.The hydrophobicity of the interaction interface between the PPE and PE protein is color-coded:the most apolar regions are indicated in red,orange,and yellow,and the most polar regions are indicated in blue.Notice the extensive apolar regions that are shielded from solvent as the complex forms.
虽然在分枝杆菌进化的过程中,通常情况下会发生基因组减小的现象,然而PE/PPE家族是由基因复制演化而来的。pe/ppe基因分散在结核分枝杆菌的基因组上,部分基因与esat-6样基因共同形成基因簇,esat-6基因簇的多种复制子存在于结核分枝杆菌的基因组中。通过比较基因组学研究了pe/ppe基因的起源以及它们与esat-6样基因之间的联系,pe/ppe基因最初插入了Esx-1基因座,这些基因在复制的过程中发生了变化。pe_pgrs和ppe_mptr亚类在这类基因的进化史上是最近发生的事件。为了鉴定某些菌株,研究病原的系统发生非常重要,这就需要合适的分子标记。katG基因的第436位密码子,gyrA基因的第95位密码子都存在多态性,narGHJI基因复合物启动子区域存在单个核苷酸的多态性,以及TbD1缺失都已被用作结核分枝杆菌的家族谱系追踪。pe/ppe基因也具备这样的用途,两个毗邻的pe_pgrs基因,如pe_pgrs17和pe_pgrs18也可用作结核分枝杆菌的家族谱系追踪。分子进化研究表明,在无毒力分枝杆菌中,如BCG,某些pe/ppe基因是缺失的,田鼠分枝杆菌(Mycobacteriummicroti)也是一种无毒力分枝杆菌,有4个pe基因和5个ppe基因缺失[6]。BCG在牛结核分枝杆菌(Mycobacteriumbovis)减毒的过程中缺失了某些区域,其中RD1区,含有esat-6、cfp-10以及pe(rv3872)和ppe(rv3873)基因,其他的RD区域也发生了pe/ppe基因的缺失。
4 亚细胞定位和可能的分泌机制
PE/PPE蛋白被认为具有免疫原性并且具有致病性,在宿主-病原相互作用过程中,病原的细胞表面分子递呈给宿主细胞,这方便了病原的入侵。已鉴定出很多帮助入侵的结核分枝杆菌基因,如Mce(mammalian cell entry,哺乳动物细胞入侵)基因和Eis(enhanced intracellular survival,增强胞内存活)基因以及Erp(exported repeated protein,输出重复蛋白)基因。一些PE/PPE蛋白含有跨膜区,并且作为细胞表面组分参与了细胞入侵。Brennan等研究显示,pe_pgrs33(rv1818c)的突变体不能感染巨噬细胞。pe_pgrs33编码的蛋白暴露在细胞表面,并且影响细菌的结构。更多的关于PE/PPE蛋白位于细胞表面的证据来源于它们与分泌抗原密切相关。结核分枝杆菌ESAT-6/CFP-10的分泌以及毒力的维持都需要RD1区基因的参与。RD1区含有pe(rv3872)/ppe(rv3873)基因对,RD1区基因可能是ESAT-6和CFP-10转运分泌系统的组成部分。因此,PE/PPE蛋白对作为分泌系统的组成部分可能位于细菌胞外被膜上,PE/PPE蛋白氨基酸组成及序列分析也支持这一推断。Pajón等[7]对结核分枝杆菌中含有β-桶状结构的蛋白进行了预测,在预测结果中含有40个PE/PPE蛋白。β-桶状蛋白通常暴露在细胞表面,而且含有膜锚定位点。以上信息均支持PE/PPE蛋白可能位于细胞表面的设想。进化基因组学已经揭示PE/PPE家族的进化和发展与Esx区域密切相关,在结核分枝杆菌的基因组中共含有5个Esx基因簇,它们共同组成了VII型分泌系统,其中Esx-1研究得最为透彻,负责EsxA(ESAT-6)和EsxB(CFP-10)的分泌,并且是结核分枝杆菌的毒力因子。PE35和PPE68基因位于Esx-1内,PE35的分泌是Esx-1依赖的。PPE68和结核分枝杆菌的细胞壁相关,并且能够和Esx-1其他的组分对话。令人惊讶的是,破坏PPE68将会导致ESAT-6的过度分泌,因此人们猜想,PPE68可能充当着Esx-1守门人的角色,然而这还需要实验来证实。Abdallah等[8]报道 Esx-5介导了许多PE/PPE蛋白的分泌。Esx-5与海洋分枝杆菌(Mycobacteriummarinum)的致病性相关,然而还不清楚哪些PE/PPE蛋白参与了这个过程。在结核分枝杆菌中Esx-5介导的PE/PPE蛋白的分泌尚未被阐明。鉴于EsxA/EsxB复合体与Esx分泌装置的相似性,PE/PPE复合体或者单个蛋白可能充当了Esx-5分泌的致病效应分子。但是并不是所有的PE/PPE蛋白都是通过Esx系统分泌的,有些PE/PPE蛋白含有功能性的信号肽切割位点,它们更倾向于通过Sec等经典的途径进行分泌。pe/ppe基因以操纵子的形式存在,并形成稳定的、功能性的蛋白复合体,Rv2430c和Rv2431c复合体晶体结构显示,PE/PPE蛋白绝大部分的保守区域形成了蛋白相互作用的位点。在其他的PE/PPE蛋白复合体上,可能也是相同的区域组成了蛋白相互作用的界面。晶体结构同时显示存在假定停泊位点(putative docking site),这意味着可能有其他蛋白被招募到复合体上。复合体中的PPE蛋白结构与丝氨酸趋化受体(serine chemotaxis receptors)具有同源性,因此推测PE/PPE蛋白可能参与了宿主免疫信号传导。目前结核分枝杆菌这类蛋白只有一个代表性的结构信息,为了更深入地了解这些蛋白的分子功能,必须要获得更多的结构信息。
5 毒力因子
已有很多研究显示PE/PPE蛋白与毒力相关,如PE_PGRS33的失活将导致细菌聚集生长能力丧失和感染巨噬细胞能力下降。同样,将PE_PGRS33在非致病性、生长快速的耻垢分枝杆菌(Mycobacteriumsmegmatis)中进行过量表达,体内外实验均证实能提高细菌在巨噬细胞内的存活能力。PPE46(Rv3018)的失活也能降低结核分枝杆菌的毒力。
Sayes等[9]将结核分枝杆菌 H37Rv野生株、Δppe25-pe19缺失株以及Δppe25-pe19::esx-5回复株以1×104CFU/只小鼠剂量通过滴鼻方式感染C57BL/6小鼠,感染后第14d、24d和28d测定肺和脾脏的荷菌量,结果Δppe25-pe19感染组没有分离到细菌。感染后第28天的肺组织切片显示,Δppe25-pe19感染组只表现为支气管和血管周围有巨噬细胞、淋巴细胞/浆细胞轻度浸润,萋-尼氏染色没有发现抗酸杆菌,而Δppe25-pe19::esx-5感染组则表现为巨噬细胞、上皮样细胞、淋巴细胞/浆细胞和嗜中性粒细胞的广泛浸润,并有大量的抗酸杆菌。这些结果表明,PPE25-PE19是结核分枝杆菌的致病因子。Betts等[10]利用microarray和蛋白质组学方法研究了结核分枝杆菌在缺乏营养条件下的反应,结果发现感染24h后有4个ppe基因表达上调,这些基因对维持细菌在缺乏营养条件下的长期存活有着重要的作用。铁依赖性转录调节因子(iron dependent regulator,IdeR)是多种毒力因子的调控因子,铁获得系统控制着多个PE/PPE蛋白,如 Rv0279、Rv0285和 Rv2123[11],铁的获得对毒力是必须的,因此也可以认为PE/PPE蛋白与毒力相关。以上报道均暗示PE/PPE蛋白能够作为毒力因子来帮助细菌引发感染,然而有关PE/PPE蛋白帮助细菌存活的分子机制还需要深入研究。
6 在诊断抗原和疫苗方面的应用
为了研发新型的诊断工具,一些具有高免疫原性的PE/PPE蛋白已被用作抗原来进行IFN-γ释放试验和抗体检测试验。Khan等[12]报道,PPE17(Rv1168c)可以用作特异性的诊断标记来区分活动性结核病人和BCG免疫个体,而且Rv1168c甚至可以用来诊断肺外结核和痰涂片阴性的肺结核病例,而这些病例用传统的检测手段很难检测出来。然而PE/PPE蛋白用作诊断抗原需注意以下问题:第一,一些PE/PPE蛋白存在于结核分枝杆菌复合群之外的分枝杆菌中,为了避免交叉反应,候选诊断抗原应当是种属特异的;第二,虽然一些PE/PPE抗原能够区分免疫和非免疫个体、疾病的不同形式以及感染的不同阶段,但是现有的数据表明不是所有的PE/PPE蛋白都具有这些诊断能力,因此在临床应用前需要大量的试验确证。
PE/PPE家族的一些成员能诱导机体产生免疫应答,例如,以PPE18为基础的亚单位疫苗Mtb72f,在多种动物实验中均产生了令人鼓舞的结果[13-14],并 且 已 进 入 临 床 I 期 实 验[15-16]。PPE_MPTR42与佐剂CpG联合使用,在小鼠实验中能提供部分保护[17]。以 PPE44[18]、PPE41[19]以及 PE_PGRS33[20]为基础的DNA疫苗,在小鼠实验中也能提供免疫保护。因此PE/PPE蛋白具有用作疫苗的潜能。
7 影响抗原加工递呈
PE_PGRS蛋白的PGRS结构域与EB病毒(Epstein-Barr virus,EBV)的EBV核抗原1(EBV nuclear antigen 1,EBNA1)有大约50%的同源性。EBNA1含有大量的Gly-Ala重复序列(同源性的基础),含有Gly-Ala的小肽GGAGAGAG通过干扰泛素-蛋白酶体通路来阻止EBNA1蛋白通过MHC I途径进行加工和递呈。为了考察PE_PGRS蛋白是否也能够阻止蛋白酶体的加工,Brennan等将PE_PGRS-GFP、PE-GFP以及 MPT64-GFP蛋白分别转染横纹肌肉瘤细胞,24h后荧光显微镜观察,结果只有PE_PGRS-GFP组有很强的荧光信号,从而说明PE_PGRS蛋白也能够阻止蛋白酶体的加工。后来的很多研究也认为PE_PGRS蛋白存在特定的结构域能够阻止泛素-蛋白酶体依赖的蛋白降解和CD8+T细胞的识别。
树突状细胞(dendritic cell,DC)在起始获得性免疫方面起着关键作用。机体能够针对病原微生物产生强有力的免疫应答,在这个过程中抗原递呈细胞起着至关重要的作用,但是结核分枝杆菌能够通过干扰抗原递呈细胞的功能而在宿主体内存活。先天性DC反应致敏Th1反应并控制Th1反应的强度,巨噬细胞反应招募细胞迁移至肺部以行使杀菌功能。Gupta等研究发现,感染早期(感染第1d)表达的基因能够增强结核分枝杆菌介导的DC的活化,而在感染后期(感染第5d)表达的基因则将阻止DC的活化。然而在结核分枝杆菌感染中,巨噬细胞内PE/PPE基因的表达与DC的活化之间是否存在相关性还不清楚。Bansal等的一项研究表明,PE_PGRS17和 PE_PGRS11识别TLR2,并诱导人DC的成熟和活化。由PE_PGRS蛋白诱导的DC活化包含ERK 1/2,p38MAPK和 NF-κB信号通路,PE_PGRS17和PE_PGRS11蛋白可能通过作用于DC等抗原递呈细胞来调节针对结核分枝杆菌的免疫反应以及结核病的临床过程。结核分枝杆菌感染小鼠巨噬细胞后,PE_PGRS17和PE_PGRS11的表达都得到了上调,在感染小鼠的肺部也检测到了PE_PGRS17和PE_PGRS11的表达。另一个PE_PGRS蛋白Rv1917c(PPE34)也能够通过触发TLR2-p38MAPK信号通路来诱导DC活化,有意思的是,Rv1917c诱导的免疫应答倾向于Th2类型,并且与DC环氧合酶-2的表达相关。
[1]Cole ST,Brosch R,Parkhill J,et al.Deciphering the biology ofMycobacteriumtuberculosisfrom the complete genome sequence[J].Nature,1998,393(6685):537-544.DOI:10.1038/31159
[2]Gey van Pittius NC,Sampson SL,Lee H,et al.Evolution and expansion of theMycobacteriumtuberculosis PE and PPE multigene families and their association with the duplication of the ESAT-6(esx)gene cluster regions[J].BMC Evol Biol,2006,6:95.DOI:10.1186/1471-2148-6-95
[3]Akhter Y,Ehebauer MT,Mukhopadhyay S,et al.The PE/PPE multigene family codes for virulence factors and is a possible source of mycobacterial antigenic variation:perhaps more[J].Biochimie,2012,94(1):110-116.DOI:10.1016/j.biochi.2011.09.026
[4]Tundup S,Akhter Y,Thiagarajan D,et al.Clusters of PE and PPE genes ofMycobacteriumtuberculosisare organized in operons:evidence that PE Rv2431cis co-transcribed with PPE Rv2430cand their gene products interact with each other[J].FEBS Lett,2006,580(5):1285-1293.DOI:10.1016/j.febslet.2006.01.042
[5]Strong M,Sawaya MR,Wang S,et al.Toward the structural genomics of complexes:crystal structure of a PE/PPE protein complex fromMycobacteriumtuberculosis[J].Proc Natl Acad Sci U S A,2006,103(21):8060-8065.DOI:10.1073/pnas.0602606103
[6]Garcia-Pelayo MC,Caimi KC,Inwald JK,et al.Microarray analysis ofMycobacteriummicrotireveals deletion of genes encoding PE-PPE proteins and ESAT-6family antigens[J].Tuberculosis(Edinb),2004,84(3/4):159-166.DOI:10.1016/j.tube.2003.12.002
[7]Pajon R,Yero D,Lage A,et al.Computational identification of beta-barrel outer-membrane proteins inMycobacteriumtuberculosis predicted proteomes as putative vaccine candidates[J].Tuberculosis(Edinb),2006,86(3/4):290-302.DOI:10.1016/j.tube.2006.01.005
[8]Abdallah AM,Gey van Pittius NC,Champion PA,et al.Type VII secretion-mycobacteria show the way[J].Nat Rev Microbiol,2007,5(11):883-891.DOI:10.1038/nrmicro1773
[9]Sayes F,Sun L,Di Luca M,et al.Strong immunogenicity and cross-reactivity ofMycobacteriumtuberculosisESX-5type VII secretion:encoded PE-PPE proteins predicts vaccine potential[J].Cell Host Microbe,2012,11(4):352-363.DOI:10.1016/j.chom.2012.03.003
[10]Betts JC,Lukey PT,Robb LC,et al.Evaluation of a nutrient starvation model ofMycobacteriumtuberculosispersistence by gene and protein expression profiling[J].Mol Microbiol,2002,43(3):717-731.DOI:10.1046/j.1365-2958.2002.02779.x[11]Prakash P,Yellaboina S,Ranjan A,et al.Computational prediction and experimental verification of novel IdeR binding sites in the upstream sequences ofMycobacteriumtuberculosisopen reading frames[J].Bioinformatics,2005,21(10):2161-2166.DOI:10.1093/bioinformatics/bti375
[12]Khan N,Alam K,Nair S,et al.Association of strong immune responses to PPE protein Rv1168cwith active tuberculosis[J].Clin Vaccine Immunol,2008,15(6):974-980.DOI:10.1128/CVI.00485-07
[13]Reed SG,Coler RN,Dalemans W,et al.Defined tuberculosis vaccine,Mtb72F/AS02A,evidence of protection in cynomolgus monkeys[J].Proc Natl Acad Sci U S A,2009,106(7):2301-2306.DOI:10.1073/pnas.0712077106
[14]Tsenova L,Harbacheuski R,Moreira AL,et al.Evaluation of the Mtb72Fpolyprotein vaccine in a rabbit model of tuberculous meningitis[J].Infect Immun,2006,74(4):2392-2401.DOI:10.1128/IAI.74.4.2392-2401.2006
[15]Leroux-Roels I,Leroux-Roels G,Ofori-Anyinam O,et al.E-valuation of the safety and immunogenicity of two antigen concentrations of the Mtb72F/AS02(A)candidate tuberculosis vaccine in purified protein derivative-negative adults[J].Clin Vaccine Immunol,2010,7(11):1763-1771.DOI:10.1128/CVI.00133-10
[16]Von Eschen K,Morrison R,Braun M,et al.The candidate tuberculosis vaccine Mtb72F/AS02A:Tolerability and immunogenicity in humans[J].Hum Vaccin,2009,5(7):475-482.
[17]Bertholet S,Ireton GC,Kahn M,et al.Identification of human T cell antigens for the development of vaccines againstMycobacteriumtuberculosis[J].J Immunol,2008,181(11):7948-7957.
[18]Romano M,Rindi L,Korf H,et al.Immunogenicity and protective efficacy of tuberculosis subunit vaccines expressing PPE44(Rv2770c)[J].Vaccine,2008,26(48):6053-6063.DOI:10.1016/j.vaccine.2008.09.025
[19]Skeiky YA,Ovendale PJ,Jen S,et al.T cell expression cloning of aMycobacteriumtuberculosisgene encoding aprotective antigen associated with the early control of infection[J].J Immunol,2000,165(12):7140-7149.
[20]Delogu G,Brennan MJ.Comparative immune response to PE and PE_PGRS antigens ofMycobacteriumtuberculosis[J].Infect Immun,2001,69(9):5606-5011.DOI:10.1128/IAI.69.9.5606-5611.2001
