N-乙酰半胱氨酸对博莱霉素致小鼠肺间质纤维化形成及NF-κB、IL-4表达的影响*
2013-11-20刘卫青张晓晔秦秉玉
刘卫青,张晓晔,朱 敏,秦秉玉
1)郑州大学人民医院重症医学科 郑州 450003 2)中国医科大学附属盛京医院肿瘤内科 沈阳 110004 3)郑州大学人民医院呼吸科 郑州 450003
近年来,随着全球经济一体化和工业化的快速发展,肺间质纤维化患者越来越多,但是该病的发病机制仍不清楚,临床疗效也差。已有研究[1-2]表明,氧化应激可诱导核转录因子-κB(nuclear factor-kappa B,NF-κB)的活化,调节许多致纤维化相关细胞因子的转录。作者以前的研究[3]显示,在博莱霉素(bleomycin,BLM)诱导的肺间质纤维化病理过程中,肺组织NF-κB的表达明显增强。另有研究[4]显示,白介素-4(interleukin-4,IL-4)可增加肺成纤维细胞胶原的表达和细胞外基质蛋白的沉积,在肺纤维化病理过程中具有重要作用。作者观察了抗氧化剂N-乙酰半胱氨酸(N-acetylcysteine,NAC)对小鼠肺间质纤维化的治疗作用,并进一步探讨其可能的作用机制。
1 材料与方法
1.1材料8周龄雌性C57BL/6小鼠,体质量17~20 g,购自北京维通利华实验动物技术公司,寄养于中国医科大学盛京医院实验动物中心。BLM-A5(8 mg/支,天津太河制药有限公司,批号:050101),NAC(0.1 g/包,富露施,海南赞邦制药有限公司,批号:060110),NF-κB p65免疫组化检测试剂盒购自北京中杉金桥生物技术有限公司,IL-4酶联免疫吸附(ELISA)试剂盒购自上海森雄科技实业有限公司,羟脯氨酸(HYP)试剂盒购自南京建成生物工程研究所。紫外光、可见光连续分光光度计(法国S500-P),全自动酶标仪(奥地利TECAN),超声匀浆机(德国UPH-200)。
1.2实验动物分组及处理75只C57BL/6小鼠随机分为3组。BLM组25只,气管注射BLM 5 mg/kg制作肺间质纤维化模型[5];NAC组25只,于注射BLM前5天开始每天给予NAC 250 mg/kg直至取材;对照组25只,气管注射生理盐水20 μL。3组小鼠于实验第1、3、7、14、28天以腹腔主动脉放血法处死(每组每个时间点5只)后,行支气管肺泡灌洗,反复灌洗3次,将收集的支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)3 000 r/min离心10 min,取上清液-70 ℃冻存待测IL-4。所得细胞进行离心涂片,冷丙酮固定后用于测NF-κB的表达。
1.3肺组织病理学观察左肺灌注40 g/L多聚甲醛直至肺表面光滑,结扎气管后取出左肺,放入40 g/L多聚甲醛中固定3 h,常规石蜡包埋,制成4 μm厚切片,行HE染色和Masson染色。
1.4肺组织HYP含量的测定按试剂盒说明书操作(样本碱水解法)。
1.5支气管肺泡灌洗细胞NF-κBp65的检测将固定后的支气管肺泡灌洗细胞进行p65(NF-κB的功能亚单位)SP免疫组化染色。一抗为小鼠p65单克隆IgG抗体,以PBS代替一抗作为阴性对照,按免疫组化试剂盒步骤操作,DAB显色,以细胞核染成棕黄色为阳性,每张玻片随机选取5个视野(×400),计算视野内阳性细胞占全部细胞的比例。
1.6BALF中IL-4含量测定ELISA法检测IL-4的含量,按试剂盒说明书操作,使用全自动酶标仪测492 nm处吸光度,通过标准曲线计算IL-4的含量。
1.7统计学处理应用SPSS 16.0处理数据,采用单因素方差分析比较同一时间点不同组别HYP、NF-κB阳性细胞百分比和IL-4含量的差异,两两比较用LSD-t检验,检验水准α=0.05。
2 结果
2.1 3组小鼠肺组织病理结果HE及Masson染色结果见图1。

图1 3组小鼠肺组织HE染色和Masson染色(×400)
结果显示,BLM组小鼠经气管注射BLM后第7天,肺泡间隔增厚,肺泡腔内可见渗出改变,内有炎症细胞浸润;第14天肺间质出现大量炎症细胞浸润,肺泡间隔明显增厚,可见多发片状实变(Masson染色可见肺间质内有明显的胶原沉积);第28天肺组织可见大片的实变,其间可见大量的炎症细胞浸润,肺泡结构明显丧失(Masson染色可见肺间质大量的胶原沉积,纤维化改变明显)。与BLM组小鼠相比,NAC组小鼠第14天肺泡炎症明显减轻,肺泡间隔略有增厚,炎症细胞浸润明显减轻;第28天可见肺实变程度较BLM组明显减轻,可见破坏的肺泡结构,肺泡间隔明显增厚,间质内可见大量炎症细胞浸润,有明显胶原沉积。
2.2 3组小鼠肺组织HYP含量的比较见表1。
2.3 3组小鼠支气管肺泡灌洗细胞NF-κB的表达见图2、表2。
2.4 3组小鼠BALF中IL-4含量比较见表3。
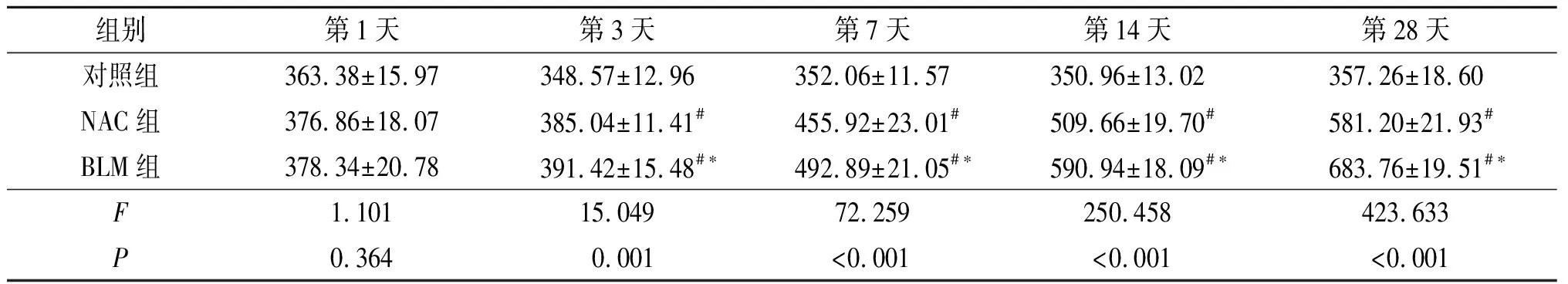
表1 3组小鼠肺组织HYP含量的比较 (n=5) μg/g
#与对照组比较,P<0.05;*与NAC组比较,P<0.05。

图2 第7 d 3组小鼠支气管肺泡灌洗细胞NF-κB的表达(SP,×400)
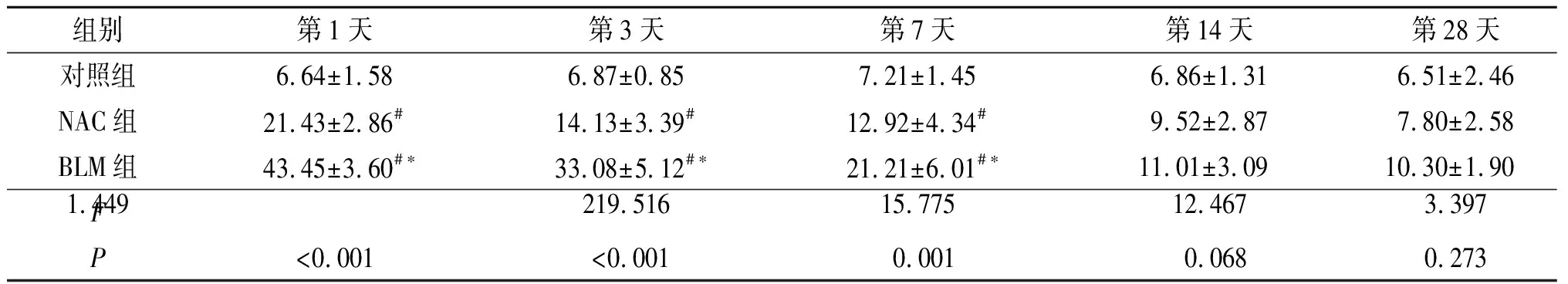
表2 3组小鼠支气管肺泡灌洗细胞中NF-κB阳性细胞百分比的比较 (n=5) %
#与对照组比较,P<0.05;*与NAC组比较,P<0.05。
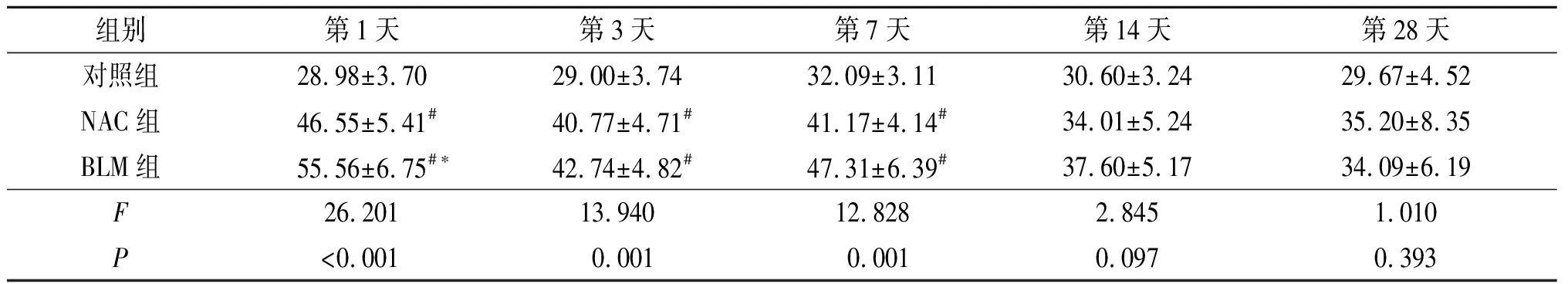
表3 3组小鼠BALF中IL-4含量的比较 (n=5) ng/L
#与对照组比较,P<0.05;*与NAC组比较,P<0.05。
3 讨论
目前认为,在肺间质纤维化病理过程中存在氧化/抗氧化失衡和细胞因子网络失衡[1-2,6]。抗氧化剂NAC口服后可脱去乙酰基变为半胱氨酸即谷胱甘肽的前体[7],提高还原巯基水平,发挥抗氧化作用,纠正氧化失衡。但NAC对细胞因子的作用机制仍不清楚,故对这一问题的研究有助于进一步阐明NAC及NF-κB在肺间质纤维化中的作用。
有研究[3,8]显示,NF-κB是一个重要的转录因子,调节许多炎症性细胞因子的转录。活化的NF-κB是由两个蛋白亚单位构成的二聚体,p65是其重要的功能亚单位。在BLM诱导的肺间质纤维化病理过程中,存在着Th1/Th2细胞因子的平衡失调,当Th1型细胞因子占优势时,可抑制肺间质纤维化的形成[8],当Th2型细胞因子占优势时,有利于肺间质纤维化的形成。IL-4是重要的Th2型细胞因子,能促进其他Th2型细胞因子的产生,并抑制Th1型细胞因子的生成,使Th1/Th2细胞因子平衡向Th2型优势发展。同时IL-4可刺激肺成纤维细胞,增加胶原的表达,促进细胞外基质蛋白的沉积[4]。
该研究结果显示,在BLM诱导的肺间质纤维化病理过程早期,NF-κB p65在支气管肺泡灌洗细胞胞核的表达即明显增强,同时IL-4在BALF中的表达也明显增强,这与其他研究结果类似[9-10],而且IL-4与NF-κB p65表达强度的时间变化相似,而NAC明显抑制了BLM诱导的NF-κB活化和IL-4的产生。作者以往的研究[11]显示,小鼠气管注射BLM后1天,支气管肺泡灌洗细胞表达的NF-κB p65和IL-4间存在着正相关关系。目前尚未见文献报道NF-κB对IL-4的合成具有直接调控作用,但两者之间却联系紧密[12],如缺乏NF-κB p50亚基小鼠的Th2细胞不能产生IL-4、IL-5、IL-13,抑制NF-κB的活性可以阻断T细胞中GATA-3的表达和Th2型细胞因子的产生[13]。据此推测,肺泡内单核巨噬细胞NF-κB的活化可能通过间接途径使IL-4合成增强,并进一步引发Th2型细胞因子的优势表达,使BLM诱导的肺损伤向形成纤维化的方向发展。NAC通过抗氧化作用减轻氧化损伤,抑制了活性氧刺激的NF-κB激活[14],进而可能通过NF-κB的间接途径下调IL-4的表达,从而纠正细胞因子网络失衡,最终抑制了肺间质纤维化的发展。
此外,该研究还显示,NAC不仅明显减轻了BLM所致小鼠肺泡炎症和肺组织纤维化程度,还抑制了肺组织HYP水平的增高。这进一步说明NAC可抑制BLM诱导的小鼠肺间质纤维化形成。
总之,抗氧化剂NAC可能通过抑制NF-κB的活化,减少IL-4等致纤维化相关细胞因子的产生,进而减轻BLM致小鼠肺间质纤维化。NF-κB的活化和细胞因子网络失衡在BLM诱导的肺间质纤维化病理过程中具有重要作用。
[1]Forman HJ,Torres M.Reactive oxygen species and cell signaling[J].Am J Respir Crit Care Med,2002,166(12 Pt 2):s4
[2]Janssen-Heininger YM,Persinger RL,Korn SH,et al.Reactive nitrogen species and cell signaling[J].Am J Respir Crit Care Med,2002,166(12 Pt 2):s9
[3]张晓晔,周妍,刘卫青,等.核因子κB在博莱霉素致小鼠肺纤维化病理过程中的动态表达[J].中国医科大学学报,2007,36(5):505
[4]Lukacs NW,Hogaboam C,Cheensue SW,et al.Type1/Type2 cytokine paradigm and the progression of pulmonary fibrosis[J].Chest,2001,120(1 Suppl):5S
[5]陈祥银,严仪昭,曾卫东,等.丹参、川芎嗪及糖皮质激素对肺纤维化保护作用的实验观察[J].中华结核和呼吸杂志,1987,10(3):152
[6]张晓晔,侯显明.转录因子NF-κB与非特异性炎症[J].国外医学:呼吸系统分册,2000,20:41
[7]徐凌,蔡柏蔷.N-乙酰半胱氨酸在肺部疾病中的应用进展[J].国外医学:呼吸系统分册,2004,24(6):413
[8]Sime PJ,O’Reilly KM.Fibrosis of the lung and other tissues:new concepts in pathogenesis and treatment[J].Clin Immunol,2001,99(3):308
[9]Castranova V,Porter D,Millecchia L,et al.Effect of inhaled crystalline silica in a rat model:time course of pulmonary reactions[J].Mol Cell Biochem,2002,234/235(1/2):177
[10]Wallace WA,Howie SE.Immunoreactive interleukin 4 and interferon-gamma expression by type Ⅱ alveolar epithelial cells in interstitial lung disease[J].J Pathol,1999,187(4):475
[11]张晓晔,周妍,刘卫青,等.核因子κB反义寡核苷酸对博莱霉素致小鼠肺间质纤维化形成及白细胞介素4表达的影响[J].中华医学杂志,2007,87(3):195
[12]Yu M,Qi X,Moreno JL,et al.NF-κB signaling participates in both RANKL- and IL-4-induced macrophage fusion:receptor cross-talk leads to alterations in NF-κB pathways[J].J Immunol,2011,187(4):1797
[13]Das J,Chen CH,Yang L,et al.A critical role for NF-κB in CATA-3 expression and Th2 differentiation in allergic airway inflammation[J].Nat Immunol,2001,2(1):45
[14]Mercurio F,Manning AM.NF-kappa B as a primary regulator of the stress response[J].Oncogene,1999,18(45):6163
