伴胃肠动力障碍的重症急性胰腺炎大鼠结肠黏膜下神经节一氧化氮合酶阳性神经元的变化*
2013-11-20李小玲
袁 园,林 中,李小玲
桂林医学院附属医院消化内科 桂林 541001
急性胰腺炎是多种病因导致胰酶在胰腺内被激活后,引起胰腺组织自身消化、水肿、出血甚至坏死的炎症反应,而重症急性胰腺炎(severe acute pancreatitis,SAP)患者常伴胃肠动力障碍,目前,SAP引起胃肠动力障碍的神经机制尚不明确。研究[1-3]表明一氧化氮合酶(nitric oxide sythase,NOS)表达的改变与多种伴有胃肠动力障碍的疾病有关,而使用NOS抑制剂能在一定程度上改善胃肠道运动功能。胃肠道的神经调节与肠神经系统(enteric nervous system,ENS)密切相关。ENS主要由肠肌间神经丛和黏膜下神经丛组成。研究[4]发现ENS神经元在微环境改变下能发生重塑,而该特性又是众多病理生理过程发生发展的基础和前提。研究[5]发现伴有胃肠动力障碍的SAP大鼠结肠肌间神经节NOS阳性神经元比例上调,推测与胃肠动力障碍有关,而同一部位黏膜下神经节NOS表达是否改变尚未明确。作者利用机能实验观察SAP模型大鼠结肠蠕动频率、胰腺病理表现,应用免疫荧光技术观察大鼠结肠黏膜下神经节NOS阳性神经元的改变,探讨其与SAP胃肠动力障碍的关系。
1 材料与方法
1.1材料成年SPF级SD健康雌性大鼠,体质量200~230 g,由桂林医学院动物实验中心提供。小鼠抗大鼠神经蛋白HuC/HuD单克隆抗体(美国Molecular Probes公司),兔抗鼠NOS多克隆抗体(美国Santa Cruz公司);牛磺胆酸钠(美国Sigma公司);正常山羊封闭血清、FITC标记山羊抗小鼠IgG(H+L)、TRITC标记山羊抗兔IgG(H+L)(北京中杉金桥生物技术有限公司)。BL-410生物机能实验系统(四川成都孟秦公司),解剖显微镜(蔡司光学仪器上海国际贸易有限公司),荧光显微镜(日本奥林巴斯仪器公司)。
1.2SAP模型的制备方法采用肠壁穿刺逆行胰胆管注射牛黄胆酸钠的方法制作SAP大鼠模型。SD大鼠禁食24 h不禁水,乙醚吸入麻醉,无菌下开腹暴露十二指肠,辨认胰胆管,用磨钝4号半头皮针逆行胰胆管穿刺4~5 mm后,用动脉夹夹闭肝门部胆管,固定针头,泵入50 g/L牛磺胆酸钠(1 mL/kg,0.1 mL/min)3~5 min后撤针。继续夹闭8~10 min,松开动脉夹,复位肠管关腹,皮下补液(生理盐水10 mL),禁食禁水24 h。
1.3实验分组20只SD健康雌性大鼠采用抽签法随机分为假手术组和模型组,每组10只。模型组按1.2方法制备模型;假手术组大鼠用乙醚麻醉后开腹,翻动十二指肠及胰腺10次后关腹,术后皮下补液(生理盐水10 mL),禁食禁水24 h。24 h后,各组存活大鼠用乌拉坦麻醉后开腹,观察大鼠腹腔内腹水情况、有无皂化斑及胰腺和肠管的大体改变;取标本进行观测。
1.4观测指标
1.4.1 小肠推进比测定 存活大鼠灌服台盼兰1.5 mL/只,以幽门为起点测量含台盼兰小肠的长度及小肠全长。小肠推进比=(小肠全长-含台盼兰小肠长度)/小肠全长×100%
1.4.2 结肠蠕动频率测定 取近回盲部1.5 cm结肠组织立即浸泡于37 ℃的Kreb液中,将肠段一端系在通气管上,另一端系在张力换能器上,由BL-410生物机能实验系统记录5 min结肠蠕动频率。
1.4.3 胰腺病理观察 取胰头组织,置于福尔马林固定24 h后,HE染色,光镜下观察。将胰腺组织水肿、炎性细胞浸润、出血、坏死程度分别按0~4 分评分,各参数分值相加得总分[6]。
1.4.4 粪便含水量 收集各组大鼠24 h粪便,测定湿重后,于65 ℃烤箱中干燥24 h,测定干重。粪便含水量=(湿重-干重)/湿重×100%。
1.4.5 结肠黏膜下组织NOS阳性神经元的测定 距回盲部4 cm向远端取1~2 cm结肠放入4 ℃ Kreb液中漂洗干净,30 min内完成结肠黏膜下神经丛全层标本的制作。在解剖显微镜下,于4 ℃Kreb液环境中沿肠系膜剪开、平铺标本,将浆膜面朝上,撕去浆肌层;翻转标本使黏膜面朝上剔除黏膜组织,暴露黏膜下神经丛,将黏膜下神经丛全层标本适当展开固定,置于Stefanini液(体积分数2%甲醛液50 mL、饱和杏仁酸150 mL、磷酸缓冲液定容至1 000 mL)中固定24 h。用PBS漂洗3×10 min,用含TritonX-100、体积分数10%正常山羊封闭血清的PBS室温(22 ℃) 孵育30~60 min,用抗HuC/HuD(10 mg/L,4 ℃)孵育24 h,用NOS多克隆抗体(1100,4 ℃)孵育24 h,FITC标记山羊抗小鼠IgG(1100,22 ℃)孵育45 min,TRITC标记山羊抗兔IgG(1400,22 ℃)孵育45 min。黏膜面向上,镜下铺片,甘油封片,干燥后置于荧光显微镜下镜检计数。每个样本至少观察200个HuC/HuD阳性神经元(绿色),计数其中NOS阳性神经元(红色)。
1.5统计学处理采用SPSS 17.0进行数据分析,2组小肠推进比、结肠蠕动频率、粪便含水量及胰腺病理评分符合正态分布,其比较采用两独立样本t检验;2组NOS阳性神经元计数非正态分布,采用Mann-Whintney非参数检验;检验水准α=0.05。
2 结果
2.1 2组动物一般情况24 h后,假手术组大鼠无死亡,一般状况良好,开腹后未见胰腺病灶、腹水、胃肠道扩张等胰腺炎相关表现。模型组大鼠死亡2只,开腹后可见胰腺组织出现出血坏死灶,胰头尤其明显;胃肠道扩张较明显,结肠内多有粪便残留并伴有血性腹水。
2.2 2组小肠推进比、结肠蠕动频率、粪便含水量及胰腺病理评分的比较光镜下假手术组胰腺小叶结构完整,可见充血水肿,无胰腺坏死病灶,局部可见炎性细胞浸润。模型组胰腺小叶排列紊乱,叶间裂增宽,大量炎性渗出,胰腺腺泡细胞肿胀,坏死区内腺泡结构消失,胞核溶解(图1)。假手术组小肠推进比、结肠蠕动频率、粪便含水量均高于模型组,而胰腺病理评分则低于模型组,见表1。
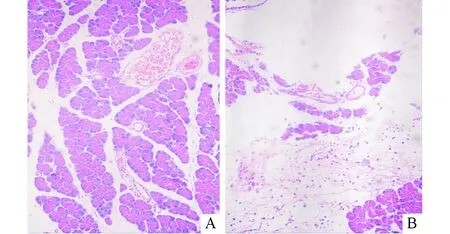
图1 2组胰腺组织病理表现(HE,×100)

组别n小肠推进比/%结肠蠕动频率/min-1粪便含水量/%胰腺病理评分假手术组1041.04±4.3613.40±1.3541.56±6.691.20±0.63模型组814.54±2.304.00±0.9312.98±6.5615.75±1.72t15.47716.7488.86923.569P<0.001<0.001<0.001<0.001
2.3 2组结肠黏膜下NOS阳性神经元计数的比较荧光显微镜下观察可见(图2)黏膜下神经元呈多态性,多以神经节形式聚集分布,神经细胞着色,神经纤维不着色。而NOS阳性神经元胞体和纤维均可着色。假手术组NOS阳性神经元计数为(22.49±5.14)%,模型组为(26.36±2.57)%,2组比较,差异无统计学意义(Z=-1.955,P=0.055)。
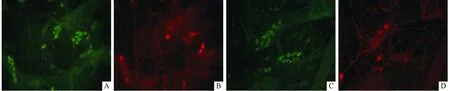
图2 2组结肠黏膜下神经元免疫荧光结果(×200)
A:假手术组黏膜下神经元;B:假手术组黏膜下NOS阳性神经元;C:模型组黏膜下神经元;D:模型组黏膜下NOS阳性神经元。
3 讨论
该实验采用肠壁穿刺逆行胰胆管注射牛黄胆酸钠的方法制作SAP大鼠模型,用胰腺HE染色验证造模成功与否;并通过小肠推进比、机能实验等观察是否伴有胃肠道运动障碍;应用双重免疫荧光观察大鼠黏膜下NOS阳性神经元的改变。已有研究[7-8]发现SAP大鼠结肠肌间NOS阳性神经元和黏膜下血管活性肠多肽(VIP)阳性神经元较假手术组增加,推测上述两种神经元重塑与SAP胃肠动力障碍有关。而该实验结果表明同一部位黏膜下神经丛NOS阳性神经元基本不变。
SAP大鼠结肠黏膜下神经丛NOS表达基本不变,可能与以下几方面有关。①NOS的生物学功效可能与VIP不同。胃肠道黏膜下NOS和VIP都具有舒张血管、抗炎等作用[9-10],推测两者虽同为抑制性神经递质,但在结肠黏膜下的生物学功能侧重点可能不同。②该实验中取材为蠕动部位的结肠组织,不能排除其他部位黏膜下神经丛NOS表达改变的可能。有学者报道[11]SAP大鼠血清及肠道VIP表达具有双向性,即SAP大鼠血清及肠组织VIP于术后1 h后明显降低,随后逐渐增加,于术后12 h超过假手术组。而该实验取材于24 h后的SAP大鼠结肠组织,不能排除NOS阳性神经元也有类似特点,该神经元可能在24 h之内就已经发生了重塑,或者尚未发生重塑,因错过观察时相,所以未能观察到NOS阳性神经元的改变。Zhou等[12]发现伴有胃肠动力障碍的急性坏死性胰腺炎大鼠回肠NOS蛋白表达下降。故不能排除结肠黏膜下NOS阳性神经元数目上调的可能,该上调效应可能因部分表达下调的中和而呈现出表达基本不变的假象。③该研究样本含量有可能造成一定的偏差。④近几年来,作为ENS重要组成部分的神经胶质细胞对胃肠动力的影响日益受到人们的关注[13],但在SAP中对各类神经元的影响尚不清楚,有待进一步研究。
因此,作者认为SAP伴有胃肠动力障碍是多因素共同作用的结果,虽然伴有胃肠动力障碍SAP大鼠结肠黏膜下NOS阳性神经元未发生明显重塑,但ENS在伴有胃肠动力障碍SAP中的作用和改变仍有继续研究的空间及价值。
[1]Bagyanszki M,Torfs P,Krecsmarik M,et al.Chronic alcohol consumption induces an overproduction of NO by nNOS- and iNOS-expressing myenteric neurons in the murine small intestine[J].Neurogastroenterol Motil,2011,23(6):237
[2]Chaumette T,Lebouvier T,Aubert P,et al.Neurochemical plasticity in the enteric nervous system of a primate animal model of experimental Parkinsonism[J].Neurogastroenterol Motil,2009,21(2):215
[3]张军明,任艳华,刘芬,等.肝门阻断对大鼠肠道肌间神经丛内NOS阳性神经元的影响[J].世界华人消化杂志,2006,14(1):87
[4]林中,张剑中,赵永中.EvaEkblad.小肠肌间神经丛体外培养抑制肠平滑肌的增殖[J].世界华人消化杂志,2008,16(14):1577
[5]Lin Z,Liu Y,Zheng Q,et al.Increased proportion of nitric oxide synthase immunoreactive neurons in rat ileal myenteric ganglia after severe acute pancreatitis[J].BMC Gastroenterol,2011,11:127
[6]Schmidt J,Rattner DW,Lewandrowski K,et al.A better model of acute pancreatitis for evaluating therapy[J].Ann Surg,1992,215(1):44
[7]刘颖,林中,胡琼花,等.伴有胃肠动力障碍的重症急性胰腺炎大鼠结肠肠肌间神经丛一氧化氮合成酶神经元的变化[J].第三军医大学学报,2010,32(3):374
[8]程晓雯,林中,郑清华,等.重症急性胰腺炎伴胃肠动力障碍结肠黏膜下血管活性肠肽的变化[J].南京医科大学学报:自然科学版,2012,32(2):183
[9]Fahrenkrug J.VIP and PACAP[J].Results Probl Cell Differ,2010,50:221
[10]Toda N,Herman AG.Gastrointestinal function regulation by nitrergic efferent nerves[J].Pharmacol Rev,2005,57(3):315
[11]Zhongkai L,Jianxin Y,Weichang C.Vasoactive intestinal peptide promotes gut barrier function against severe acute pancreatitis[J].Mol Biol Rep,2012,39(4):3557
[12]Zhou H,Liu L,Bai Y,et al.Damage of the interstitial cells of Cajal and myenteric neurons causing ileus in acute necrotizing pancreatitis rats[J].Surgery,2011,149(2):262
[13]Bassotti G,Villanacci V,Antonelli E,et al.Enteric glial cells:new players in gastrointestinal motility?[J].Lab Invest,2007,87(7):628
