葡聚糖硫酸钠(DSS)诱导的小鼠肠炎模型中CD19+CD5+CD1dhiB细胞的表达及抑炎作用
2013-11-19汪路曼刘小明常丽君储以微
汪路曼 钱 静 刘小明 常丽君 储以微
(复旦大学基础医学院免疫学系 上海 200032)
人类炎症性肠病(inflammatory bowel disease,IBD)是一种肠道免疫系统异常反应所致的肠道炎症损伤性病变,包括克罗恩氏病(Crohn's disease,CD)和溃疡性结肠炎(ulcerative colitis,UC),其病因和发病机制尚未完全明确[1-2]。葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的小鼠肠道损伤是人类炎性肠病的实验性动物模型。其病程可分为炎症加重期(第1~10天)和炎症缓解期(第11天后),主要症状为腹泻、便血和体重减轻,病理学表现为全结肠的炎性细胞浸润和糜烂[3-5]。
作为机体中一类重要的免疫细胞,B细胞在免疫和炎症反应中行使着多种功能。B细胞不仅可以介导体液免疫和细胞免疫发挥正性免疫调节作用,近年来的研究显示B细胞中还存在着发挥负性调节作用的细胞亚群[6-7]。CD19+CD5+CD1dhiB 细胞是新近报道的一种发挥负性调节作用的B细胞,其免疫调节作用已在多种疾病模型中得到证实[8-9]。然而有关这类B细胞在肠炎模型中的研究不多,尤其在疾病过程中其数量比例以及功能的动态变化尚不清楚。因此,本文拟以DSS诱导的小鼠肠炎为研究模型,聚焦CD19+CD5+CD1dhiB细胞,通过流式检测其在疾病发展中的比例变化,分析其在疾病进程中的抑炎作用,为临床IBD的研究和疾病的治疗提供新思路。
材料和方法
实验动物及试剂 8~12周雌性C57BL/6小鼠(200只)购于斯莱克公司,SPF级环境饲养于复旦大学基础医学院动物实验中心。相对分子质量(Mr)为36 000~50 000的DSS购自美国MP Biomedicals公司;脂多糖(LPS)、离子霉素(Ionomycin)、佛波酯(PMA)均购自美国Sigma公司;莫能星(monensin),抗 CD16/CD32 Fc block,FITC-抗 CD19,IFN-γ,TNF-α和IL-6 ELISA抗体均购自美国eBioscience公司;PE-抗CD5和Alexa flour 647-抗CD1d购自美国Biolegend公司。
肠炎模型的诱导以及疾病评价 给予雌性C57BL/6小鼠含有3.5%DSS的饮用水,7天后改成正常饮用水。根据文献报道及实验指标,第0~10天为肠炎急性期,第11~25天为肠炎消退期,分别在第8天和第12天处死小鼠,作为不同阶段的实验组,未饮用3.5%DSS水的小鼠作为健康对照组,每组至少5只小鼠。疾病临床评分(disease activity index,DAI)包括体质量下降的程度、大便性状以及有无便血。小鼠在不同时间点处死后,取肠组织固定在10%甲醛中,用切片机将其切成5 μm厚度,苏木精-伊红染色并进行病理学评分:0分,正常;1分,轻度炎症,散在的单个核细胞浸润;2分,中度炎症,多发性病灶;3分,重度炎症,血管增生以及肠壁显著增厚;4分,严重的炎症反应,伴随透壁性炎性细胞浸润以及肠道杯状细胞脱落。每只小鼠的肠道组织观察4个视野,取平均值作为该小鼠的病理学评分。
流式检测脾细胞中CD19+CD5+CD1dhiB细胞的表达 不同时间点的小鼠断颈处死,70%酒精浸泡消毒后,取小鼠脾脏,研磨成单个细胞后重悬于PBS缓冲液中,置于15 mL离心管并插于冰盒中。1 500 r/min离心5 min,弃上清,加入红细胞裂解液裂解红细胞后,1 500 r/min离心5 min,弃上清,加入10 mL RPMI1640细胞培养液重悬,细胞计数。取1×106细胞于流式管中,加入封闭细胞Fc端的抗体抗 CD16/CD32 ,4℃、15 min后加入抗 CD19、抗CD5、抗CD1d抗体,4℃下避光反应 30 min,洗涤2次(1 500 r/min,离心5min),加入流式洗涤液300 μL重悬,用流式细胞仪分析。
体内转输实验 如前所述,不同时间点的小鼠断颈处死,脾细胞制成单细胞悬液,用流式抗体抗CD19、抗CD5、抗CD1d抗体染色后,用细胞分选仪分选出 CD19+CD5+CD1dhiB细胞。将1×106/100 μL浓度的细胞通过尾静脉转输到DSS诱导1天的小鼠体内,PBS组作为阴性对照。观察小鼠的体重变化,给予DAI评分。
局部细胞因子的检测 取转输了CD19+CD5+CD1dhiB细胞的DSS小鼠局部肠组织,加入含蛋白酶抑制剂的PBS碾碎后,离心(12 000×g,20 min)取上清,用ELISA试剂盒检测肠局部IFN-γ,TNF-α和IL-6的表达。
统计学分析 用统计软件 Prism 5.0分析,两组间比较采用 t检验,多组间比较采用 One-way ANOVA检验,P<0.05为差异有统计学意义。
结 果
小鼠肠炎模型的疾病评估 对经DSS诱导的肠炎小鼠分别进行体质量、临床评分(DAI)以及病理学评分,结果显示:第0~10天,小鼠体质量减轻,DAI疾病指数升高,病理学切片发现肠壁有大量炎症细胞浸润,肠黏膜受损、肠腺体杯状细胞减少(放大倍数:200×),病理学评分增高,表明0~10天是小鼠肠炎的疾病加重期;而11天后,小鼠体质量回升、DAI及病理学评分则逐步下降,提示11天以后为疾病的恢复期(图1A~C)。
肠炎病程中CD19+CD5+CD1dhiB细胞的改变我们首先检测了肠炎小鼠脾脏中B细胞的变化,发现与对照组相比,DSS处理组B细胞比例增加(P=0.046 4,t=2.849,图2A)。随后,我们对于代表正常(第0天)、炎症急性期(第8天)以及炎症恢复期(第12天)小鼠脾细胞中的CD19+CD5+CD1dhiB细胞的比例分别进行了分析,结果显示在炎症急性期,脾细胞中的CD19+CD5+CD1dhiB细胞的比例明显增加(P=0.000 9,F=28.13,图2B)。

图1 DSS诱导的小鼠肠炎模型(×200)Fig 1 DSS-induced inflammatory bowel disease model(×200)
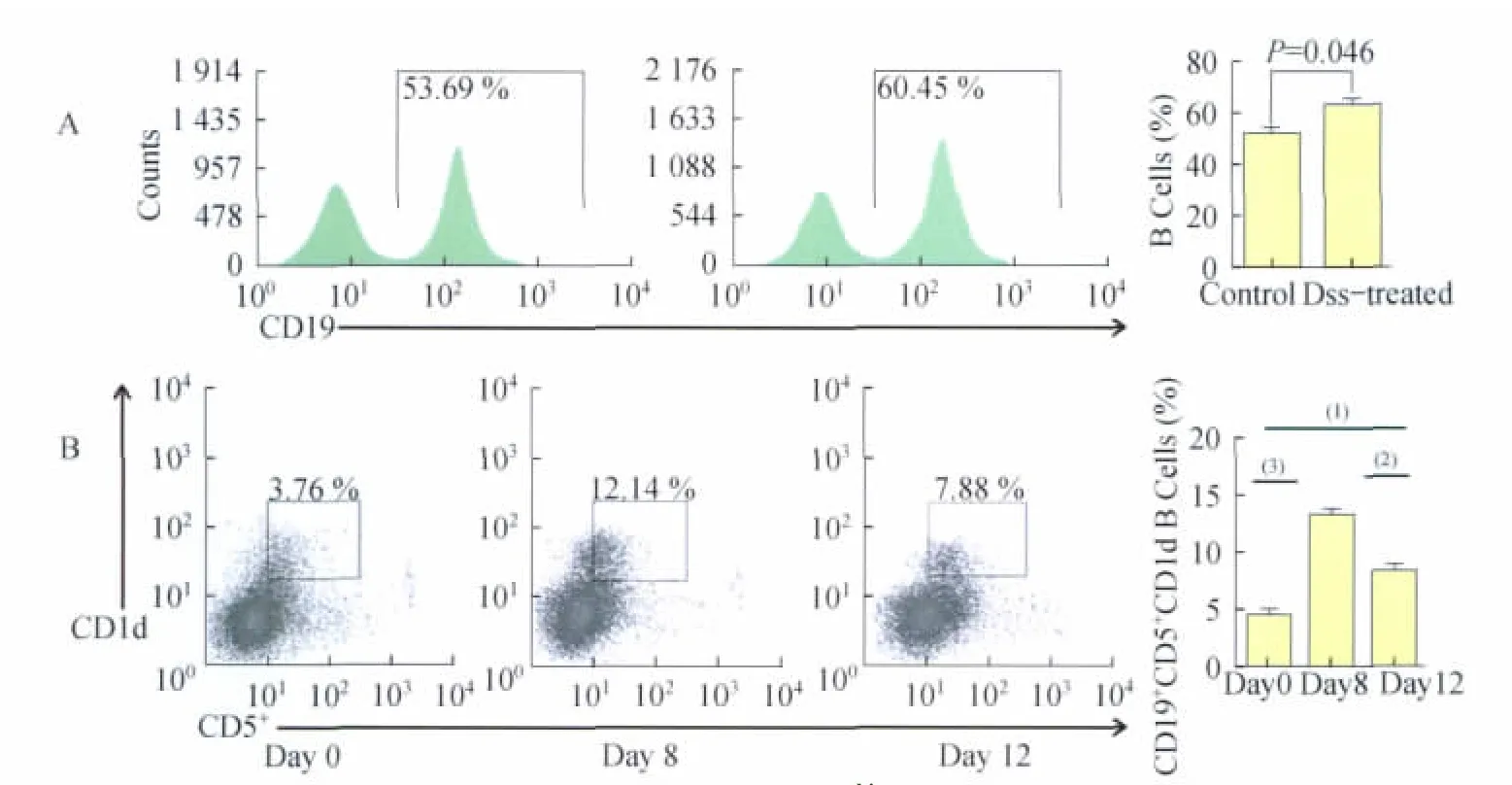
图2 肠炎小鼠脾脏中CD19+CD5+CD1dhiB细胞的比例变化Fig 2 The proportion change of splenic B cells and CD19CD5CD1dB cells in DSS-induced inflammatory bowel disease
CD19+CD5+CD1dhiB细胞在炎症不同时期的功能差异 为了探究CD19+CD5+CD1dhiB细胞在炎症不同阶段的功能改变,我们在DSS诱导的小鼠肠炎模型中分选第0、8和12天小鼠脾细胞中CD19+CD5+CD1dhiB细胞,分别转输到DSS诱导的急性期小鼠体内(图3A)。结果发现,只有转输了第8天即炎症急性期的CD19+CD5+CD1dhiB细胞能使小鼠急性肠炎症状得到减轻,而转输了第0天和第12天的CD19+CD5+CD1dhiB细胞,小鼠肠炎症状无明显改善(图3B)。提示在肠炎急性期,CD19+CD5+CD1dhiB细胞的抑炎功能增强。
CD19+CD5+CD1dhiB细胞对肠道炎性因子的影响 IFN-γ,TNF-α和IL-6是小鼠肠炎模型中肠道重要的炎性因子,为了验证CD19+CD5+CD1dhiB细胞对于它们的作用,我们分别检测了转输PBS对照组和炎症急性期CD19+CD5+CD1dhiB细胞的小鼠肠道局部炎性因子的变化。结果表明转输CD19+CD5+CD1dhiB 细胞可明显下调 IFN-γ、TNF-α 和IL-6的分泌(图4),提示下调局部炎性细胞因子的产生很有可能是CD19+CD5+CD1dhiB细胞的免疫调节机制之一。
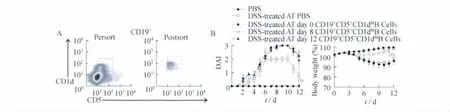
图3 体内转输CD19+CD5+CD1dhiB细胞的抑炎作用Fig 3 CD19+CD5+CD1dhiB cells suppress disease symptoms in DSS-induced inflammatory bowel disease
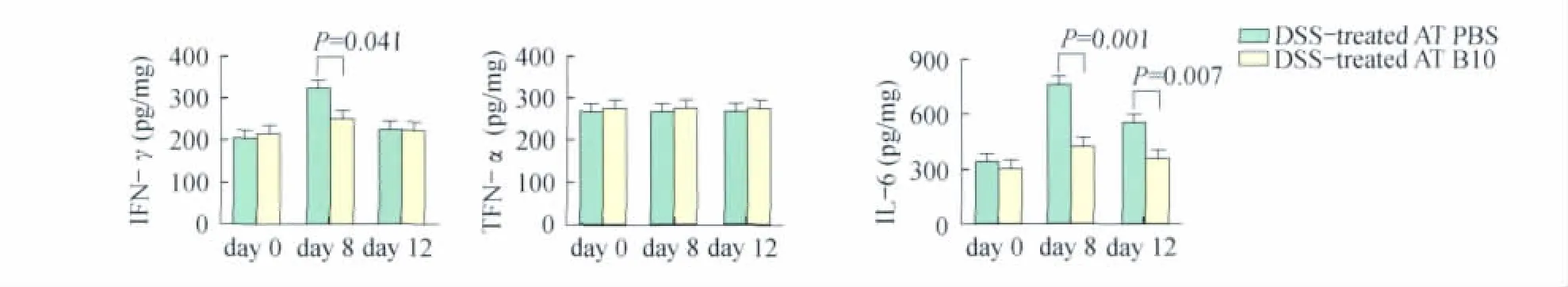
图4 CD19+CD5+CD1dhiB细胞抑制肠道炎性因子的分泌Fig 4 The secretion of inflammatory cytokine in local intestine after CD19+CD5+CD1dhiB cells adoptive transfer
讨 论
我们的研究表明,CD19+CD5+CD1dhiB细胞可能在小鼠肠炎模型中发挥着重要的保护性作用。脾脏中CD19+CD5+CD1dhiB细胞的比例与肠炎的严重程度正相关;体内转输CD19+CD5+CD1dhiB细胞可有效控制疾病的进展,改善疾病的症状;CD19+CD5+CD1dhiB细胞的转输可明显降低肠道局部炎性细胞因子的分泌。以上结果表明,CD19+CD5+CD1dhiB细胞可通过抑制肠道炎性细胞因子的分泌在小鼠肠炎模型中发挥着负性调节作用。此外,我们的研究还发现只有疾病急性期(第8天)的CD19+CD5+CD1dhiB细胞才具备有效的抑炎作用,疾病的初始期(第0天)及恢复期(第12天),此类细胞的负性免疫调节功能不明显,提示CD19+CD5+CD1dhiB细胞的功能变化也与小鼠肠炎病情严重程度密切相关。这与文献报道[10]相吻合:研究表明,正常小鼠体内CD19+CD5+CD1dhiB细胞不具备抑制作用,只有处于炎症环境中,CD19+CD5+CD1dhiB细胞的免疫功能才能被激活,从而起到缓解和调节疾病的作用。本研究中,处于健康状态的第0天,小鼠CD19+CD5+CD1dhiB细胞处于“静息”状态,因而不具备调节功能;而在第8天,炎症处于急性期,CD19+CD5+CD1dhiB被“激活”,产生了调节性作用;转输实验表明,外源性增加CD19+CD5+CD1dhiB可以缓解疾病的症状,但是其调节疾病的途径目前存在争议。文献表明IL-10是CD19+CD5+CD1dhiB调节疾病的主要方式,然而越来越多的证据表明,CD19+CD5+CD1dhiB及其他类型的调节性B细胞通过IL-10非依赖的方式协同其他调节性细胞缓解疾病[11-17]。此外,在炎症环境中具体是什么因素促进了CD19+CD5+CD1dhiB细胞的调节作用,尚需进一步的研究证明。本研究中,处于第12天缓解期的CD19+CD5+CD1dhiB细胞同样不具有调节性作用,可能是由于炎症环境减轻后,CD19+CD5+CD1dhiB细胞受到的刺激作用减弱,调节作用不能持续,这个发现有待进一步验证。
调节性B细胞是一群以分泌IL-10为主要特点的免疫功能负调性细胞,它参与调节多种自身免疫疾病并促进肿瘤转移[18-19]。在自身免疫性疾病小鼠模型中,如类风湿关节炎和实验性自身免疫性脑脊髓炎,清除小鼠体内的B细胞会加重病情,降低自愈倾向[8]。在人外周血中,CD19+CD24hiCD38hi和CD19+CD24hiCD27hiB细胞亚群被证实具有很强的抑制功能[20-21]。而在小鼠体内,调节性 B细胞(Breg)包含在几乎每一个B细胞亚群中,比如脾脏的过渡2型 B细胞(T2-MZP),边缘性 B细胞(MZB),腹腔淋巴结中的B-1a型B细胞等,在小鼠脾脏中,通常用CD19+CD5+CD1dhi表示调节性B细胞[8-9,22]。本研究发现,在炎症状态最为严重的急性期,CD19+CD5+CD1dhiB细胞的比例增多,抑制效率增强;而在炎症消退后,其比例减少,抑制功能也下降到了正常水平。由此可见,CD19+CD5+CD1dhiB细胞与小鼠肠炎疾病进程有着强烈的正相关性,可能起着与炎性免疫细胞相互制约的作用,并为IBD的自愈倾向打下了基础。
本研究证实,抑制炎性因子的分泌可能是调节性B细胞发挥体内免疫抑制作用的方式之一。深入研究其调节机制将为自身免疫病的治疗提供新的契机。
[1] Maloy KJ,Powrie F.Intestinal homeostasis and its breakdown in inflammatory bowel disease[J].Nature,2011,474(7351):298-306.
[2] Danese S,Fiocchi C.Ulcerative colitis[J].N Engl J Med,2011,365(18):1713 -1725.
[3] Sugimoto K.Role of STAT3 in inflammatory bowel disease[J].World J Gastroenterol,2008,14(33):5110 - 5114.
[4] Yanaba K,Yoshizaki A,Asano Y,et al.IL-10-producing regulatory B10 cells inhibit intestinal injury in a mouse model[J].Am J Pathol,2011,178(2):735 - 743.
[5] Okayasu I,Hatakeyama S,Yamada M,et al.A novel method in the induction of reliable experimental acute and chronic ulcerative colitis in mice[J].Gastroenterology,1990,98(3):694-702.
[6] Lund FE,Randall TD.Effector and regulatory B cells:modulators of CD4(+)T cell immunity[J].Nat Rev Immunol,2010,10(4):236 -247.
[7] Mauri C,Bosma A.Immune regulatory function of B cells[J].Annu Rev Immunol,2012,30:221 - 241.
[8] Dilillo DJ,Matsushita T,Tedder TF.B10 cells and regulatory B cells balance immune responses during inflammation,autoimmunity,and cancer[J].Ann NY Acad Sci,2010,1183:38-57.
[9] Yanaba K,Bouaziz JD,Haas KM,et al.A regulatory B cell subset with a unique CD1dhiCD5+phenotype controls T celldependent inflammatory responses[J].Immunity,2008,28(5):639-650.
[10] Mizoguchi A,Bhan AK.A case for regulatory B cells[J].J Immunol,2006,176(2):705 -710.
[11] Ray A,BasuS,WilliamsCB,etal.A novelIL-10-independentregulatory role forB cellsin suppressing autoimmunity by maintenance of regulatory T cells via GITR ligand[J].J Immunol,2012,188(7):3188 -3198.
[12] Kaneko Y,Nimmerjahn F,Ravetch JV.Anti-inflammatory activity of immunoglobulin G resulting from Fc sialylation[J].Science,2006,313(5787):670 -673.
[13] Mann MK,Maresz K,Shriver LP,et al.B cell regulation of CD4+CD25+T regulatory cells and IL-10 via B7 is essential for recovery from experimental autoimmune encephalomyelitis[J].J Immunol,2007,178(6):3447 -3456.
[14] Parekh VV,Prasad DV,Banerjee PP,et al.B cells activated by lipopolysaccharide,but not by anti-Ig and anti-CD40 antibody,induce anergy in CD8+T cells:role of TGF-beta 1[J].J Immunol,2003,170(12):5897 -5911.
[15] Sonoda KH,Stein-Streilein J.CD1d on antigen-transporting APC and splenic marginal zone B cells promotes NKT celldependent tolerance[J].Eur J Immunol,2002,32(3):848-857.
[16] Carter NA,Rosser EC,Mauri C.IL-10 produced by B cells is crucial for the suppression of Th17/Th1 responses,induction of Tr1 cells and reduction of collagen-induced arthritis[J].Arthritis Res Ther,2012,14(1):R32.
[17] Lundy SK.Killer B lymphocytes:theevidenceand the potential[J].Inflamm Res,2009,58(7):345 -357.
[18] Li X,Braun J,Wei B.Regulatory B cells in autoimmune diseases and mucosal immune homeostasis [J].Autoimmunity,2011,44(1):58 -68.
[19] Fillatreau S,Sweenie CH,Mcgeachy MJ,et al.B cells regulate autoimmunitybyprovision ofIL-10[J].Nat Immunol,2002,3(10):944 -950.
[20] Blair PA,Norena LY,Flores-Borja F,et al.CD19(+)CD24(hi)CD38(hi)B cells exhibit regulatory capacity in healthy individuals but are functionally impaired in systemic lupus erythematosus patients[J].Immunity,2010,32(1):129-140.
[21] Iwata Y,Matsushita T,Horikawa M,et al.Characterization of a rare IL-10-competent B-cell subset in humans that parallels mouse regulatory B10 cells[J].Blood,2011,117(2):530-541.
[22] Fillatreau S,Gray D,Anderton SM.Not always the bad guys:B cells as regulators of autoimmune pathology[J].Nat Rev Immunol,2008,8(5):391 -397.
