血清铜生化对肝豆状核变性的诊断意义
2013-11-19吴君霞薛明月刘庆云胡纪源
吴君霞, 杨 茜, 薛明月, 刘庆云, 胡纪源
(安徽中医学院神经病学研究所附属医院检验科,安徽合肥230031)
肝豆状核变性(HLD)是一种原发性铜代谢障碍的常染色体隐性遗传性疾病,临床表现差异较大,误诊率较高。HLD基因突变类型超过515种,至少379种可能为致病突变[1]。如此多的突变类型使HLD基因诊断较难普遍开展。目前诊断HLD主要依靠患者的临床表现和各种辅助检查。辅助检查中肝铜测定是诊断HLD的金标准,但其属创伤性检查手段,难以作为常规检查方法[2];角膜K-F环在HLD早期阳性率很低;24 h尿铜检查留取较为不便。为此,我们对HLD患者的铜生化[血清铜离子(Cu2+)、铜氧化酶(SCO)和铜兰蛋白(CP)]进行分析,以探讨其对HLD的诊断意义。
材料和方法
一、对象
选取安徽中医学院神经病学研究所附属医院2010年住院的288例HLD患者,其中男175例、女113例,年龄4~56岁。采用HLD分型标准[3]将288例HLD分为假性硬化型42例、脑内脏混合型49例、肝型138例、Wilson型59例。选择同期安徽中医学院神经病学研究所附属医院体检健康者90名作为正常对照组,其中男59名,女31名,年龄3~79岁,体检时无炎症和病毒感染,血清甲型肝炎抗体、乙型肝炎7项、丙型肝炎抗体均阴性。
二、诊断标准
排除其他肝胆疾病,至少符合下述表现中的3项:(1)肝病表现;(2)神经系统表现;(3)角膜K-F环阳性;(4)排除其他原因的血清Cu2+、CP水平和SCO活力低下;(5)驱铜治疗前24 h尿Cu2+>100μg和(或)青霉胺驱铜试验阳性。
三、样本采集
HLD组与正常对照组均早晨空腹采集静脉血5 mL,1 h内分离血清,当日检测血清Cu2+、SCO和CP。
四、方法
血清Cu2+测定采用原子吸收光谱法,仪器为北京海光仪器公司生产的GGX-800型原子吸收分光光度计;血清CP测定采用免疫透射比浊法,试剂由浙江伊利康公司生产,仪器为日立7020全自动生化分析仪;SCO采用盐酸对苯二胺比色法[3],试剂自行配制。
五、统计学方法
采用SPSS 13.0软件进行数据分析。Cu2+、CP数据为正态分布,采用±s表示,运用ANOVA单因素方差分析;SCO为偏态分布,采用中位数(范围)表示,运用非参数检验的多个独立样本检验进行分析。P<0.05表示差异有统计学意义。
结 果
一、血清Cu2+、SCO和CP之间的相关性分析
3个项目之间均呈正相关。Cu2+与SCO的相关系数(r)=0.57(P<0.01),与CP的r=0.556(P<0.01);SCO 与CP的r=0.81(P<0.01)。
二、HLD组和正常对照组血清铜生化结果比较
HLD组及正常对照组男、女之间血清铜生化结果差异无统计学意义(P>0.05)。
288例HLD患者中有3例(2例为肝型、1例为Wilson型)血清铜生化结果正常;其余285例患者血清铜生化结果均降低,异常率为98.96%。285例血清铜生化降低的HLD患者血清Cu2+、SCO和CP水平均明显低于正常对照组(P<0.01)。见表1。
三、285例血清铜生化降低的HLD患者各临床分型的血清铜生化结果
假性硬化型HLD患者的血清Cu2+水平明显高于脑内脏混合型、肝型和Wilson型(P<0.05、P<0.01);Wilson型HLD患者血清SCO水平明显低于肝型及假性硬化型(P<0.01),CP水平明显低于肝型及脑内脏混合型(P<0.05、P<0.01)。见表2。
表1 285例血清铜生化降低的HLD患者及正常对照组铜生化结果比较±s)

表1 285例血清铜生化降低的HLD患者及正常对照组铜生化结果比较±s)
注:与正常对照组比较,*P<0.01
正常对照组 90 15.09±2.42 0.492(0.269~0.798)306.37±46.84
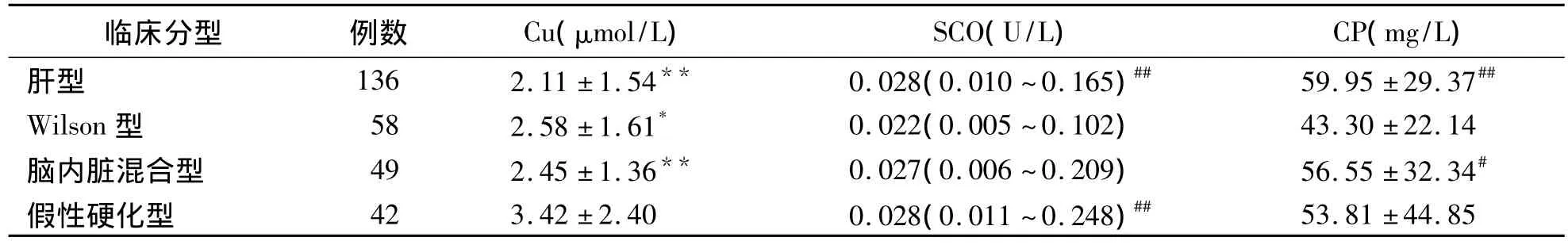
表2 285例血清铜生化降低的HLD患者各临床分型血清铜生化结果比较
四、285例血清铜生化降低的HLD患者按年龄分组后血清铜生化结果比较
0~10岁组血清Cu2+水平明显低于11~20岁组、21~30岁组和≥31岁组(P<0.05、P<0.01);11~20岁组血清Cu2+水平明显低于21~30岁组和≥31岁组(P<0.01),而 21~30岁与≥31岁组之间差异无统计学意义(P>0.05)。≥31岁组SCO和CP水平明显高于其他年龄组(P<0.05、P<0.01),而其他各年龄组之间差异无统计学意义(P>0.05)。见表3。
表3 285例血清铜生化异常HLD患者不同年龄分组铜生化结果的比较(±s)
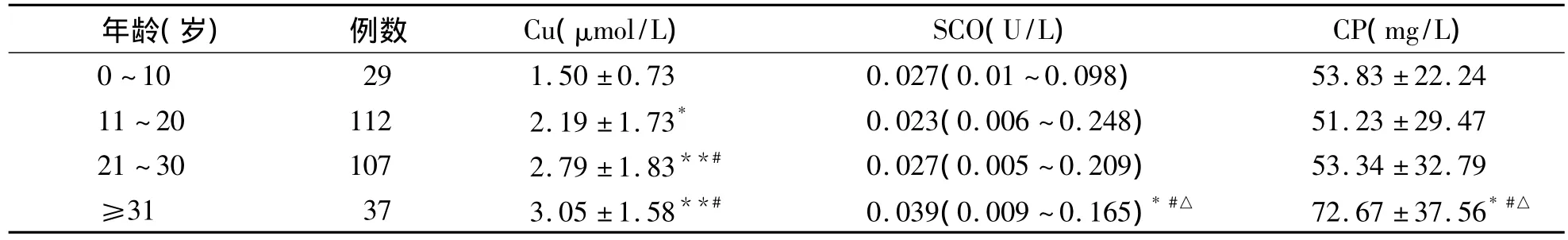
表3 285例血清铜生化异常HLD患者不同年龄分组铜生化结果的比较(±s)
注:与0~10岁组比较,*P<0.05,**P<0.01;与11~20岁组比较,#P<0.01;与≥21~30岁组比较,△P<0.01
21~30 107 2.79±1.83**# 0.027(0.005~0.209) 53.34±32.79≥31 37 3.05±1.58**# 0.039(0.009~0.165)*#△ 72.67±37.56*#△
五、血清铜生化诊断HLD的受试者工作特征(ROC)曲线分析
血清Cu2+、SCO和CP诊断HLD的ROC曲线下面积(AUC)分别为0.995、0.994 和0.996;最佳诊断界值分别为6.34 μmol/L、0.121 U/L 和123.1 mg/L;灵敏度、特异性和误判率均相同,分别为95%、100%和0%。见表4、图1~3。
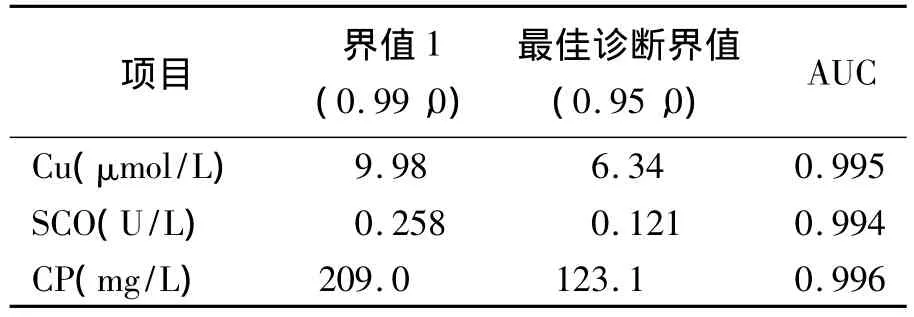
表4 血清铜生化诊断HLD的ROC分析
图1 血清Cu2+的ROC曲线
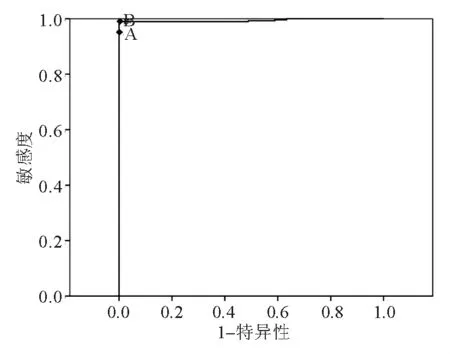
图2 SCO的ROC曲线
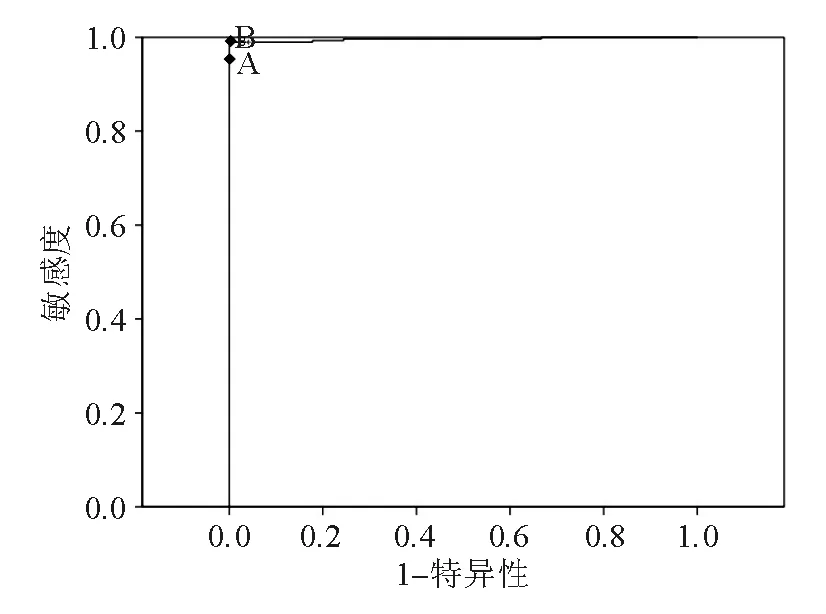
图3 CP的ROC曲线
讨 论
HLD是目前少数可以治疗的几种遗传病之一,其致病机制是ATP7B酶的功能缺陷,使饮食吸收的铜不能经胆道正常排出,导致铜在肝脏、中枢神经系统及肾脏等脏器的大量沉积造成多脏器功能损害。CP降低是诊断HLD最早和最常用的指标。CP的前体在肝脏合成后,必须在ATP7B酶的作用下与Cu2+结合形成全CP才能完成其功能。每个全CP分子与6个Cu2+结合,然后释放入血液,其含铜量占血浆总铜量的90%~95%,是血浆中Cu2+的主要结合形式。
CP具有氧化酶活性又称SCO[4]。本研究中SCO测定即检测CP酶的活性,CP测定即测定CP的含量。国外报道[5]有10%的HLD患者CP正常,但本研究288例确诊病例中只有3例正常,可能与目前诊断HLD比较依赖铜生化指标有关,使一些铜生化正常的HLD患者被漏诊。CP正常的HLD患者可能是该蛋白功能异常[6]。
本研究显示铜生化结果异常的HLD组血清Cu2+、CP和SCO显著低于正常对照组;不同临床型HLD患者铜生化结果显示Wilson型的CP和SCO低于其他临床型,假性硬化型的血清Cu2+高于其他临床型。HLD患者不同年龄分组中0~10岁组的血清Cu2+最低,≥31岁组铜生化结果高于其他年龄组,这可能与其基因突变类型有关,具体机制有待于进一步研究。
本研究中血清Cu2+、CP和SCO的AUC分别为0.995、0.994 和0.996,表明铜生化检测项目对HLD的诊断效果很高。有研究报道认为CP<80 mg/L可作为诊断HLD的诊断指标[7]。CP是急性时相反应蛋白,在肝功能异常、肝硬化、肝炎和肾病综合症等时亦可降低,是一种非特异性的降低,在治疗后有升高和恢复的趋势,而HLD患者CP水平在治疗前后变化不大[8]。因此,为避免误诊,将铜生化诊断HLD的最佳诊断界值定为Cu2+≤6.34 μmol/L、SCO≤0.121 U/L 和CP≤123.1 mg/L,3个项目的灵敏度和特异性均相同,分别为95%和100%。
HLD好发于儿童和青少年,我国发病率高于西方国家,临床表现多样,早期确诊至关重要,可以降低其致残率和死亡率。本研究显示血清铜生化指标3项结果呈正相关,对HLD诊断的效率高。联合检查3项指标可以避免因单独检测CP可能出现误差而导致的误诊和漏诊,使HLD患者早诊断、早治疗。
[1]杨华荣,宋 治,邓 昊.肝豆状核变性的遗传学研究进展[J].国际遗传学杂志,2009,32(6):444-448.
[2]Roberts EA,Schilsky ML,American Association for Study of Liver Diseases(AASLD).Diagnosis and treatment of Wilson disease:an update[J].Hepatology,2008,47(6):2089-2111.
[3]杨任民.肝豆状核变性[M].合肥:安徽科技出版社,1995:77-205.
[4]郭云良,郭宗君,郑建忠,等.神经病学实验技术[M].西安:第四军医大学出版社,2005:78.
[5]Brewer GJ.Recognition,diagnosis,and management of Wilson's Disease[J].Proc Soc Exp Biol Med,2000,223(1):39-46.
[6]Forbes JR,Cox DW.Copper-dependent trafficking of Wilson disease mutant ATP7B proteins[J].Hum Mol Genet,2000,9(13):1927-1935.
[7]黄 丽,李洵桦,梁秀龄,等.各种辅助检查对肝豆状核变性的诊断价值[J].临床神经病学杂志,2006,19(1):8-11.
[8]陈 珺,冯子敬,薛启缮,等.血清铜蓝蛋白氧化酶活性检测及其结果分析[J].中国临床神经科学,2006,14(6):625-628.
