肥大细胞促早期胃癌形成及其生物学意义
2013-11-19刘亚楠蔺丽慧戴慧蓉
刘亚楠, 蔺丽慧, 王 娟, 李 佳, 彭 霞, 肖 辉, 李 飞, 戴慧蓉, 李 莉
(上海市第一人民医院检验科,上海200080)
近年来炎症在肿瘤发生发展中的作用越来越受重视[1-2],肿瘤组织中有大量的炎症细胞浸润,其中肥大细胞(mast cell,MC)引起人们的广泛关注。MC参与了多种肿瘤的形成与进展,如胰腺癌、肝癌、肺癌、恶性黑色素瘤、前列腺癌及胃癌等,同时部分研究认为MC与肿瘤患者预后相关[3-4]。但这些研究结果尚存在争议。胃癌形成的Correa途径[5-6]在癌症病理变化中发挥重要作用,但MC在该疾病演变过程中的作用较少被关注。我们采用免疫组化法标记MC,初步了解胃疾病演变过程(胃良性病变、胃癌前病变、胃癌)组织中MC的数目分布情况及其与患者生存期的相关性,并分析二者与临床病理资料的关系,探讨MC在胃癌发生、发展中的作用。
材料和方法
一、材料
1.对象 选取2008年至2011年上海市第一人民医院手术切除及胃镜活检标本。胃癌标本59例(高分化10例、中分化17例、低分化32例;Ⅰ期13例、Ⅱ期12例、Ⅲ期26例、Ⅳ期8例),其中男24例,女25例,年龄27~86岁,TNM分期按国际抗癌联盟1997年标准判定。胃癌前病变(慢性萎缩性胃炎伴肠化)标本40例,其中男27例,女13例,年龄41~84岁。胃良性病变(慢性非萎缩性胃炎)标本33例,其中男16例,女17例,年龄34~79岁。标本经10%中性福尔马林固定,常规石蜡包埋,4 mm厚连续切片,进行免疫组化。所有病例经病理切片和免疫组化染色确诊。
2.试剂 抗MC类胰蛋白酶的单克隆抗体(AA1,DAKO)、二步法抗兔/抗鼠通用型免疫组化检测试剂盒(EnVisionTMDetection KIT)购自基因科技(上海)有限公司。BASO苏木素(梅尔氏)购自珠海贝索生物技术有限公司。
二、方法
1.免疫组织化学染色 将切片脱蜡并梯度酒精水化,蒸馏水洗涤;柠檬酸缓冲液(pH值6.0)微波抗原修复15 min,切片完全冷却后,PBS洗涤3次;3%H2O2去除内源性过氧化物酶影响。5%牛血清白蛋白(BSA)封片30 min后,弃封闭液,加入1∶5 000稀释的抗MC类胰蛋白酶的单克隆抗体50 μL,放湿盒内4℃过夜孵育;磷酸盐缓冲液(PBS)充分洗涤3次后加入二抗50μL,室温孵育30 min;PBS充分洗涤3次后加入1∶50稀释的二氨基联苯胺(DAB)显色液50μL,显微镜下观察,适时终止反应;BASO苏木素(梅尔氏)染色30 s后流水内充分返蓝;梯度酒精脱水后烤片5 min,中性树胶封片。经免疫组化染色,MC的胞浆呈棕色,避开组织边缘及坏死区,各组织标本在高倍视野下连续计数5个MC密集区中MC数量,求其平均数。
2.随访 所有患者均采用电话方式进行随访,随访时间为2~54个月。无法与患者或家属取得联系者视为失访。
三、统计学方法
用SPSS17.0软件进行统计分析。用Shapiro-Wilk进行数据正态性检验。以±s表示MC在胃组织中的数量,两两比较采用t检验,多组间比较用单因素方差分析或LSD法。根据疾病种类及MC绘制Kaplan-Meier生存曲线。
结 果
一、不同病变组织中MC免疫组织化学染色结果
被染成棕色的MC主要分布在胃腺泡的间质及上皮下。其中胃癌、胃癌前病变组织中的MC数量明显高于胃良性病变组织;胃癌前病变组织中的MC数量明显高于胃癌组织,见图1。
二、各组MC计数统计结果
胃癌组、胃癌前病变组、胃良性病变组MC数量经正态性检验分析符合正态分布,P值依次为0.102、0.315、0.916。胃癌组、胃癌前病变组、胃良性病变组标本每个高倍视野平均MC个数依次为29±11、40±12、20±5。3组之间差异均有统计学意义(P均<0.05)。见图2。
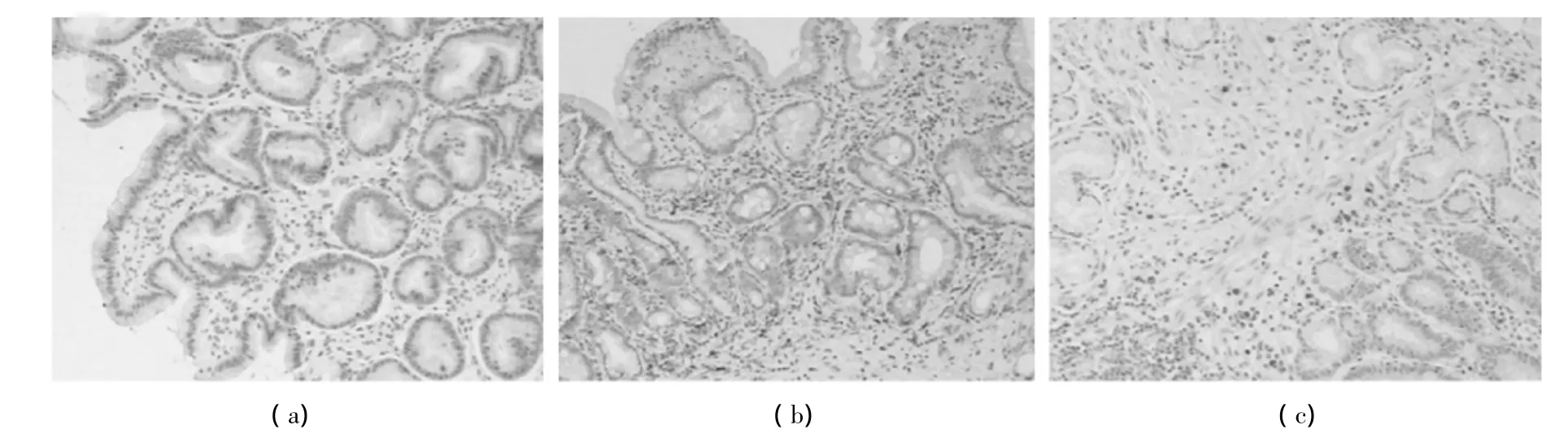
图1 免疫组化标记类胰蛋白酶阳性MC(×100)
三、胃癌前病变组织MC数量与各临床病理资料关系
幽门螺杆菌(helicobacter pylori,HP)(+)胃癌前病变患者的MC数量明显高于HP(-)的患者(P<0.05);而炎症程度及活动性、组织萎缩程度及肠化生程度之间MC数量差异均无统计学意义(P 均>0.05),见表1。
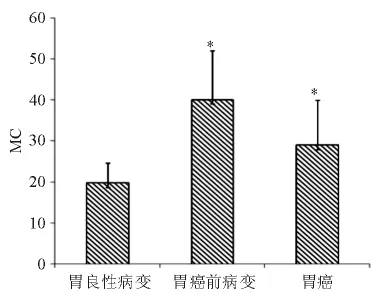
图2 胃癌变组织中肥大细胞数量比较
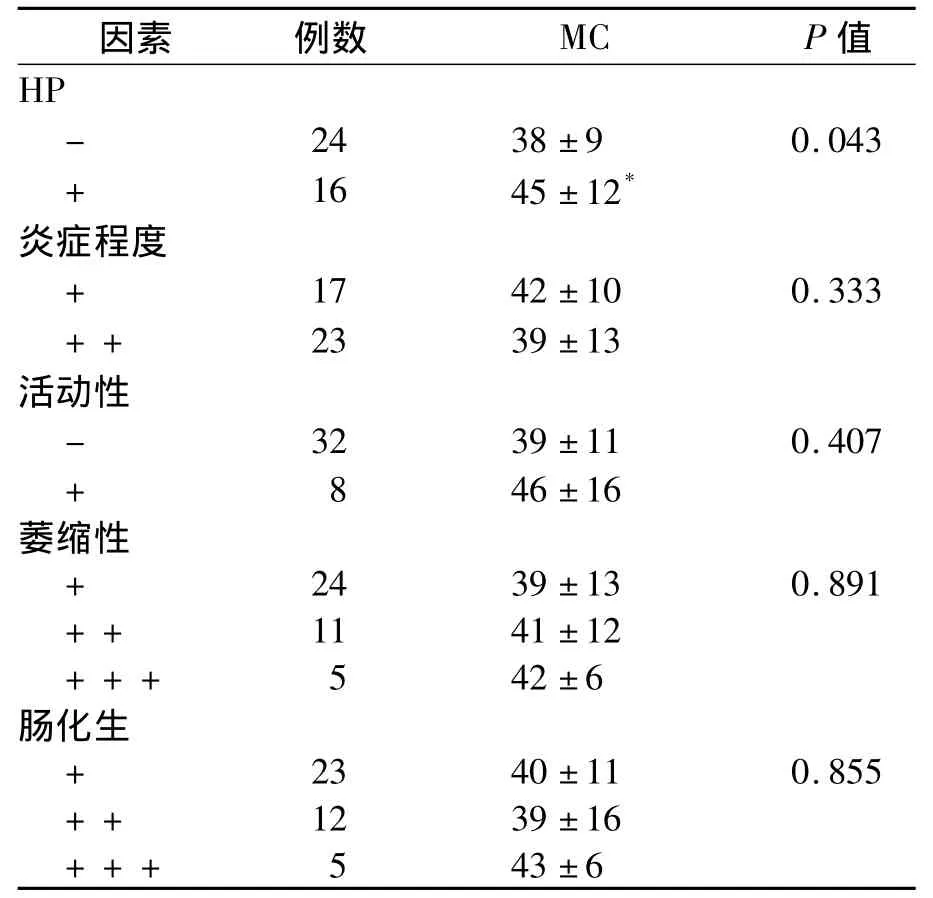
表1 胃癌前病变患者临床病理资料与MC数量的关系
四、胃癌组织MC数量与各临床病理资料关系
HP(-)和HP(+)组MC数量比较有明显差异(P<0.05),Ki-67的表达强弱程度之间MC数量有明显差异(P<0.05);肿瘤TNM分期、浸润深度、分化级别、局域淋巴结转移、脉管浸润、神经浸润程度之间MC数量无明显差异(P>0.05)。见表2。
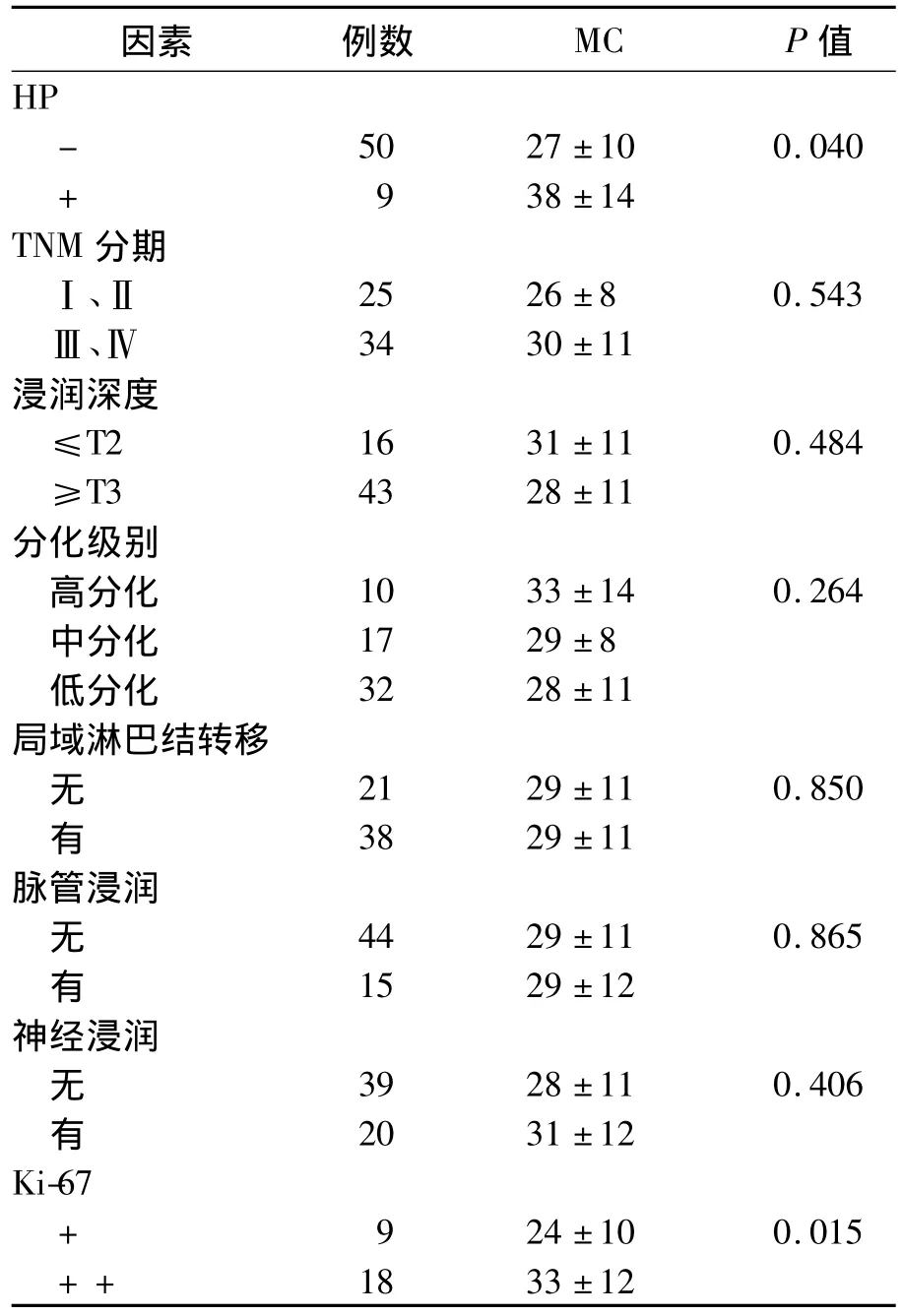
表2 胃癌患者临床病理资料与MC数量的关系
五、预后情况
胃癌组、胃癌前病变组分别以MC数量的中位数(28、43)为界限各分为2组。胃癌及胃癌前病变中MC高水平组与低水平组生存期比较差异均无统计学意义(P均>0.05)。见图3。
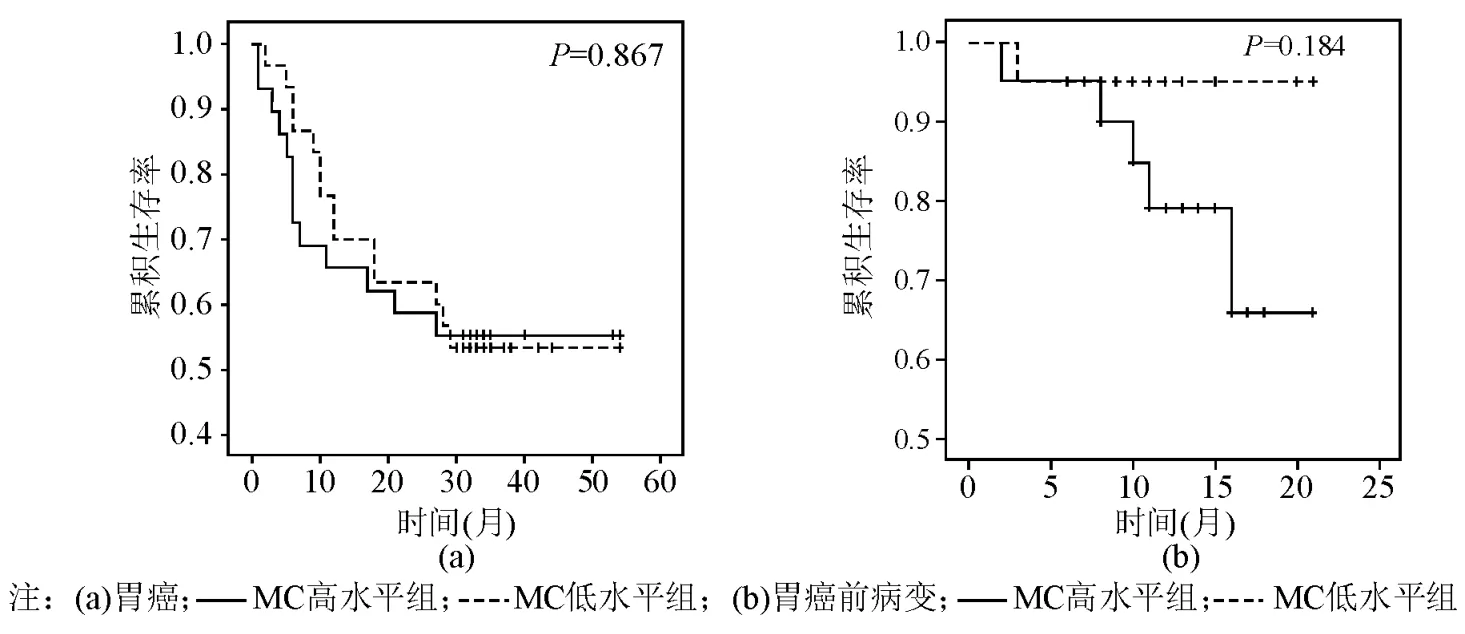
图3 胃癌及胃癌前病变患者MC高水平组与低水平组生存期比较
讨 论
炎症反应在肿瘤形成发展的不同时期均发挥着重要作用,包括肿瘤始发、进展、恶性转化、浸润和转移[1]。许多研究发现肿瘤起源于炎症部位。应用非甾体类抗炎药物(NSAIDs)的个体患肿瘤的几率减少,这提示炎症能增加肿瘤易感性。同时,流行病学研究发现,常规应用NSAIDs能明显降低胃肠道肿瘤患者死亡率[7]。慢性炎症是胃癌发生的高危因素,多数与慢性感染有关,特别是HP。胃癌是一个多步骤进行性发展的疾病。长期感染或其他因素导致慢性炎症形成以腺体消失为特点的慢性萎缩性胃炎,随着病情进展部分患者发展为伴有肠化生或异型增生的癌前病变,而高达85%的非典型增生患者发展成胃癌[8]。但是导致这些病理变化的确切机制尚不十分明确。随着人们对肿瘤微环境的认识,炎症细胞的浸润,特别是MC在微环境中的生物学作用被人们所关注。
MC是功能多样的炎症细胞,一直以来人们对MC的关注都集中在过敏反应和抗感染方面。现在发现在许多肿瘤中,MC能直接影响肿瘤细胞增殖、侵袭,同时释放的多种生物活性介质能重构肿瘤微环境和调节机体对肿瘤细胞的免疫反应,最终影响肿瘤患者预后[3]。Ribatti等[9]发现MC通过促进血管增生参与胃癌的发生、发展,但没有分析在胃良性病变到胃癌前病变直至胃癌发生这一疾病演变过程中MC的作用及与各临床病理资料的关系。一些学者认为MC在肿瘤中的作用不仅取决于肿瘤形成发展时期,还取决于肿瘤的类型[10]。Soucek 等[11]在胰腺癌模型中发现MC是肿瘤形成早期唯一增加的炎症细胞并且与肿瘤进展相关。Gounaris等[12]发现MC在结肠发生癌变中起到重要作用。本研究发现胃癌前病变组织中MC平均数较胃良性病变高,提示MC可能在肿瘤形成早期发挥重要作用,这与以上文献结果一致;胃癌组织中MC数量明显多于良性病变,而比胃癌前病变组织中的有所减少。这说明在已形成的肿瘤中其生物学功能可能不再单纯依赖MC数量。胃癌组织中MC平均数高于胃良性病变,而在高、中、低分化胃腺癌组织中无差异,说明MC在肿瘤发展中发挥了一定的生物学作用,但与已形成的肿瘤的分化程度无明显关系。Ki-67是细胞增殖的重要标记[13],肿瘤细胞增殖状态可作为预测恶性肿瘤发展及预后的指标。本研究分析了27例胃癌组织中Ki-67的表达与MC的关系,发现Ki-67表达的强弱与MC数量存在明显的相关性,提示MC参与肿瘤增殖与进展。总之,MC参与肿瘤早期形成,而与肿瘤分化程度无关,推测可能与MC在肿瘤组织中的分布、亚型和活化状态有关。
本研究发现胃癌前病变患者中HP(+)高达40%,胃癌患者的阳性率为15.3%,同时MC与HP感染有明显的相关性,即HP(+)患者病变组织中浸润的MC增加。这与Nakajima等[14]的研究结果一致。HP感染是诱发萎缩性胃炎及病理进展成胃癌的主要因素,早在1994年就被认为是胃癌发生的Ⅰ类致癌物质[15]。HP在胃癌形成中的作用也一直被人们探讨研究,但仍存有疑问,单独的HP感染并不足以诱发胃癌。以往研究发现HP释放的VacA毒素能趋化MC到炎症部位,同时来源于HP的中性粒细胞激活蛋白(neutrophilactivating protein,NAP)能诱导活化MC脱颗粒及合成释放炎症介质,如白细胞素-6(IL-6)。de Bernard等[16]发现VacA毒素能活化 MC释放炎性介质肿瘤坏死因子α(TNF-α)及IL-6。一些研究显示IL-6在结肠炎相关肿瘤早期发挥重要作用,通过NF-ΚB-IL6-STAT3途径能促进肿瘤始发细胞的增殖及抑制其凋亡。同时越来越多的证据显示TNF-α也能促进肿瘤的形成[17]。由此可见,宿主炎症反应中MC可能参与了HP感染诱导的肿瘤发生和进展。早期趋化活化MC释放各种炎症介质(如IL-6、TNF-α等)重构肿瘤炎症微环境或者与肿瘤细胞、肿瘤组织内其他细胞直接或间接作用,亦或者降解微环境基质及介导脉管新生,甚至微粒、外泌体介导肿瘤细胞或其他细胞功能作用。
肿瘤患者的预后与肿瘤类型、分期、分化程度、有无转移浸润等因素有关。近年许多研究者分析MC与肿瘤患者生存期的关系,认为MC可作为独立的肿瘤预后指标,但是存在争议。Ju等[18]研究肝癌时发现,肿瘤组织中浸润MC越多患者的预后越差。Xia等[19]研究发现ⅢB期结肠癌患者生存期与肿瘤组织中MC数目无关。本研究将胃癌患者依据组织MC中位数将其分为2组并分析其与生存期的关系,发现MC高水平组与MC低水平组的生存期无明显差异(P=0.867),与Xia等[19]的研究结果一致;癌前病变组织中MC数量虽明显高于胃癌组,但MC高水平组和低水平组的生存期比较亦无明显差异(P=0.087)。因此,单纯MC数量不能作为单独的肿瘤预后指标。
本研究发现胃癌前病变组织中MC数量高于胃癌和胃良性病变,说明MC与肿瘤早期形成有关,尤其是HP感染诱发的肿瘤。MC可能成为肿瘤早期诊断治疗干预的新靶点。同时MC与肿瘤患者的生存期无相关性,因此不能作为独立的肿瘤预后指标。由于本研究样本量较少,具有一定的局限性。MC与肿瘤的关系需进一步研究证实。此研究也有助于我们进一步认识胃癌的形成和发展机制。
[1]Grivennikov SI,Greten FR,Karin M.Immunity,inflammation,and cancer[J].Cell,2010,140(6):883-899.
[2]Oshima H,Oshima M.The inflammatory network in the gastrointestinal tumor microenvironment:lessons from mouse models[J].J Gastroenterol,2012,47(2):97-106.
[3]Khazaie K,Blatner NR,Khan MW,etal.The significant role of mast cells in cancer[J].Cancer Metastasis Rev,2011,30(1):45-60.
[4]Liu J,Zhang Y,Zhao J,etal.Mast cell:insight into remodeling a tumor microenvironment[J].Cancer Metastasis Rev,2011,30(2):177-184.
[5]Fox JG,Wang TC.Inflammation,atrophy,and gastric cancer[J].J Clin Invest,2007,117(1):60-69.
[6]卢灿荣,张士武,张 勇,等.癌胚抗原、糖链抗原72-4和胃蛋白酶原联合检测评价胃癌的诊断价值[J].检验医学,2012,27(6):442-444.
[7]Giovannucci E,Egan KM,Hunter DJ,etal.Aspirin and the risk of colorectal cancer in women[J].N Engl JMed,1995,333(10):609-614.
[8]Zabaleta J.Multifactorial etiology of gastric cancer[J].Methods Mol Biol,2012,863:411-435.
[9]Ribatti D,Guidolin D,Marzullo A,etal.Mast cells and angiogenesis in gastric carcinoma[J].Int J Exp Pathol,2010,91(4):350-356.
[10]Theoharides TC,Conti P.Mast cells:the Jekyll and Hyde of tumor growth[J].Trends Immunol,2004,25(5):235-241.
[11]Soucek L,Lawlor ER,Soto D,etal.Mast cells are required for angiogenesis and macroscopic expansion of Myc-induced pancreatic islet tumors[J].Nat Med,2007,13(10):1211-1218.
[12]Gounaris E,Erdman SE,Restaino C,etal.Mast cells are an essential hematopoietic component for polyp development[J].Proc Natl Acad Sci USA,2007,104(50):19977-19982.
[13]沈悦娣,张卫平,丁 伟,等.急性白血病Ki-67的表达研究[J].检验医学,2004,19(6):544-545.
[14]Nakajima S,Bamba N,Hattori T.Histological aspects and role of mast cells in Helicobacter pylori-infected gastritis[J].Aliment Pharmacol Ther,2004,20(Suppl 1):165-170.
[15]Varon C,Dubus P,Mazurier F,etal.Helicobacter pylori infection recruits bone marrow-derived cells that participate in gastric preneoplasia in mice[J].Gastroenterology,2012,142(2):281-291.
[16]De Bernard M,Cappon A,Pancotto L,etal.The Helicobacter pylori VacA cytotoxin activates RBL-2H3 cells by inducing cytosolic calcium oscillations[J].Cell Microbiol,2005,7(2):191-198.
[17]Balkwill F.Tumour necrosis factor and cancer[J].Nat Rev Cancer,2009,9(5):361-371.
[18]Ju MJ,Qiu SJ,Gao Q,etal.Combination of peritumoral mast cells and T-regulatory cells predicts prognosis of hepatocellular carcinoma[J].Cancer Sci,2009,100(7):1267-1274.
[19]Xia Q,Wu XJ,Zhou Q,etal.No relationship between the distribution of mast cells and the survival of stageⅢB colon cancer patients[J].J Transl Med,2011,9:88.
