长期有氧运动对慢性心力衰竭大鼠心肌能量代谢的调节
2013-11-19王勇马延超
王勇,马延超
(1.潍坊学院 体育学院,山东 潍坊 261061;2.洛阳师范学院 体育学院,河南 洛阳 471022)
心肌细胞代谢性重塑是心力衰竭(heart failure,HF)发生发展的重要机制。HF时心肌脂肪酸(fatty acid,FA)氧化减少、葡萄糖利用增加[1],能量代谢的效率增加,这是心肌的自我保护机制。但同时糖酵解代谢增强,乳酸产生增多造成酸中毒与心肌损害,FA利用减少,脂质在心脏沉积并造成心肌细胞凋亡与脂毒性心脏异常[2],加之HF时线粒体生物合成减少[3],能量生成进一步下降,即所谓的心肌能量饥渴(energy starvation)[4],心功能继之恶化,因此心肌代谢性重塑又加速了HF进程。
有氧运动可改善HF患者心肌代谢异常,但具体分子机制尚未明确。AMPK(磷酸腺苷活化蛋白激酶)是一种调节细胞内能量代谢的酶类,其主要作用是通过激活下游信号转导途径促进能量产生,维持细胞的能量平衡稳态。研究发现,AMPK在心脏的正常发育以及心肌代谢过程中起重要作用,同时对心肌缺血-再灌注损伤起保护作用[5]。关于运动与 AMPK关系的研究主要集中在骨骼肌组织,而在心肌表达的研究较少,Coven等[6]和Musi等[7]发现,一次急性运动可上调正常心肌AMPK活性或表达量,并呈现运动强度依赖性,提示AMPK在心肌能量代谢以及对运动适应中起重要作用。但长期运动对HF心脏AMPK表达及对能量代谢的影响未见报道。本研究以心梗后慢性HF大鼠为模型,观察8周有氧运动对心功能、心肌糖原、FA和乳酸含量以及 AMPKα、PPARα、CPT-1、GLUT4、PGC-1α基因表达的影响,探讨长期有氧运动对HF心脏代谢性重塑的影响及可能机制。
1 研究对象和方法
1.1 实验动物
SPF级SD大鼠45只,体质量260~320 g,雌雄各半,由北京维通利华实验动物中心提供,分笼饲养,自由进食水。
1.2 心梗后HF模型的建立
大鼠随机分为心梗组(MI组,30只)和假手术组(Sham组,15只)。心梗组采用冠状动脉结扎术方法:麻醉后连接呼吸机,开胸暴露心脏,由左心耳下方2~3 mm处用0号丝线结扎左冠状动脉前降支。Sham组只开胸穿线,不结扎,其他操作同MI组。MI组再随机分为心梗对照组(MI-Sed组)和心梗运动组(MI-Ex组),每组各15只。Sham组和MI-Sed组保持安静状态,MI-Ex组进行为期8周的运动训练。
1.3 有氧运动方案
采用Bedford等建立的大鼠跑台运动方案:即5 min热身(坡度为0°,速度为5 m/min)后,坡度调为5°,速度为 10 m/min(相当于 45%VO2max),第 1天训练 15 min、第2天30 min、第3天45 min,从第4天开始均为60 min。5 d/周,共训练8周。
1.4 血流动力学参数(心功能)测定
腹腔麻醉大鼠,心导管插管至左心室,连接压力换能器,利用多媒体生物信号采集处理系统记录左心室收缩期压力(LVSP)、左心室舒张末期压力(LVEDP)、左心室压力最大上升速率(+(dp/dt)max)和左室压力最大下降速率(-(dp/dt)max)。
1.5 取材
大鼠断头处死后取心脏,用生理盐水冲洗,滤纸沾干后迅速将组织置于液氮中并转移至-80 ℃冰箱冻存待测。
1.6 心肌FA、糖原和乳酸测定
均采用比色法测定心肌匀浆液中糖原质量分数、FA浓度和乳酸质量摩尔浓度,严格按照试剂盒(南京建成生物工程研究所)操作说明进行。单位分别为:mg/g、mmol/L、μmmol/g。
1.7 实时荧光定量 PCR检测心肌 PPARα和 CPT-1 mRNA水平
将心肌匀浆后,用Trizol法抽提总RNA,逆转录反应获得cDNA,实时荧光定量PCR(ABI 7900HT型荧光定量PCR仪,美国)测定PPARα和CPT-1 mRNA含量,引物序列见表1,扩增条件:预变性95 ℃,1 min;94 ℃,30 s;54 ℃,30 s;72 ℃,1 min。共40个循环。以β-actin作为内参,计算相对表达量。

表1 引物序列及产物长度
1.8 Western blot测定心肌总AMPKα蛋白、磷酸化AMPK α蛋白(p-AMPKα)、GLUT4和PGC-1α表达水平
裂解细胞后提取细胞总蛋白,采用BCA法进行蛋白定量。灌制10%的分离胶和5%的浓缩胶,恒压120 V、80 mA预电泳10 min,上样,进行SDS-PAGE电泳,转移至PVDF膜上。5%脱脂奶粉室温封闭1 h,兔抗大鼠 AMPKα、AMPKα-Thr172磷酸化、GLUT4和 PGC-1α多克隆抗体于 4 ℃孵育过夜,TBST洗涤PVDF膜。加二抗后室温孵育1 h,暗室中滴加发光底物混合物2 mL于PVDF膜上,曝光、显影、定影。对目的蛋白进行光密度分析,以β-actin为内参。目的蛋白相对含量=目的蛋白灰度值/β-actin蛋白灰度值。
1.9 心肌组织病理学观察
沿心脏长轴将心尖至结扎点取2 mm厚组织制作切片,40 g/L多聚甲醛固定,石蜡包埋,Masson染色,普通光镜观察各组心肌组织病理学变化。
1.10 统计学分析
所有数据使用SPSS 15.0统计软件进行数据分析。数据以“平均数±标准差”表示,使用单因素方差分析进行统计学检验,各组两两比较使用LSD检验。显著性水平定为P<0.05,非常显著水平定为P<0.01。
2 结果及分析
2.1 大鼠血流动力学参数的变化
表2结果显示,与Sham组比较,MI-Sed组LVSP、±(dp/dt)max显著性下降(均为P<0.01),LVEDP则显著性升高(P<0.01);与MI-Sed组比较,MI-Ex组LVSP、±(dp/dt)max显著性升高(均为P<0.01),LVEDP则显著性下降(P<0.01)。
表2 有氧运动对大鼠血流动力学参数的影响
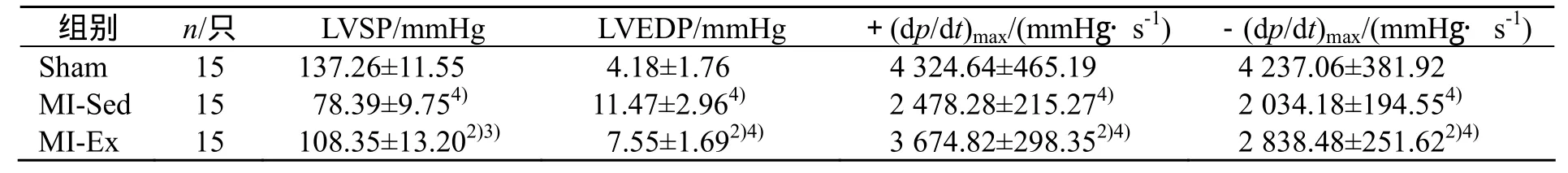
表2 有氧运动对大鼠血流动力学参数的影响
与MI-Sed组比较,1)P<0.05,2)P<0.01;与Sham组比较,3)P<0.05,4)P<0.01
组别 n/只 LVSP/mmHg LVEDP/mmHg +(dp/dt)max/(mmHg·s-1) -(dp/dt)max/(mmHg·s-1)Sham 15 137.26±11.55 4.18±1.76 4 324.64±465.19 4 237.06±381.92 MI-Sed 15 78.39±9.754) 11.47±2.964) 2 478.28±215.274) 2 034.18±194.554)MI-Ex 15 108.35±13.202)3) 7.55±1.692)4) 3 674.82±298.352)4) 2 838.48±251.622)4)
2.2 心肌糖原、FA和乳酸含量的变化
与 Sham组比较,MI-Sed组糖原质量分数降低(P<0.01),FA浓度和乳酸质量摩尔浓度升高(均为P<0.01);与 MI-Sed组比较,MI-Ex组糖原质量分数升高(P<0.05),FA浓度和乳酸质量摩尔浓度下降(均为P<0.01)(见表 3)。
表3 大鼠心肌糖原质量分数、FA浓度和乳酸质量摩尔浓度的变化
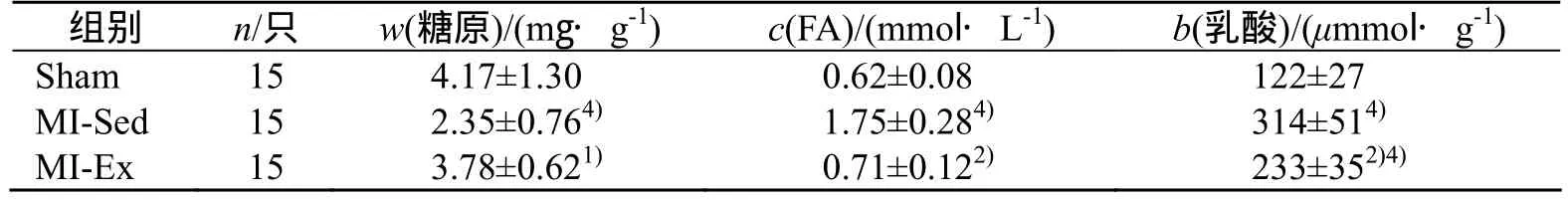
表3 大鼠心肌糖原质量分数、FA浓度和乳酸质量摩尔浓度的变化
与MI-Sed组比较,1)P<0.05,2)P<0.01;与Sham组比较,3)P<0.05,4)P<0.01
组别 n/只 w(糖原)/(mg·g-1) c(FA)/(mmol·L-1) b(乳酸)/(μmmol·g-1)Sham 15 4.17±1.30 0.62±0.08 122±27 MI-Sed 15 2.35±0.764) 1.75±0.284) 314±514)MI-Ex 15 3.78±0.621) 0.71±0.122) 233±352)4)
2.5 心脏组织病理学改变
Masson染色显示。Sham组心肌细胞着色均匀,无明显胶原成分。MI-Sed组心肌纤维化程度明显,只有少量心肌细胞。MI-Ex组较 MI-Sed组心肌细胞增多,胶原纤维显著减少(见图1)。
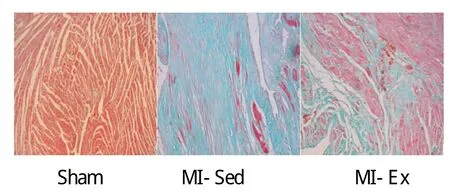
图1 各组心肌组织病理学变化
2.6 心肌PPARα和CPT-1 mRNA的变化
心肌PPARα和CPT-1 mRNA的变化规律一致,即MI-Sed组显著低于Sham组(P<0.01),MI-Ex组显著高于MI-Sed组(P<0.01)(见图2)。
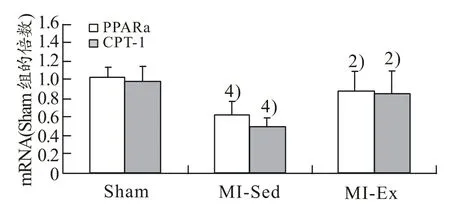
图2 心肌PPARα和CPT-1 mRNA的变化
2.7 心肌总AMPKα、p-AMPKα、GLUT4和PGC-1α蛋白的变化
心肌总 AMPKα蛋白在各组差异无显著性(P>0.05)。p-AMPKα在 MI-Sed组高于 Sham 组(P<0.05),MI-Ex组则分别高于MI-Sed组和Sham组(P<0.01)。GLUT4和 PGC-1α变化趋势一致,即在MI-Sed组低于 Sham 组(P<0.01),在 MI-Ex组高于MI-Sed 组(P<0.01)(见图 3)。
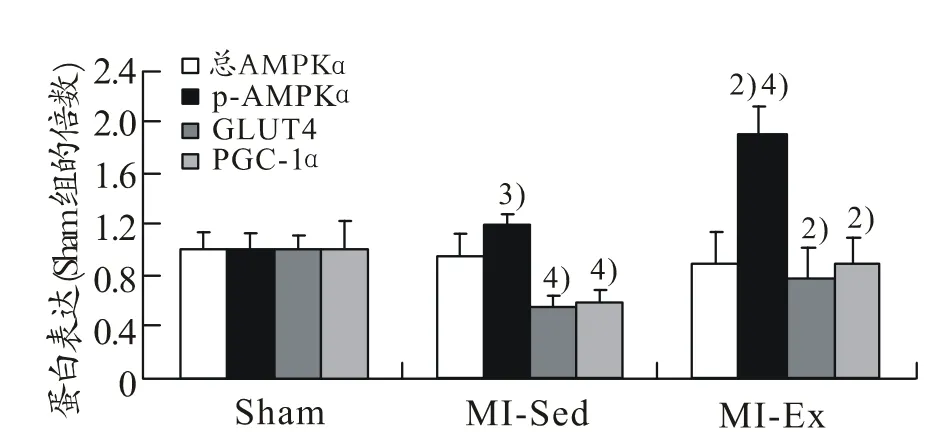
图3 心肌总AMPKα、p-AMPKα、GLUT4和PGC-1α蛋白的变化
3 讨论
本研究探讨了长期有氧运动对HF大鼠心肌能量代谢的影响发现,运动通过活化AMPK,上调下游靶分子(GLUT4、PPARα、CPT-1和PGC-1α)的基因表达,进而促进 FA利用、葡萄糖摄取与有氧氧化、线粒体生物合成增加、心肌有氧代谢能力提高,减少了心脏脂质沉积与乳酸堆积,因此改善了HF后心脏代谢性重塑并提高心功能。
3.1 HF后心肌代谢性重塑及运动的良性效应
本研究成功建立心梗后HF模型,即MI-Sed组表现出典型的心梗后心室舒缩功能下降(LVSP、±(dp/dt)max显著性下降,LVEDP则显著性升高),同时心肌糖原质量分数减少、FA浓度堆积、乳酸升高、线粒体生物合成减少。8周有氧运动后,与MI-Sed组比较,MI-Ex组心功能改善(LVEDP显著性降低,LVSP、±(dp/dt)max显著性升高),糖原质量分数升高,FA浓度和乳酸质量摩尔浓度下降。上述结果提示,心梗后HF心脏发生代谢性重塑,能量产生减少、酸中毒和脂毒性造成心功能进一步下降,有氧运动则延缓了这一病理过程的发生,这与临床流行病学的研究一致[8-9]。但运动如何通过调节能量代谢进而改善心功能,至今仍不清楚。由于AMPK在心肌能量代谢中起关键作用且运动应激可使其活化[6-7],因此,推测运动诱导的AMPK上调可能参与了对HF后心肌代谢性重塑的调节。
3.2 运动诱导的AMPK信号通路参与了HF大鼠心肌能量的调节
研究表明,AMPK在心脏的正常发育以及心肌代谢过程中起重要作用,同时对心肌缺血-再灌注损伤起保护作用[5,10]。运动时,AMP与ATP比值升高诱导AMPK活化[6],因此一次急性运动可活化AMPK[7],并呈现运动强度依赖性,提示AMPK在心肌能量代谢以及对运动适应中起重要作用,但长期运动训练对病理心脏AMPK表达的影响尚无报道。在本研究中,经过8周运动训练,总AMPKα蛋白在各组差异无显著性,p-AMPKα(AMPK磷酸化后才能被激活,所以只有p-AMPKα具有生物活性)在MI-Ex组显著高于MI-Sed组和Sham组,说明长期有氧运动可持续上调AMPK表达水平,这与长期运动可提高骨骼肌、脂肪与肝脏AMPK活性的研究结果相似[11-12],同时提示,AMPK在运动改善HF大鼠代谢性重塑中扮演重要角色。
1)运动活化AMPK-PGC-1α信号通路与线粒体生物合成。
正常心肌细胞的主要供能物质是 FA,可产生60%~70%ATP,其余大约30%ATP由葡萄糖代谢供给,因此,线粒体在心肌细胞供能过程中起着至关重要的作用。PGC-1α是调节线粒体生物合成的关键性信号分子,其表达增加激活包括核呼吸因子(NRFs)及线粒体转录因子A(Tfam)在内的一组转录因子,启动线粒体DNA复制和转录而诱导线粒体生物合成[13]。AMPK作为PGC-1α的上游信号分子,可上调其表达[14]。本研究发现,MI-Sed组PGC-1α蛋白水平显著低于Sham组,提示HF时线粒体生物合成减少,这与前人的研究一致[3]。MI-Ex组p-AMPKα和PGC-1α均较MI-Sed组显著升高,推测长期有氧运动可激活AMPK-PGC-1α信号通路,促进心肌线粒体生物合成[15]。临床研究指出,运动能力下降、易疲劳和肌无力是影响HF患者生活质量的主要因素,这与HF时心输出量和最大摄氧量(VO2max)降低以及有氧代谢能力下降密切相关。而PGC-1α上调使线粒体容积密度增加并与 HF患者VO2max和无氧阈的变化正相关[16]。因此,运动诱导AMPK-PGC-1α上调改善了HF时能量产生,心脏收缩功能和有氧能力(VO2max)随之提高[17],为代谢性重塑的良性变化奠定了物质基础。
2)运动活化AMPK-PPARα信号通路与FA代谢。
FA是正常心肌安静时的主要能量底物,PPARα能够调控编码心肌线粒体大部分 FA氧化酶的基因表达[18],其中CPT-1催化长链FA进入线粒体,是决定FA氧化的限速酶之一。最新的研究指出,PPARα是AMPK下游的靶分子,即AMPK可上调PPARα表达,两者构成AMPK-PPARα信号通路,对维持心肌能量代谢稳态发挥重要作用[19-20]。此外,AMPK还可激活PGC1α,PGC1α作为转录协同激活因子,与PPARα结合促进FA代谢酶的表达。
研究证实,压力过负荷HF模型8周后,PPARα mRNA和蛋白水平均显著低于对照组[19]。本研究发现,虽然MI-Sed组AMPK有一定程度升高,但PPARα mRNA在MI-Sed组显著低于Sham组,提示少量活化的AMPK不足以上调PPARα或者存在其他网络式信号转导途径(如PGC1α下调)。伴随CPT-1的表达下调,心肌FA含量显著升高,这是HF时FA利用减少的重要分子机制。HF时FA供能减少,一方面,可减少缺血缺氧状态下心肌氧耗(FA氧化耗氧量多于葡萄糖),但同时可造成脂质在心脏沉积,诱导心肌细胞凋亡和脂毒性心脏异常。临床研究发现,HF患者心肌内出现明显的脂质沉积,而且心肌细胞间脂质沉积与收缩功能失调及心功能衰竭有关[2]。
耐力运动可上调心脏 PPARα表达水平[21],与本研究结果一致,即经过8周有氧运动,MI-Ex组PPARα、CPT-1 mRNA水平显著高于MI-Sed组,说明长期有氧运动激活了 AMPK-PPARα信号通路,加之 PGC1 α上调、线粒体生物合成增加使心肌能够更有效的氧化、利用FA供能,心脏FA含量显著降低,减轻了心脏脂质沉积并改善脂毒性心脏异常。
3)运动活化 AMPK-GLUT4信号通路与葡萄糖代谢。
葡萄糖代谢约占正常心肌能量代谢的1/3。AMPK可通过上调 GLUT4表达以及转位而促进葡萄糖摄取并增强糖酵解作用[22]。本研究发现,HF时GLUT4蛋白表达下调,这与Tian等[19]的研究结果一致,他们还发现,虽然GLUT4总蛋白降低,但肌膜上的GLUT4占总蛋白的百分比却增加,提示HF时AMPK代偿性增加可促进 GLUT4向肌膜转位,从而增加葡萄糖摄取。然而由于 GULT4总量减少,GLUT4在肌膜的相对增多并不能满足HF时心肌的能量供应。HF时糖酵解效率明显增强,心肌糖原含量减少,乳酸堆积增多、酸中毒进一步影响心功能[23]。
一次急性运动可上调GLUT4表达[24],其意义在于通过增强糖酵解作用及时为心肌提供能量(糖酵解供能效率均较 FA和糖有氧氧化高)。但长期运动上调GLUT4表达的意义可能不同于一次急性运动。在本研究中,MI-Ex组GLUT4蛋白水平显著高于MI-Sed组,提示长期有氧运动通过活化AMPK促进GLUT4表达,葡萄糖摄取增加。与此同时,MI-Ex组心肌乳酸含量较MI-Sed组显著性降低(但仍高于Sham组),说明长期有氧运动促使HF时糖酵解供能向糖有氧氧化供能转变。其可能机制是长期运动通过增加线粒体生物合成、舒张血管(特别是冠状动脉)增加血流量,机体的有氧代谢能力增强,同时FA氧化利用增加又可通过葡萄糖-脂肪酸循环[25]抑制糖酵解的关键酶——丙酮酸脱氧酶和磷酸果糖激酶,使糖酵解供能逐渐转向糖有氧氧化供能。因此,心肌乳酸堆积减少,心功能随之改善。
HF时心肌能量代谢的特点是由优先利用FA转变为糖酵解供能为主并造成酸中毒和脂质沉积,同时线粒体生物合成减少,随着HF发展进程,脂肪酸与葡萄糖的利用均显著下降;运动则使FA氧化、葡萄糖利用以及线粒体生物合成均增加,这是心肌对长期训练适应的结果。
综上所述,长期有氧运动通过激活AMPK及其下游信号通路改善了HF心脏的代谢性重塑并提高运动心功能。
[1] van B M,van N F A,der Vusse G J. Metabolic remodelling of the failing heart: beneficial or detrimen-tal?[J]. Cardiovasc Res,2009,81(3):420-428.
[2] Sharma S,Adrogue J V,Golfman L,et al. Intramyocardial lipid accumulation in the failing human heart resembles the lipotoxic rat heart[J]. FASEB J,2004,18(14):1692-1700.
[3] Garnier A,Fortin D,Delomenie C,et al. Depressed mitochondrial transcription factors and oxidative capacity in rat failing cardiac and skeletal muscles[J]. J Physiol,2003,551(Pt 2):491-501.
[4] Neubauer S. The failing heart-an engine out of fuel[J].N Engl J Med,2007,356(11):1140-1151.
[5] Kim A S,Miller E J,Young L H. AMP-activated protein kinase: a core signalling pathway in the heart[J].Acta Physiol (Oxf),2009,196(1):37-53.
[6] Coven D L,Hu X,Cong L,et al. Physiological role of AMP-activated protein kinase in the heart: graded activation during exercise[J]. Am J Physiol Endocrinol Metab,2003,285(3):E629-636.
[7] Musi N,Hirshman M F,Arad M,et al. Functional role of AMP-activated protein kinase in the heart during exercise[J]. FEBS Lett,2005,579(10):2045-2050.
[8] Keteyian S J. Exercise training in congestive heart failure: risks and benefits[J]. Prog Cardiovasc Dis,2011,53(6):419-428.
[9] Yeh G Y,McCarthy E P,Wayne P M,et al. Tai chi exercise in patients with chronic heart failure: a randomized clinical trial[J]. Arch Intern Med,2011,171(8):750-757.
[10] Lopaschuk G D. AMP-activated protein kinase control of energy metabolism in the ischemic heart[J]. Int J Obes (Lond),2008,32(Suppl 4):S29-35.
[11] Langfort J,Viese M,Ploug T,et al. Time course of GLUT4 and AMPK protein expression in human skeletal muscle during one month of physical training[J]. Scand J Med Sci Sports,2003,13(3):169-174.
[12] Takekoshi K,Fukuhara M,Quin Z,et al. Long-term exercise stimulates adenosine monophosphate-activated protein kinase activity and subunit expression in rat visceral adipose tissue and liver[J]. Metabolism,2006,55(8):1122-1128.
[13] 韩雨梅,张勇. PGC-1α在运动诱导骨骼肌线粒体生物合成中的调控作用[J]. 中国运动医学杂志,2010,29(4):494-497.
[14] Scarpulla R C. Metabolic control of mitochondrial biogenesis through the PGC-1 family regulatory network[J].Biochim Biophys Acta,2011,1813(7):1269-1278.
[15] Kemi O J,Hoydal M A,Haram P M,et al. Exercise training restores aerobic capacity and energy transfer systems in heart failure treated with losartan[J]. Cardiovasc Res,2007,76(1):91-99.
[16] Garnier A,Fortin D,Zoll J,et al. Coordinated changes in mitochondrial function and biogenesis in healthy and diseased human skeletal muscle[J]. FASEB J,2005,19(1):43-52.
[17] Wisloff U,Loennechen J P,Currie S,et al. Aerobic exercise reduces cardiomyocyte hypertrophy and increases contractility,Ca2+sensitivity and SERCA-2 in rat after myocardial infarction[J]. Cardiovasc Res,2002,54(1):162-174.
[18] Madrazo J A,Kelly D P. The PPAR trio: regulators of myocardial energy metabolism in health and disease[J]. J Mol Cell Cardiol,2008,44(6):968-975.
[19] Meng R S,Pei Z H,Yin R,et al. Adenosine monophosphate-activated protein kinase inhibits cardiac hypertrophy through reactivating peroxisome proliferator-activated receptor-alpha signaling pathway[J]. Eur J Pharmacol,2009,620(1-3):63-70.
[20] Meng R,Pei Z,Zhang A,et al. AMPK activation enhances PPARalpha activity to inhibit cardiac hypertrophy via ERK1/2 MAPK signaling pathway[J]. Arch Biochem Biophys,2011,511(1-2):1-7.
[21] 方子龙,陈敏,张志文,等. 耐力训练和注射丙酸睾酮对雄性大鼠肝脏、心脏和腓肠肌PPARα表达的影响[J]. 天津体育学院学报,2006,21(3):197-200.
[22] Bergeron R,Shulman G I. Translocation of myocardial GLUT-4 and increased glucose uptake through activation of AMPK by AICAR[J]. Am J Physiol,1999,277(2 Pt 2):H643-649.
[23] Dolinsky V W,Dyck J R. Role of AMP-activated protein kinase in healthy and diseased hearts[J]. Am J Physiol Heart Circ Physiol,2006,291(6):H2557-2569.
[24] 龚豪杰,谢谨,张楠,等. 不同强度运动对AMPKα2三种不同基因状态鼠MEF2/GLUT4DNA结合活性的影响[J]. 体育科学,2011,31(2):55-63.
[25] 房冬梅,冯美云. 运动对心肌组织能量代谢的影响[J]. 体育科研,2002,23(4):16-18.
